Etiologia
O fator etiológico primário envolvido no esôfago de Barrett é o refluxo gastroesofágico. No entanto, há evidências de que o refluxo combinado de ácido e bile são os principais agentes causadores. Em um estudo de pacientes com doença do refluxo gastroesofágico, mais de 50% apresentaram níveis anormais de bile no esôfago.[12] O nível mais alto de bile esofágica foi encontrado em pacientes com esôfago de Barrett, e cerca de metade dos pacientes com esôfago de Barrett com exposição anormal à bile esofágica tiveram níveis normais de bile no estômago. O esôfago de Barrett e as lesões na mucosa esofágica em geral foram mais comuns em pacientes expostos a uma combinação de ácido e bile, e incomuns em pacientes expostos somente à bile. A lesão de mucosa foi menos comum em pacientes expostos ao ácido isoladamente, mas ainda significativamente mais frequente que o normal.[13]
Fisiopatologia
O American College of Gastroenterology define esôfago de Barrett como uma alteração no epitélio esofágico de qualquer extensão que possa ser reconhecida na endoscopia e tem metaplasia intestinal confirmada por biópsia do esôfago tubular e exclui metaplasia intestinal da cárdia.[14] No entanto, nem toda metaplasia intestinal é visível por endoscopia. O epitélio não caliciforme pode ser intestinalizado.[15] Gradualmente, estamos desenvolvendo uma melhor compreensão dos complexos mecanismos moleculares que estão envolvidos na conversão do epitélio esofágico escamoso normal em metaplasia intestinal, displasia e carcinoma.[16]
Para que o esôfago de Barrett se desenvolva, fatores ambientais devem interagir com características determinadas geneticamente. Como raramente o esôfago de Barrett é familiar (embora haja algumas famílias em que múltiplos indivíduos são afetados pelo esôfago de Barrett colocando-os em risco substancial de adenocarcinoma), é provável que essas características sejam variações normais (polimorfismo), em vez de uma única mutação genética.[17]
O mecanismo patogênico mais comumente aceito inclui o desenvolvimento de células-tronco colunares metaplásicas de uma fonte local (células-tronco do epitélio escamoso) ou da medula óssea (células-tronco derivadas da medula óssea). A origem das células-tronco do esôfago de Barrett pode explicar sua persistência e a predisposição a desenvolver adenocarcinoma. As origens propostas dessas células-tronco metaplásicas alteradas são:
a camada celular basal do epitélio escamoso
células-tronco que se originam na junção gastroesofágica e se proliferam em resposta a refluxo ácido e duodeno-gastroesofágico
células-tronco do colo das glândulas submucosas esofágicas que migram para a superfície do esôfago distal e nela se proliferam após a lesão na mucosa escamosa
migração das células-tronco de medula óssea para o epitélio lesionado.
Essas alterações podem ser mediadas pela ativação ou inativação de fatores de transcrição e modulação de vias de sinalização no nível celular. O refluxo gastroesofágico pode produzir alterações genéticas, resultando em aumento da produção de fatores de transcrição que promovem diferenciação celular intestinal (metaplasia) e diminuição da produção de fatores de transcrição que promovem diferenciação de células escamosas.[18]
Há vários genes candidatos cujas alterações podem causar o desenvolvimento da metaplasia intestinal.[19] A expressão do gene da ciclo-oxigenase-2 no epitélio escamoso do esôfago parece ser aumentada como resultado de refluxo e diminuída como resultado da cirurgia antirrefluxo.[20] Além disso, o fator de transcrição homeótico Cdx2 (homeobox 2 tipo caudal) foi descoberto como sendo o gene do "interruptor mestre" do epitélio intestinal. Sua perda ou deleção está associada ao desenvolvimento de metaplasia.[21]
Em última análise, a importância da metaplasia intestinal está no seu potencial maligno. Embora os mecanismos genéticos e moleculares exatos não tenham sido esclarecidos, parece que o refluxo intraluminal age como um estímulo pró-proliferativo causando as características genéticas e, mais importante, biológicas de neoplasias malignas. Elas incluem a ativação dos controladores de pH da superfície celular (por exemplo, trocadores sódio-hidrogênio), que provocam alterações na sinalização celular (por exemplo, o fator de transformação do crescimento beta, proteína quinase ativada por mitógenos e proteína quinase C), resultando na disfunção do gene p53, provocando evasão da apoptose. Essas células hiperproliferativas precisarão de angiogênese para manter o crescimento. Isso geralmente é mediado pelo gene da ciclo-oxigenase-2. Finalmente, espera-se que a compreensão dos eventos moleculares que ocorrem na sequência metaplasia-displasia-carcinoma leve ao conhecimento de biomarcadores que possam identificar pacientes destinados a desenvolver adenocarcinoma.[19] Embora seja claro que o esôfago de Barrett aumenta o risco de adenocarcinoma esofágico, a quantificação do risco tem sido difícil. Uma revisão sistemática definiu o risco em 6.3/1000 pessoas-ano, com um intervalo de confiança de 95% entre 4.7 e 8.4/1000 pessoas e heterogeneidade considerável dos dados.[22][Figure caption and citation for the preceding image starts]: Esôfago de Barrett; mucosa cor de salmão estendendo-se acima da junção gastroesofágica como uma coluna contínuaDa coleção pessoal do Dr. Vic Velanovich; usado com permissão [Citation ends].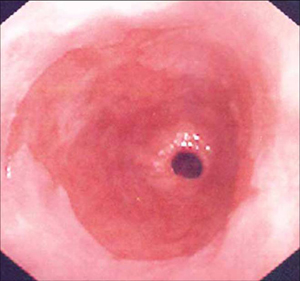 [Figure caption and citation for the preceding image starts]: Esôfago de Barrett; mucosa cor de salmão estendendo-se acima da junção gastroesofágica com uma borda acentuada irregularDa coleção pessoal do Dr. Vic Velanovich; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Esôfago de Barrett; mucosa cor de salmão estendendo-se acima da junção gastroesofágica com uma borda acentuada irregularDa coleção pessoal do Dr. Vic Velanovich; usado com permissão [Citation ends].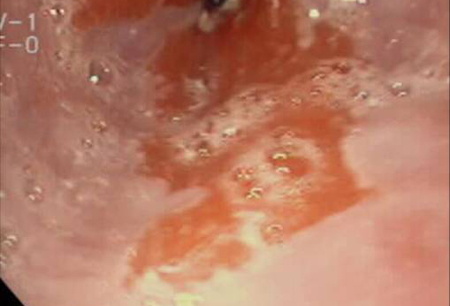 [Figure caption and citation for the preceding image starts]: Metaplasia de Barrett sem displasia, mostrando o epitélio colunar com células caliciformes da região superior à junção gastroesofágicaCortesia de Adrian Ormsby, MD, Henry Ford Hospital, Detroit, MI [Citation ends].
[Figure caption and citation for the preceding image starts]: Metaplasia de Barrett sem displasia, mostrando o epitélio colunar com células caliciformes da região superior à junção gastroesofágicaCortesia de Adrian Ormsby, MD, Henry Ford Hospital, Detroit, MI [Citation ends].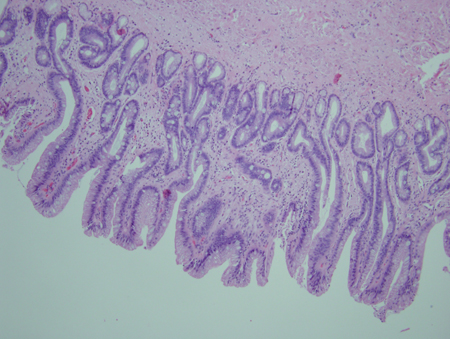 [Figure caption and citation for the preceding image starts]: Metaplasia de Barrett com displasia de baixo grau; células e núcleos mais irregularesCortesia de Adrian Ormsby, MD, Henry Ford Hospital, Detroit, MI [Citation ends].
[Figure caption and citation for the preceding image starts]: Metaplasia de Barrett com displasia de baixo grau; células e núcleos mais irregularesCortesia de Adrian Ormsby, MD, Henry Ford Hospital, Detroit, MI [Citation ends].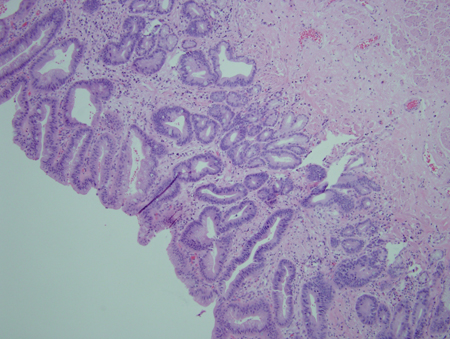 [Figure caption and citation for the preceding image starts]: Metaplasia de Barrett com displasia de alto grau; irregularidade mais avançada das célulasCortesia de Adrian Ormsby, MD, Henry Ford Hospital, Detroit, MI [Citation ends].
[Figure caption and citation for the preceding image starts]: Metaplasia de Barrett com displasia de alto grau; irregularidade mais avançada das célulasCortesia de Adrian Ormsby, MD, Henry Ford Hospital, Detroit, MI [Citation ends].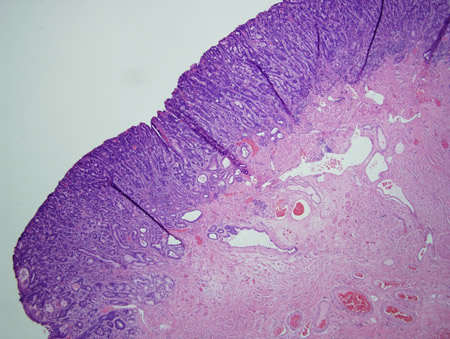 [Figure caption and citation for the preceding image starts]: Metaplasia de Barrett com displasia de alto grau associada a um foco de carcinoma intramucoso; células francamente malignas além da extensão da membrana basal envolvendo a lâmina própriaCortesia de Adrian Ormsby, MD, Henry Ford Hospital, Detroit, MI [Citation ends].
[Figure caption and citation for the preceding image starts]: Metaplasia de Barrett com displasia de alto grau associada a um foco de carcinoma intramucoso; células francamente malignas além da extensão da membrana basal envolvendo a lâmina própriaCortesia de Adrian Ormsby, MD, Henry Ford Hospital, Detroit, MI [Citation ends].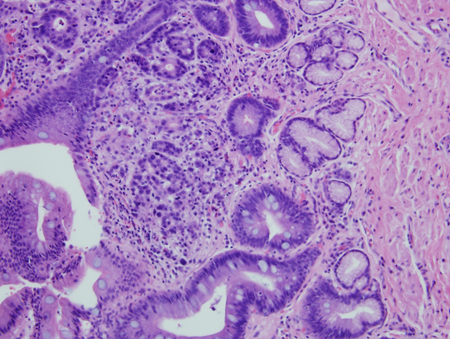
O uso deste conteúdo está sujeito ao nosso aviso legal