El tratamiento de la embolia pulmonar (EP) se basa en un enfoque diagnóstico algorítmico. Los antecedentes y la exploración física son relativamente insensibles e inespecíficos, por lo que se deben combinar con otras pruebas diagnósticas en el proceso de toma de decisiones clínicas.
Antecedentes
La anamnesis puede variar mucho entre individuos. Muchos reportarán un inicio agudo de molestias en el pecho o disnea, pero la EP puede presentarse con síntomas más inusuales, o incluso ser asintomática.[117]Pollack CV, Schreiber D, Goldhaber SZ, et al. Clinical characteristics, management, and outcomes of patients diagnosed with acute pulmonary embolism in the emergency department: initial report of EMPEROR (Multicenter Emergency Medicine Pulmonary Embolism in the Real World Registry). J Am Coll Cardiol. 2011 Feb 8;57(6):700-6.
http://www.onlinejacc.org/content/57/6/700
http://www.ncbi.nlm.nih.gov/pubmed/21292129?tool=bestpractice.com
Los síntomas que se presentan con mayor frecuencia son dolor torácico pleurítico y disnea.[117]Pollack CV, Schreiber D, Goldhaber SZ, et al. Clinical characteristics, management, and outcomes of patients diagnosed with acute pulmonary embolism in the emergency department: initial report of EMPEROR (Multicenter Emergency Medicine Pulmonary Embolism in the Real World Registry). J Am Coll Cardiol. 2011 Feb 8;57(6):700-6.
http://www.onlinejacc.org/content/57/6/700
http://www.ncbi.nlm.nih.gov/pubmed/21292129?tool=bestpractice.com
[118]Bajaj N, Bozarth AL, Guillot J, et al. Clinical features in patients with pulmonary embolism at a community hospital: analysis of 4 years of data. J Thromb Thrombolysis. 2014 Apr;37(3):287-92.
http://www.ncbi.nlm.nih.gov/pubmed/23681675?tool=bestpractice.com
Con frecuencia se informa una sensación de ansiedad.[4]Bell WR, Simon TL, DeMets DL. The clinical features of submassive and massive pulmonary emboli. Am J Med. 1977 Mar;62(3):355-60.
http://www.ncbi.nlm.nih.gov/pubmed/842555?tool=bestpractice.com
[119]Stein PD, Willis PW 3rd, DeMets DL. History and physical examination in acute pulmonary embolism in patients without preexisting cardiac or pulmonary disease. Am J Cardiol. 1981 Feb;47(2):218-23.
http://www.ncbi.nlm.nih.gov/pubmed/7468469?tool=bestpractice.com
La hemoptisis y el síncope son menos frecuentes; este último sugiere una mayor carga de coágulos, una disfunción ventricular derecha más importante y un peor pronóstico.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
[117]Pollack CV, Schreiber D, Goldhaber SZ, et al. Clinical characteristics, management, and outcomes of patients diagnosed with acute pulmonary embolism in the emergency department: initial report of EMPEROR (Multicenter Emergency Medicine Pulmonary Embolism in the Real World Registry). J Am Coll Cardiol. 2011 Feb 8;57(6):700-6.
http://www.onlinejacc.org/content/57/6/700
http://www.ncbi.nlm.nih.gov/pubmed/21292129?tool=bestpractice.com
[118]Bajaj N, Bozarth AL, Guillot J, et al. Clinical features in patients with pulmonary embolism at a community hospital: analysis of 4 years of data. J Thromb Thrombolysis. 2014 Apr;37(3):287-92.
http://www.ncbi.nlm.nih.gov/pubmed/23681675?tool=bestpractice.com
Deben determinarse los factores de riesgo de tromboembolismo venoso (TEV).
Signos y exploración física
Los signos de la EP incluyen taquicardia, taquipnea, aumento del esfuerzo respiratorio, fiebre (generalmente de bajo grado) y, en casos más graves, hipotensión y signos de hipoperfusión (shock).
La exploración física a menudo es inespecífica.[117]Pollack CV, Schreiber D, Goldhaber SZ, et al. Clinical characteristics, management, and outcomes of patients diagnosed with acute pulmonary embolism in the emergency department: initial report of EMPEROR (Multicenter Emergency Medicine Pulmonary Embolism in the Real World Registry). J Am Coll Cardiol. 2011 Feb 8;57(6):700-6.
http://www.onlinejacc.org/content/57/6/700
http://www.ncbi.nlm.nih.gov/pubmed/21292129?tool=bestpractice.com
En casos graves, pueden presentarse hallazgos de sobrecarga ventricular derecha, como pulsación venosa yugular elevada, pérdida de palpabilidad del vértice ventricular izquierdo (debido al desplazamiento posterior del ventrículo izquierdo por agrandamiento del ventrículo derecho) y un tercer ruido cardíaco del lado derecho.
La EP que ha progresado durante un período de tiempo puede presentarse con hallazgos físicos de hipertensión pulmonar, como un tirón ventricular derecho, un soplo holosistólico de regurgitación tricuspídea, un componente pulmonar fuerte del segundo ruido cardíaco, un aumento de la presión venosa yugular y edema con fóvea en las extremidades.[120]Courtney DM, Kline JA, Kabrhel C, et al. Clinical features from the history and physical examination that predict the presence or absence of pulmonary embolism in symptomatic emergency department patients: results of a prospective, multicenter study. Ann Emerg Med. 2010 Apr;55(4):307-15.e1.
https://www.doi.org/10.1016/j.annemergmed.2009.11.010
http://www.ncbi.nlm.nih.gov/pubmed/20045580?tool=bestpractice.com
[121]Bajaj R, Ramanakumar A, Mamidala S, et al. Successful treatment of mobile right atrial thrombus and acute pulmonary embolism with intravenous tissue plasminogen activator. BMJ Case Rep. 2013 Jul 25;2013:bcr2013010255.
http://www.ncbi.nlm.nih.gov/pubmed/23892824?tool=bestpractice.com
[122]Matthews JC, McLaughlin V. Acute right ventricular failure in the setting of acute pulmonary embolism or chronic pulmonary hypertension: a detailed review of the pathophysiology, diagnosis, and management. Curr Cardiol Rev. 2008 Feb;4(1):49-59.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2774585
http://www.ncbi.nlm.nih.gov/pubmed/19924277?tool=bestpractice.com
Dado que la EP se origina con mayor frecuencia en las trombosis venosas profundas (TVP) de las extremidades inferiores, puede haber hallazgos físicos de esta afección.
Pacientes con sospecha de EP con shock o hipotensión
El shock (hipoperfusión de órganos dianas y una PA sistólica <90 mmHg o necesidad de vasopresores para mantener la PA sistólica >90 mmHg) o la hipotensión (PA sistólica <90 mmHg o disminución >40mmHg respecto al valor inicial conocido durante al menos 15 minutos) se producen en una minoría de casos, pero son pronóstico de un alto riesgo de mortalidad.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
Más del 95% de los pacientes que presentan EP aguda son hemodinámicamente estables.[123]Laporte S, Mismetti P, Décousus H, et al; RIETE Investigators. Clinical predictors for fatal pulmonary embolism in 15,520 patients with venous thromboembolism: findings from the Registro Informatizado de la Enfermedad TromboEmbolica venosa (RIETE) Registry. Circulation. 2008 Apr 1;117(13):1711-6.
http://circ.ahajournals.org/content/117/13/1711.long
http://www.ncbi.nlm.nih.gov/pubmed/18347212?tool=bestpractice.com
Lo idóneo es confirmar la EP mediante angiografía pulmonar por tomografía computarizada (APTC) antes de que se administre el tratamiento trombolítico.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
[124]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.
http://www.onlinejacc.org/content/67/8/976
http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com
Sin embargo, una gammagrafía pulmonar de V/P negativa descarta efectivamente la EP y es un procedimiento ahorrador de radiación y medio; pero la adquisición de imágenes lleva mucho más tiempo que la APTC.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
Si el paciente corre el riesgo de sufrir un paro cardíaco inminente, se puede iniciar el tratamiento únicamente basándose en razones clínicas.[125]British Thoracic Society Standards of Care Committee Pulmonary Embolism Guideline Development Group. British Thoracic Society guidelines for the management of suspected acute pulmonary embolism. Thorax. 2003 Jun;58(6):470-83.
http://thorax.bmj.com/content/58/6/470.long
http://www.ncbi.nlm.nih.gov/pubmed/12775856?tool=bestpractice.com
[126]Gayen S, Katz A, Dikengil F, et al. Contemporary practice patterns and outcomes of systemic thrombolysis in acute pulmonary embolism. J Vasc Surg Venous Lymphat Disord. 2022 Sep;10(5):1119-27.
http://www.ncbi.nlm.nih.gov/pubmed/35714905?tool=bestpractice.com
Pacientes con sospecha de EP sin shock o hipotensión
Cuando la anamnesis y la exploración física no logran descartar la EP, la probabilidad de EP antes de la prueba debe determinarse mediante el juicio clínico. Cuando la evaluación clínica inicial sugiere una baja sospecha clínica de EP, se recomienda la aplicación de los Criterios de Descarte de Embolia Pulmonar (PERC) para descartar la EP en estos pacientes.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
[127]Rivera-Lebron B, McDaniel M, Ahrar K, et al. Diagnosis, treatment and follow up of acute pulmonary embolism: consensus practice from the PERT consortium. Clin Appl Thromb Hemost. 2019 Jan-Dec;25:1076029619853037.
https://pmc.ncbi.nlm.nih.gov/articles/PMC6714903
http://www.ncbi.nlm.nih.gov/pubmed/31185730?tool=bestpractice.com
Los pacientes con una alta sospecha clínica de EP requieren una evaluación adicional utilizando los criterios de Well originales (modificados), los criterios de Wells simplificados (modificados), la puntuación de Ginebra original (revisada), la puntuación de Ginebra simplificada (revisada) o los criterios YEARS. Para obtener más información al respecto, consulte a continuación.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
[128]Wells PS, Anderson DR, Rodger M, et al. Derivation of a simple clinical model to categorize patients' probability of pulmonary embolism: increasing the model's utility with the SimpliRED D-dimer. Thromb Haemost. 2000 Mar;83(3):416-20.
http://www.ncbi.nlm.nih.gov/pubmed/10744147?tool=bestpractice.com
[129]Le Gal G, Righini M, Roy PM, et al. Prediction of pulmonary embolism in the emergency department: the revised Geneva score. Ann Intern Med. 2006 Feb 7;144(3):165-71.
http://www.ncbi.nlm.nih.gov/pubmed/16461960?tool=bestpractice.com
[130]van der Hulle T, Cheung WY, Kooij S, et al. Simplified diagnostic management of suspected pulmonary embolism (the YEARS study): a prospective, multicentre, cohort study. Lancet. 2017 Jul 15;390(10091):289-97.
http://www.ncbi.nlm.nih.gov/pubmed/28549662?tool=bestpractice.com
Si existe una alta probabilidad de EP pero las pruebas diagnósticas no se pueden realizar con prontitud, se debe proporcionar anticoagulación empírica a la dosis inicial, si no está contraindicada, mientras se esperan los resultados de las pruebas diagnósticas.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
Algoritmo diagnóstico para la EP
[Figure caption and citation for the preceding image starts]: Resumen: trayecto diagnóstico de la embolia pulmonarCreado por BMJ Knowledge Centre [Citation ends].
Evaluar la probabilidad clínica de EP
La probabilidad clínica, evaluada por el juicio clínico y una regla de predicción validada, es la base de todas las estrategias diagnósticas para la EP.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
La sospecha de EP a menudo se puede descartar sin una prueba de imagen, evitando el gasto y los riesgos de la radiación y el contraste de los estudios por imágenes. Por lo tanto, el primer paso para hacer el diagnóstico de EP es establecer la probabilidad de que haya una EP utilizando un modelo de evaluación de riesgos. Utilizando un enfoque algorítmico, más del 40% de los pacientes con sospecha de EP pueden descartar el diagnóstico de forma segura sin necesidad de estudios por imágenes.[127]Rivera-Lebron B, McDaniel M, Ahrar K, et al. Diagnosis, treatment and follow up of acute pulmonary embolism: consensus practice from the PERT consortium. Clin Appl Thromb Hemost. 2019 Jan-Dec;25:1076029619853037.
https://pmc.ncbi.nlm.nih.gov/articles/PMC6714903
http://www.ncbi.nlm.nih.gov/pubmed/31185730?tool=bestpractice.com
Las guías de práctica clínica del American College of Physicians recomiendan la aplicación del PERC para descartar la EP en pacientes donde la evaluación clínica inicial sugiere una baja sospecha clínica de EP.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
[127]Rivera-Lebron B, McDaniel M, Ahrar K, et al. Diagnosis, treatment and follow up of acute pulmonary embolism: consensus practice from the PERT consortium. Clin Appl Thromb Hemost. 2019 Jan-Dec;25:1076029619853037.
https://pmc.ncbi.nlm.nih.gov/articles/PMC6714903
http://www.ncbi.nlm.nih.gov/pubmed/31185730?tool=bestpractice.com
Un metanálisis de los estudios que evaluaron la exactitud del PERC para descartar la EP informó una sensibilidad del 97%.[131]Singh B, Mommer SK, Erwin PJ, et al. Pulmonary embolism rule-out criteria (PERC) in pulmonary embolism - revisited: a systematic review and meta-analysis. Emerg Med J. 2013 Sep;30(9):701-6.
http://emj.bmj.com/content/30/9/701.long
http://www.ncbi.nlm.nih.gov/pubmed/23038695?tool=bestpractice.com
En pacientes que cumplen todos los criterios del PERC (edad <50 años; frecuencia cardíaca inicial <100 lpm; saturación de oxígeno inicial >94% con aire ambiente; sin inflamación unilateral de la pierna; sin hemoptisis; sin cirugía ni traumatismo en las últimas 4 semanas; sin antecedentes de TEV; sin uso de estrógenos), se considera que el riesgo de EP es inferior al riesgo de las pruebas, y no se indica la realización de más pruebas.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
[127]Rivera-Lebron B, McDaniel M, Ahrar K, et al. Diagnosis, treatment and follow up of acute pulmonary embolism: consensus practice from the PERT consortium. Clin Appl Thromb Hemost. 2019 Jan-Dec;25:1076029619853037.
https://pmc.ncbi.nlm.nih.gov/articles/PMC6714903
http://www.ncbi.nlm.nih.gov/pubmed/31185730?tool=bestpractice.com
Los pacientes hemodinámicamente estables que no cumplen todos los criterios del PERC, o los pacientes con alta sospecha clínica de EP en la evaluación inicial, requieren una evaluación utilizando los criterios de Wells originales (modificados), los criterios de Wells simplificados (modificados), la puntuación de Ginebra original (revisada), la puntuación de Ginebra simplificada (revisada) o los criterios YEARS.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
[128]Wells PS, Anderson DR, Rodger M, et al. Derivation of a simple clinical model to categorize patients' probability of pulmonary embolism: increasing the model's utility with the SimpliRED D-dimer. Thromb Haemost. 2000 Mar;83(3):416-20.
http://www.ncbi.nlm.nih.gov/pubmed/10744147?tool=bestpractice.com
[129]Le Gal G, Righini M, Roy PM, et al. Prediction of pulmonary embolism in the emergency department: the revised Geneva score. Ann Intern Med. 2006 Feb 7;144(3):165-71.
http://www.ncbi.nlm.nih.gov/pubmed/16461960?tool=bestpractice.com
[130]van der Hulle T, Cheung WY, Kooij S, et al. Simplified diagnostic management of suspected pulmonary embolism (the YEARS study): a prospective, multicentre, cohort study. Lancet. 2017 Jul 15;390(10091):289-97.
http://www.ncbi.nlm.nih.gov/pubmed/28549662?tool=bestpractice.com
Cada una de estas herramientas de decisión clínica asigna un valor (un único punto o puntos) a una serie de características de examen físico e histórico, cuya suma determina si la EP es probable o improbable. Los criterios YEARS utilizan un subconjunto de los criterios de Wells para crear dos niveles de probabilidad previa a la prueba, y un umbral de dímero D ajustado para identificar a los pacientes en los que la EP se puede descartar de forma segura sin necesidad de realizar estudios por imágenes.[130]van der Hulle T, Cheung WY, Kooij S, et al. Simplified diagnostic management of suspected pulmonary embolism (the YEARS study): a prospective, multicentre, cohort study. Lancet. 2017 Jul 15;390(10091):289-97.
http://www.ncbi.nlm.nih.gov/pubmed/28549662?tool=bestpractice.com
Si estos sistemas de puntuación sugieren que la EP es poco probable, se recomienda la medición del dímero D para evaluar la necesidad de obtener estudios por imágenes.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
[127]Rivera-Lebron B, McDaniel M, Ahrar K, et al. Diagnosis, treatment and follow up of acute pulmonary embolism: consensus practice from the PERT consortium. Clin Appl Thromb Hemost. 2019 Jan-Dec;25:1076029619853037.
https://pmc.ncbi.nlm.nih.gov/articles/PMC6714903
http://www.ncbi.nlm.nih.gov/pubmed/31185730?tool=bestpractice.com
Véase el apartado Criterios. Los pacientes en los que los criterios de Wells/Ginebra o YEARS sugieren que la EP es probable, o con un dímero D anormal, deben proceder inmediatamente a la exploración pulmonar por imágenes (APTC; o ventilación y perfusión [V/P] pulmonar si la APTC está contraindicada), al igual que cualquier paciente con sospecha de EP con shock o hipotensión.[127]Rivera-Lebron B, McDaniel M, Ahrar K, et al. Diagnosis, treatment and follow up of acute pulmonary embolism: consensus practice from the PERT consortium. Clin Appl Thromb Hemost. 2019 Jan-Dec;25:1076029619853037.
https://pmc.ncbi.nlm.nih.gov/articles/PMC6714903
http://www.ncbi.nlm.nih.gov/pubmed/31185730?tool=bestpractice.com
En estos pacientes, la anticoagulación debe iniciarse mientras se esperan los resultados de los estudios por imágenes.[19]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
[20]National Institute for Health and Care Excellence. Venous thromboembolic diseases: diagnosis, management and thrombophilia testing. Aug 2023 [internet publication].
https://www.nice.org.uk/guidance/ng158
[
Puntuación Pulmonary Embolism Wells Score
Opens in new window
]
[
Escala de Ginebra revisada para la estimación de la probabilidad clínica de embolia pulmonar en adultos
Opens in new window
]
[
Algoritmo YEARS para la embolia pulmonar (EP)
Opens in new window
]
Cuando se validó cada herramienta de decisión clínica (Wells original, Wells modificado, Wells simplificado, Ginebra revisada y Ginebra revisada simplificada; todas con pruebas de dímero D si la EP era poco probable) en un conjunto de datos de atención primaria, la sensibilidad osciló entre el 88% (Ginebra revisada simplificada) y el 96% (Ginebra simplificada) y la especificidad entre el 48% (Ginebra revisada) y el 53% (Ginebra revisada simplificada).[132]Hendriksen JM, Geersing GJ, Lucassen WA, et al. Diagnostic prediction models for suspected pulmonary embolism: systematic review and independent external validation in primary care. BMJ. 2015 Sep 8;351:h4438.
https://pmc.ncbi.nlm.nih.gov/articles/PMC4561760
http://www.ncbi.nlm.nih.gov/pubmed/26349907?tool=bestpractice.com
Las versiones simplificadas de los criterios de Wells modificados o de la puntuación de Ginebra revisada pueden ser preferibles en la práctica clínica debido a su facilidad de uso.[133]van Es N, Kraaijpoel N, Klok FA, et al. The original and simplified Wells rules and age-adjusted D-dimer testing to rule out pulmonary embolism: an individual patient data meta-analysis. J Thromb Haemost. 2017 Apr;15(4):678-84.
https://onlinelibrary.wiley.com/doi/full/10.1111/jth.13630
http://www.ncbi.nlm.nih.gov/pubmed/28106338?tool=bestpractice.com
Ambas versiones simplificadas han sido validadas; ninguna ha demostrado ser superior a la otra.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
[132]Hendriksen JM, Geersing GJ, Lucassen WA, et al. Diagnostic prediction models for suspected pulmonary embolism: systematic review and independent external validation in primary care. BMJ. 2015 Sep 8;351:h4438.
https://pmc.ncbi.nlm.nih.gov/articles/PMC4561760
http://www.ncbi.nlm.nih.gov/pubmed/26349907?tool=bestpractice.com
Sin embargo, la puntuación de Ginebra se basa enteramente en elementos clínicos objetivos y puede ser más reproducible (los criterios de Wells [originales y simplificados] incluyen el elemento clínico subjetivo 'diagnóstico alternativo menos probable que la EP').[134]Klok FA, Kruisman E, Spaan J, et al. Comparison of the revised Geneva score with the Wells rule for assessing clinical probability of pulmonary embolism. J Thromb Haemost. 2008 Jan;6(1):40-4.
https://onlinelibrary.wiley.com/doi/full/10.1111/j.1538-7836.2007.02820.x
http://www.ncbi.nlm.nih.gov/pubmed/17973649?tool=bestpractice.com
Los criterios de Wells y la puntuación de Ginebra revisada categorizan a los pacientes de forma dicotómica (PE improbable o PE probable). Sin embargo, las iteraciones anteriores de cada herramienta atribuían probabilidades clínicas bajas, intermedias o altas de EP. Si se utiliza la clasificación en dos niveles, la EP se confirma en el 50% de los pacientes en la categoría de probabilidad de EP, en comparación con el 12% en la categoría de improbabilidad de EP. Si se emplea la clasificación en tres niveles, la proporción de pacientes con EP confirmada será de alrededor del 10% en la categoría de probabilidad baja, del 30% en la categoría de probabilidad intermedia y del 65% en la categoría de probabilidad alta.[135]Ceriani E, Combescure C, Le Gal G, et al. Clinical prediction rules for pulmonary embolism: a systematic review and meta-analysis. J Thromb Haemost. 2010 May;8(5):957-70.
https://www.jthjournal.org/article/S1538-7836(22)12404-9/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/20149072?tool=bestpractice.com
El criterio YEARS ajusta el umbral del dímero D para descartar la EP en función del número de criterios presentes. Los criterios son: signos clínicos de TVP; hemoptisis; y si la EP es el diagnóstico más probable.[130]van der Hulle T, Cheung WY, Kooij S, et al. Simplified diagnostic management of suspected pulmonary embolism (the YEARS study): a prospective, multicentre, cohort study. Lancet. 2017 Jul 15;390(10091):289-97.
http://www.ncbi.nlm.nih.gov/pubmed/28549662?tool=bestpractice.com
Los criterios YEARS evitan la obtención de estudios por imágenes en el porcentaje más alto de pacientes y, por lo tanto, pueden resultar en una menor necesidad de APTC, pero mantienen los elementos subjetivos de los criterios de Wells.[130]van der Hulle T, Cheung WY, Kooij S, et al. Simplified diagnostic management of suspected pulmonary embolism (the YEARS study): a prospective, multicentre, cohort study. Lancet. 2017 Jul 15;390(10091):289-97.
http://www.ncbi.nlm.nih.gov/pubmed/28549662?tool=bestpractice.com
Los criterios YEARS se han evaluado en pacientes embarazadas con sospecha de EP.[136]van der Pol LM, Tromeur C, Bistervels IM, et al. Pregnancy-adapted YEARS algorithm for diagnosis of suspected pulmonary embolism. N Engl J Med. 2019 Mar 21;380(12):1139-49.
https://www.nejm.org/doi/10.1056/NEJMoa1813865
http://www.ncbi.nlm.nih.gov/pubmed/30893534?tool=bestpractice.com
Confirmación de EP
La confirmación del diagnóstico requiere la documentación de un coágulo de sangre en una arteria pulmonar mediante un estudio por imágenes, como la APTC de múltiples detectores o la gammagrafía pulmonar de V/P (con ahorro de radiación).[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
La confirmación de EP con una prueba definitiva es esencial porque el tratamiento está relacionado con un riesgo significativo de sangrado.
No solicite estudios por imágenes de forma rutinaria para pacientes con sospecha de EP sin una probabilidad intermedia o alta de EP previa a la prueba o con un dímero D negativo.[137]American College of Radiology. Ten things physicians and patients should question. Choosing Wisely, an initiative of the ABIM Foundation. 2021 [internet publication].
https://web.archive.org/web/20230330210926/https://www.choosingwisely.org/societies/american-college-of-radiology
[138]American College of Emergency Physicians. Avoid CT pulmonary angiography in emergency department patients with a low-pretest probability of pulmonary embolism and either a negative pulmonary embolism rule-out criteria (PERC) or a negative D-dimer. Choosing Wisely, an initiative of the ABIM Foundation. 2014 [internet publication].
https://web.archive.org/web/20230323091141/https://www.choosingwisely.org/clinician-lists/acep-ct-pulmonary-angiography-in-ed-patients
[139]American College of Radiology. ACR Appropriateness Criteria®: suspected pulmonary embolism. 2022 [internet publication].
https://acsearch.acr.org/docs/69404/Narrative
Nivel cuantitativo de dímero D
El dímero D es un producto de descomposición de la fibrina reticulada; por lo tanto, si hay un TEV agudo, es probable que el nivel de dímero D esté elevado. Por lo tanto, una prueba cuantitativa o de dímero D de alta sensibilidad es una prueba útil para descartar la presencia de un TEV agudo. Sin embargo, un nivel elevado de dímero D es inespecífico y con frecuencia es anormal en pacientes de edad avanzada, enfermos agudos, enfermedad hepática subyacente, infección o embarazadas. Hay muchas pruebas disponibles para el dímero D, pero las mejores son las pruebas de ensayo de inmunoadsorción enzimática altamente sensibles. Cada una de las múltiples pruebas que están disponibles en el mercado tiene su propio valor límite normal. El dímero D se puede informar en diferentes unidades, por lo que se debe anotar el valor límite específico para la prueba que se está utilizando.[140]Freund Y, Cohen-Aubart F, Bloom B. Acute pulmonary embolism: a review. JAMA. 2022 Oct 4;328(13):1336-45.
http://www.ncbi.nlm.nih.gov/pubmed/36194215?tool=bestpractice.com
[141]Hasegawa M, Wada H, Yamaguchi T, et al. The evaluation of d-dimer levels for the comparison of fibrinogen and fibrin units using different d-dimer kits to diagnose VTE. Clin Appl Thromb Hemost. 2018 May;24(4):655-62.
https://pmc.ncbi.nlm.nih.gov/articles/PMC6714702
http://www.ncbi.nlm.nih.gov/pubmed/28480752?tool=bestpractice.com
La prueba del dímero D está indicada en pacientes hemodinámicamente estables que cumplieron con todos los criterios de los criterios de descarte de embolia pulmonar (PERC) y en los que la embolia pulmonar se ha evaluado como improbable utilizando una herramienta de decisión clínica validada (criterios de Wells original, Wells modificado, Wells simplificado, Ginebra revisado, Ginebra revisado simplificado o YEARS).[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
[127]Rivera-Lebron B, McDaniel M, Ahrar K, et al. Diagnosis, treatment and follow up of acute pulmonary embolism: consensus practice from the PERT consortium. Clin Appl Thromb Hemost. 2019 Jan-Dec;25:1076029619853037.
https://pmc.ncbi.nlm.nih.gov/articles/PMC6714903
http://www.ncbi.nlm.nih.gov/pubmed/31185730?tool=bestpractice.com
Los médicos no deben obtener un nivel del dímero D en pacientes con una alta sospecha clínica de EP; está indicado el diagnóstico inmediato mediante estudios por imágenes.[127]Rivera-Lebron B, McDaniel M, Ahrar K, et al. Diagnosis, treatment and follow up of acute pulmonary embolism: consensus practice from the PERT consortium. Clin Appl Thromb Hemost. 2019 Jan-Dec;25:1076029619853037.
https://pmc.ncbi.nlm.nih.gov/articles/PMC6714903
http://www.ncbi.nlm.nih.gov/pubmed/31185730?tool=bestpractice.com
La prueba de dímero D es altamente sensible (>95%) pero inespecífica.
Un nivel de dímero D en plasma por debajo del umbral descarta de forma segura la EP en pacientes con una baja probabilidad de EP previa a la prueba (intermedia o baja), y no se precisa realizar más pruebas.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
[124]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.
http://www.onlinejacc.org/content/67/8/976
http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com
El riesgo de EP en un plazo de 3 meses es <1% en estos pacientes.[142]Carrier M, Righini M, Djurabi RK, et al. VIDAS D-dimer in combination with clinical pre-test probability to rule out pulmonary embolism: a systematic review of management outcome studies. Thromb Haemost. 2009 May;101(5):886-92.
http://www.ncbi.nlm.nih.gov/pubmed/19404542?tool=bestpractice.com
[143]Agnelli G, Becattini C. Acute pulmonary embolism. N Engl J Med. 2010 Jul 15;363(3):266-74.
http://www.ncbi.nlm.nih.gov/pubmed/20592294?tool=bestpractice.com
El dímero D puede ajustarse a la edad (lo normal es <edad × 10 microgramos/l en pacientes de edad ≥50 años) o a la probabilidad de enfermedad antes de la prueba (punto de corte de 1000 nanogramos/mL en pacientes de baja probabilidad, o 500 nanogramos/mL en pacientes de probabilidad intermedia) para aumentar la especificidad y, por tanto, el porcentaje de pacientes que pueden evitar un estudio de imagen.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
[144]Kearon C, de Wit K, Parpia S, et al. Diagnosis of pulmonary embolism with d-Dimer adjusted to clinical probability. N Engl J Med. 2019 Nov 28;381(22):2125-34.
https://www.doi.org/10.1056/NEJMoa1909159
http://www.ncbi.nlm.nih.gov/pubmed/31774957?tool=bestpractice.com
[145]Righini M, Van Es J, Den Exter PL, et al. Age-adjusted D-dimer cutoff levels to rule out pulmonary embolism: the ADJUST-PE study. JAMA. 2014 Mar 19;311(11):1117-24.
https://orbi.uliege.be/handle/2268/178054
http://www.ncbi.nlm.nih.gov/pubmed/24643601?tool=bestpractice.com
En pacientes con cáncer, el uso de un valor de corte ajustado a la edad para el dímero D duplicó la proporción de pacientes en los que la EP podía ser descartada por la regla de decisión clínica y el dímero D, sin estudios por imágenes.[146]Wilts IT, Le Gal G, Den Exter PL, et al. Performance of the age-adjusted cut-off for D-dimer in patients with cancer and suspected pulmonary embolism. Thromb Res. 2017 Apr;152:49-51.
http://www.ncbi.nlm.nih.gov/pubmed/28226257?tool=bestpractice.com
En pacientes embarazadas con sospecha de EP, se ha estudiado el algoritmo YEARS con umbrales de dímero D adaptados al riesgo.[136]van der Pol LM, Tromeur C, Bistervels IM, et al. Pregnancy-adapted YEARS algorithm for diagnosis of suspected pulmonary embolism. N Engl J Med. 2019 Mar 21;380(12):1139-49.
https://www.nejm.org/doi/10.1056/NEJMoa1813865
http://www.ncbi.nlm.nih.gov/pubmed/30893534?tool=bestpractice.com
Los pacientes con un nivel anormal de dímero D deben someterse a APTC con detectores múltiples (o a una gammagrafía pulmonar V/Q si la APTC está contraindicada) para confirmar o descartar un diagnóstico de EP.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
[124]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.
http://www.onlinejacc.org/content/67/8/976
http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com
[127]Rivera-Lebron B, McDaniel M, Ahrar K, et al. Diagnosis, treatment and follow up of acute pulmonary embolism: consensus practice from the PERT consortium. Clin Appl Thromb Hemost. 2019 Jan-Dec;25:1076029619853037.
https://pmc.ncbi.nlm.nih.gov/articles/PMC6714903
http://www.ncbi.nlm.nih.gov/pubmed/31185730?tool=bestpractice.com
Estudios por imágenes iniciales: APTC y gammagrafía de V/P
La APTC tiene la mejor precisión diagnóstica de todos los métodos avanzados de estudios por imágenes no invasivos; la APTC confirma el diagnóstico mediante la visualización directa del trombo en una arteria pulmonar, donde aparece como un defecto de llenado intraluminal parcial o completo.[139]American College of Radiology. ACR Appropriateness Criteria®: suspected pulmonary embolism. 2022 [internet publication].
https://acsearch.acr.org/docs/69404/Narrative
[147]Perrier A, Roy PM, Sanchez O, et al. Multidetector-row computed tomography in suspected pulmonary embolism. N Engl J Med. 2005 Apr 28;352(17):1760-8.
https://www.nejm.org/doi/10.1056/NEJMoa042905
http://www.ncbi.nlm.nih.gov/pubmed/15858185?tool=bestpractice.com
El cociente de probabilidad para descartar una EP con un defecto de llenado en las ramas segmentarias o subsegmentarias es de 24.1 (rango de 12.4 a 46.7), mientras que la probabilidad para descartarla es de 0.11 (rango de 0.06 a 0.19).[147]Perrier A, Roy PM, Sanchez O, et al. Multidetector-row computed tomography in suspected pulmonary embolism. N Engl J Med. 2005 Apr 28;352(17):1760-8.
https://www.nejm.org/doi/10.1056/NEJMoa042905
http://www.ncbi.nlm.nih.gov/pubmed/15858185?tool=bestpractice.com
La especificidad es del 96%.[148]Stein PD, Fowler SE, Goodman LR, et al; PIOPED II Investigators. Multidetector computed tomography for acute pulmonary embolism. N Engl J Med. 2006 Jun 1;354(22):2317-27.
https://www.nejm.org/doi/10.1056/NEJMoa052367
http://www.ncbi.nlm.nih.gov/pubmed/16738268?tool=bestpractice.com
La incidencia a tres meses de eventos tromboembólicos venosos tras una tomografía computada (CT) negativa es <2%.[147]Perrier A, Roy PM, Sanchez O, et al. Multidetector-row computed tomography in suspected pulmonary embolism. N Engl J Med. 2005 Apr 28;352(17):1760-8.
https://www.nejm.org/doi/10.1056/NEJMoa042905
http://www.ncbi.nlm.nih.gov/pubmed/15858185?tool=bestpractice.com
[149]van Belle A, Büller HR, Huisman MV, et al. Effectiveness of managing suspected pulmonary embolism using an algorithm combining clinical probability, D-dimer testing, and computed tomography. JAMA. 2006 Jan 11;295(2):172-9.
https://jamanetwork.com/journals/jama/fullarticle/202176
http://www.ncbi.nlm.nih.gov/pubmed/16403929?tool=bestpractice.com
La exploración por TC está contraindicada en aproximadamente el 25% de los pacientes debido a la alergia al contraste o a la insuficiencia renal.[148]Stein PD, Fowler SE, Goodman LR, et al; PIOPED II Investigators. Multidetector computed tomography for acute pulmonary embolism. N Engl J Med. 2006 Jun 1;354(22):2317-27.
https://www.nejm.org/doi/10.1056/NEJMoa052367
http://www.ncbi.nlm.nih.gov/pubmed/16738268?tool=bestpractice.com
En las mujeres embarazadas, la exposición a la radiación a través de las exploraciones por TC es a una dosis mucho más baja que la exposición asociada con el daño fetal y, si es necesario, no debe suspenderse la APTC.[150]American College of Obstetricians and Gynecologists' Committee on Practice Bulletins—Gynecology. ACOG Committee opinion no. 723: guidelines for diagnostic imaging during pregnancy and lactation. Obstet Gynecol. 2017 Oct;130(4):e210-6.
https://www.acog.org/clinical/clinical-guidance/committee-opinion/articles/2017/10/guidelines-for-diagnostic-imaging-during-pregnancy-and-lactation
http://www.ncbi.nlm.nih.gov/pubmed/28937575?tool=bestpractice.com
La APTC debe usarse con discreción en adolescentes y adultos jóvenes, y se deben emplear estrategias alternativas de estudios por imágenes cuando sea posible.[151]Arnold RW, Janitz E, Poulton TB, et al. Pulmonary CT angiography to evaluate for pulmonary embolism in children visiting adult-centered community hospitals. AJR Am J Roentgenol. 2011 Jun;196(6):W823-30.
https://www.ajronline.org/doi/full/10.2214/AJR.10.5951
http://www.ncbi.nlm.nih.gov/pubmed/21606276?tool=bestpractice.com
[152]Thacker PG, Lee EY. Pulmonary embolism in children. AJR Am J Roentgenol. 2015 Jun;204(6):1278-88.
https://www.ajronline.org/doi/10.2214/AJR.14.13869
http://www.ncbi.nlm.nih.gov/pubmed/26001239?tool=bestpractice.com
Si se utiliza, la exposición a las radiaciones ionizantes debe monitorizarse y minimizarse con cuidado.[153]Tang CX, Schoepf UJ, Chowdhury SM, et al. Multidetector computed tomography pulmonary angiography in childhood acute pulmonary embolism. Pediatr Radiol. 2015 Sep;45(10):1431-9.
https://www.doi.org/10.1007/s00247-015-3336-6
http://www.ncbi.nlm.nih.gov/pubmed/25846076?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: La exploración mediante angiografía pulmonar por tomografía computarizada (APTC)con contraste muestra émbolos en la arteria pulmonar derecha subsegmentaria (ver las flechas)De la colección de Seth W. Clemens; utilizada con autorización [Citation ends].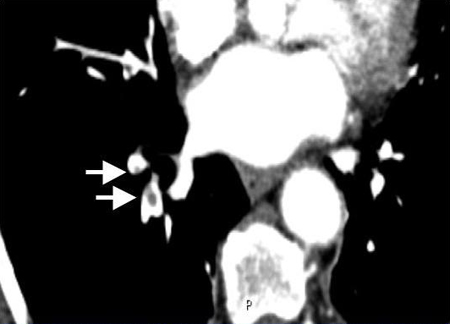
La gammagrafía de V/P pulmonar, preferiblemente con tomografía computarizada por emisión de fotón único (SPECT, que puede reducir el número de gammagrafías no concluyentes), es una alternativa a la APTC.[139]American College of Radiology. ACR Appropriateness Criteria®: suspected pulmonary embolism. 2022 [internet publication].
https://acsearch.acr.org/docs/69404/Narrative
[154]Phillips JJ, Straiton J, Staff RT. Planar and SPECT ventilation/perfusion imaging and computed tomography for the diagnosis of pulmonary embolism: a systematic review and meta-analysis of the literature, and cost and dose comparison. Eur J Radiol. 2015 Jul;84(7):1392-400.
http://www.ncbi.nlm.nih.gov/pubmed/25868674?tool=bestpractice.com
Un estudio prospectivo de pacientes con sospecha de EP aguda informó una sensibilidad del 97% y una especificidad del 88% para la gammagrafía de V/P SPECT.[155]Gutte H, Mortensen J, Jensen CV, et al. Detection of pulmonary embolism with combined ventilation-perfusion SPECT and low-dose CT: head-to-head comparison with multidetector CT angiography. J Nucl Med. 2009 Dec;50(12):1987-92.
http://jnm.snmjournals.org/content/50/12/1987.long
http://www.ncbi.nlm.nih.gov/pubmed/19910421?tool=bestpractice.com
En un estudio retrospectivo de 2328 pacientes con sospecha clínica de EP, 601 de 608 pacientes con un diagnóstico final de EP tenían una gammagrafía de V/P SPECT positiva (99% de sensibilidad), y 1153 pacientes sin diagnóstico final de EP tuvieron una gammagrafía de V/P SPECT negativa (98% de especificidad).[156]Bajc M, Olsson B, Palmer J, et al. Ventilation/perfusion SPECT for diagnostics of pulmonary embolism in clinical practice. J Intern Med. 2008 Oct;264(4):379-87.
https://onlinelibrary.wiley.com/doi/full/10.1111/j.1365-2796.2008.01980.x
http://www.ncbi.nlm.nih.gov/pubmed/18823506?tool=bestpractice.com
Una gammagrafía de V/P negativa descarta efectivamente la EP. La gammagrafía de V/P es un procedimiento que minimiza el uso de medios y la exposición a la radiación y puede ser indicado para pacientes con contraindicaciones o contraindicaciones relativas a la TC (p. ej., alergia al contraste, insuficiencia renal de moderada a grave, embarazo, pacientes jóvenes).[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
Considere la posibilidad de realizar una gammagrafía de V/P pulmonar en lugar de una APTC para diagnosticar la EP en mujeres jóvenes con una radiografía de tórax normal para reducir la dosis total de radiación en la mama.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
[157]Society of Nuclear Medicine and Molecular Imaging. Five things physicians and patients should question. Choosing Wisely, an initiative of the ABIM Foundation, 2021.
https://web.archive.org/web/20230131172641/https://www.choosingwisely.org/societies/society-of-nuclear-medicine-and-molecular-imaging
Los métodos incluyen V/P plana, TC de emisión de fotón único (SPECT) y SPECT con tomografía computarizada de baja dosis concomitante (Q-SPECT-CT). Los métodos basados en SPECT tienen menos resultados indeterminados.[158]Currie GM, Bailey DL. V/Q SPECT and SPECT/CT in pulmonary embolism. J Nucl Med Technol. 2023 Mar;51(1):9-15.
https://tech.snmjournals.org/content/51/1/9.long
http://www.ncbi.nlm.nih.gov/pubmed/36599703?tool=bestpractice.com
Otros estudios por imágenes
Ecografía en el punto de atención (POCUS)
POCUS es un estudio por imágenes rápido realizado a pie de cama por el médico u otro profesional clínico capacitado. Las guías de práctica clínica apoyan su uso para evaluar las posibles etiologías de la disnea aguda, pero el ajuste preciso en el algoritmo diagnóstico para los pacientes con sospecha clínica de EP requiere más exploración.[159]Qaseem A, Etxeandia-Ikobaltzeta I, Mustafa RA, et al. Appropriate use of point-of-care ultrasonography in patients with acute dyspnea in emergency department or inpatient settings: a clinical guideline from the American College of Physicians. Ann Intern Med. 2021 Jul;174(7):985-93.
https://www.acpjournals.org/doi/full/10.7326/M20-7844
http://www.ncbi.nlm.nih.gov/pubmed/33900792?tool=bestpractice.com
Radiografía de tórax
Una radiografía de tórax normal no elimina la EP como diagnóstico.[139]American College of Radiology. ACR Appropriateness Criteria®: suspected pulmonary embolism. 2022 [internet publication].
https://acsearch.acr.org/docs/69404/Narrative
Sin embargo, una radiografía de tórax puede descartar otras causas de los síntomas del paciente, como un neumotórax o una neumonía.[139]American College of Radiology. ACR Appropriateness Criteria®: suspected pulmonary embolism. 2022 [internet publication].
https://acsearch.acr.org/docs/69404/Narrative
Los hallazgos radiológicos de tórax asociados con la EP incluyen el signo de Fleischner/arteria pulmonar central prominente (20%); signo de Westermark/oligohemia en el área de distribución de la EP (11%); joroba de Hampton/áreas pleurales de mayor opacidad que corresponden a la distribución de la EP (27%).[129]Le Gal G, Righini M, Roy PM, et al. Prediction of pulmonary embolism in the emergency department: the revised Geneva score. Ann Intern Med. 2006 Feb 7;144(3):165-71.
http://www.ncbi.nlm.nih.gov/pubmed/16461960?tool=bestpractice.com
[160]Wicki J, Perneger TV, Junod AF, et al. Assessing clinical probability of pulmonary embolism in the emergency ward: a simple score. Arch Intern Med. 2001 Jan 8;161(1):92-7.
https://jamanetwork.com/journals/jamainternalmedicine/fullarticle/646914
http://www.ncbi.nlm.nih.gov/pubmed/11146703?tool=bestpractice.com
Ninguno de estos hallazgos es lo suficientemente sensible o específico como para permitir un diagnóstico definitivo.
Angiografía por resonancia magnética (ARM)
La ARM se puede utilizar para evaluar las arterias centrales y segmentarias, los estudios por imágenes basados en resonancia magnética (RM) rara vez se utilizan debido a las características de facilidad y rendimiento de la APTC.[139]American College of Radiology. ACR Appropriateness Criteria®: suspected pulmonary embolism. 2022 [internet publication].
https://acsearch.acr.org/docs/69404/Narrative
Existen tres técnicas diferentes: la angiografía con contraste de gadolinio (ARM-Gd), la angiografía en tiempo real (ARM-RT) y los estudios por imágenes de perfusión por RM.[161]Clemens S. Newer modalities for detection of pulmonary emboli. Am J Med. 2007 Oct;120(10 suppl 2):S2-12.
http://www.ncbi.nlm.nih.gov/pubmed/17916456?tool=bestpractice.com
La ARM se puede utilizar para evaluar las arterias central y segmentaria.[139]American College of Radiology. ACR Appropriateness Criteria®: suspected pulmonary embolism. 2022 [internet publication].
https://acsearch.acr.org/docs/69404/Narrative
La prueba tiene una alta especificidad (91% a 98%) pero baja sensibilidad (75% a 93%), por lo que no puede descartar de manera confiable la EP con una prueba negativa.[161]Clemens S. Newer modalities for detection of pulmonary emboli. Am J Med. 2007 Oct;120(10 suppl 2):S2-12.
http://www.ncbi.nlm.nih.gov/pubmed/17916456?tool=bestpractice.com
El contraste de gadolinio (Gd), utilizado en estudios de ARM-Gd y de perfusión por RM, está relativamente contraindicado durante el embarazo. Debido al coste, el tiempo de adquisición más prolongado y las características operativas, las modalidades de RM se utilizan con poca frecuencia.
angiografía pulmonar
A pesar de su precisión diagnóstica, la angiografía pulmonar invasiva rara vez se usa para diagnosticar o descartar la EP.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
[162]Kearon C. Diagnosis of suspected venous thromboembolism. Hematology Am Soc Hematol Educ Program. 2016 Dec 2;2016(1):397-403.
http://asheducationbook.hematologylibrary.org/content/2016/1/397.long
http://www.ncbi.nlm.nih.gov/pubmed/27913507?tool=bestpractice.com
Está asociada con un riesgo de morbilidad/mortalidad y la APTC (que es menos invasiva) ofrece una precisión diagnóstica comparable.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
[163]Stein PD, Athanasoulis C, Alavi A, et al. Complications and validity of pulmonary angiography in acute pulmonary embolism. Circulation. 1992 Feb;85(2):462-8.
http://www.ncbi.nlm.nih.gov/pubmed/1735144?tool=bestpractice.com
El valor predictivo negativo puede ser tan alto como el 99%, sin embargo, esta es una prueba invasiva con una morbilidad del 3% al 6% y una mortalidad del 0.2% al 0.5%.[163]Stein PD, Athanasoulis C, Alavi A, et al. Complications and validity of pulmonary angiography in acute pulmonary embolism. Circulation. 1992 Feb;85(2):462-8.
http://www.ncbi.nlm.nih.gov/pubmed/1735144?tool=bestpractice.com
[164]The PIOPED Investigators. Value of the ventilation/perfusion scan in acute pulmonary embolism. Results of the prospective investigation of pulmonary embolism diagnosis (PIOPED). JAMA. 1990 May 23-30;263(20):2753-9.
http://www.ncbi.nlm.nih.gov/pubmed/2332918?tool=bestpractice.com
[165]Schoepf UJ, Goldhaber SZ, Costello P. Spiral computed tomography for acute pulmonary embolism. Circulation. 2004 May 11;109(18):2160-7.
http://circ.ahajournals.org/content/109/18/2160.full
http://www.ncbi.nlm.nih.gov/pubmed/15136509?tool=bestpractice.com
Implica el uso de contraste; una contraindicación relativa en casos de embarazo e insuficiencia renal.
ecocardiografía transtorácica (ETT)
La ETT no suele estar indicada en el diagnóstico de la EP aguda, pero es útil para identificar la sobrecarga ventricular derecha y ayudar a clasificar la gravedad y determinar el pronóstico.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
[139]American College of Radiology. ACR Appropriateness Criteria®: suspected pulmonary embolism. 2022 [internet publication].
https://acsearch.acr.org/docs/69404/Narrative
La evidencia ecocardiográfica de trombos del corazón derecho se asocia significativamente con un aumento de la mortalidad a los 30 días en pacientes diagnosticados con EP aguda.[166]Barrios D, Rosa-Salazar V, Morillo R, et al. Prognostic significance of right heart thrombi in patients with acute symptomatic pulmonary embolism: systematic review and meta-analysis. Chest. 2017 Feb;151(2):409-16.
http://www.ncbi.nlm.nih.gov/pubmed/27746202?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: Este ARM-Gd muestra una embolia pulmonar de la arteria pulmonar principal (ver la flecha)De la colección de Seth W. Clemens; utilizada con autorización [Citation ends].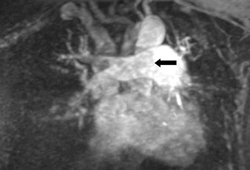 Si no se dispone de una modalidad de estudios por imágenes definitiva, se puede considerar la ecocardiografía en pacientes con sospecha de EP que presentan shock o hipotensión.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
[124]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.
http://www.onlinejacc.org/content/67/8/976
http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com
Si no se dispone de una modalidad de estudios por imágenes definitiva, se puede considerar la ecocardiografía en pacientes con sospecha de EP que presentan shock o hipotensión.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
[124]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.
http://www.onlinejacc.org/content/67/8/976
http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com
Ultrasonido
Se recomienda la ecografía de compresión venosa bilateral para establecer la presencia de trombosis sugestiva de EP en pacientes embarazadas con sospecha de EP (consulte la sección sobre poblaciones especiales de pacientes a continuación).[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
[167]Leung AN, Bull TM, Jaeschke R, et al. An official American Thoracic Society/Society of Thoracic Radiology clinical practice guideline: evaluation of suspected pulmonary embolism in pregnancy. Am J Respir Crit Care Med. 2011 Nov 15;184(10):1200-8.
https://www.atsjournals.org/doi/full/10.1164/rccm.201108-1575ST#.UnJdTVNZit8
http://www.ncbi.nlm.nih.gov/pubmed/22086989?tool=bestpractice.com
Análisis clínicos
Los análisis clínicos iniciales, incluidos tiempo de protrombina (TP), tiempo de tromboplastina parcial activada (TTPa) y relación normalizada internacional (INR), son importantes para ayudar a tomar decisiones acerca de la seguridad y el tipo de anticoagulación inicial que se seleccione. Los valores prolongados, especialmente el TTPa, en ausencia de exposición a un anticoagulante, pueden sugerir un síndrome de anticuerpos antifosfolípidos. Los paneles de función renal y hepática también ayudan a determinar la elección adecuada del tratamiento anticoagulante, ya que los distintos agentes conllevan precauciones o están contraindicados en caso de disfunción renal o hepática.[168]Ansell JE. Management of venous thromboembolism: clinical guidance from the Anticoagulation Forum. J Thromb Thrombolysis. 2016 Jan;41(1):1-2.
https://pmc.ncbi.nlm.nih.gov/articles/PMC4715851
Un hemograma completo puede detectar alteraciones hematológicas. El tratamiento con heparina puede asociarse a una trombocitopenia inducida por heparina; el recuento de plaquetas debe medirse al inicio y regularmente durante el tratamiento con heparina. Un recuento elevado de plaquetas puede sugerir una trombocitosis esencial o un trastorno mieloproliferativo, que puede representar un estado de hipercoagulabilidad secundario.
La troponina puede utilizarse para ayudar a determinar la categoría de gravedad de la EP aguda, lo que influye en las decisiones de tratamiento. Se sugiere en pacientes que tienen una categoría elevada del Pulmonary Embolism Severity Index (PESI), o alteraciones del ventrículo derecho en los estudios por imágenes.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
Cribado de trombofilia
La trombofilia se refiere comúnmente a cinco afecciones hereditarias (Factor V Leiden, gen de la protrombina 20210A, deficiencias de antitrombina, deficiencia de proteína C y de proteína S) y al síndrome antifosfolípido (una afección adquirida). Sin embargo, muchas variantes genéticas y enfermedades adquiridas modifican el riesgo de trombosis.[169]Stevens SM, Woller SC, Bauer KA, et al. Guidance for the evaluation and treatment of hereditary and acquired thrombophilia. J Thromb Thrombolysis. 2016 Jan;41(1):154-64.
https://link.springer.com/article/10.1007/s11239-015-1316-1
http://www.ncbi.nlm.nih.gov/pubmed/26780744?tool=bestpractice.com
Las indicaciones para el cribado son controvertidas. Las indicaciones para el cribado son controvertidas.[169]Stevens SM, Woller SC, Bauer KA, et al. Guidance for the evaluation and treatment of hereditary and acquired thrombophilia. J Thromb Thrombolysis. 2016 Jan;41(1):154-64.
https://link.springer.com/article/10.1007/s11239-015-1316-1
http://www.ncbi.nlm.nih.gov/pubmed/26780744?tool=bestpractice.com
[170]Connors JM. Thrombophilia testing and venous thrombosis. N Engl J Med. 2017 Sep 21;377(12):1177-87.La trombo filia hereditaria no modifica lo suficiente el riesgo pronosticado de trombosis recurrente para que afecte las decisiones del tratamiento, y un abordaje conservador para las pruebas es razonable.[19]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
Algunas guías de práctica clínica sugieren la realización de la prueba solo en situaciones en las que el resultado pueda cambiar una decisión clínica (como en los pacientes con una TVP o EP no provocada que están considerando dejar de tomar anticoagulantes).[20]National Institute for Health and Care Excellence. Venous thromboembolic diseases: diagnosis, management and thrombophilia testing. Aug 2023 [internet publication].
https://www.nice.org.uk/guidance/ng158
[61]Middeldorp S, Nieuwlaat R, Baumann Kreuziger L, et al. American Society of Hematology 2023 guidelines for management of venous thromboembolism: thrombophilia testing. Blood Adv. 2023 Nov 28;7(22):7101-38.
https://ashpublications.org/bloodadvances/article/doi/10.1182/bloodadvances.2023010177/495845/American-Society-of-Hematology-2023-Guidelines-for
http://www.ncbi.nlm.nih.gov/pubmed/37195076?tool=bestpractice.com
[171]Klok FA, Ageno W, Ay C, et al. Optimal follow-up after acute pulmonary embolism: a position paper of the European Society of Cardiology working group on pulmonary circulation and right ventricular function, in collaboration with the European Society of Cardiology working group on atherosclerosis and vascular biology, endorsed by the European Respiratory Society. Eur Heart J. 2022 Jan 25;43(3):183-9.
https://pmc.ncbi.nlm.nih.gov/articles/PMC8790766
http://www.ncbi.nlm.nih.gov/pubmed/34875048?tool=bestpractice.com
Sin embargo, la presencia de una trombofilia hereditaria no aumenta significativamente el riesgo pronosticado de TEV recurrente tras una TEV provocada, y las guías de práctica clínica desaconsejan la realización de pruebas en este contexto.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
[60]American Society of Hematology. Ten things physicians and patients should question. Choosing Wisely, an initiative of the ABIM Foundation, 2021.
https://web.archive.org/web/20230316185857/https://www.choosingwisely.org/societies/american-society-of-hematology
Síndrome antifosfolípido
Los anticuerpos antifosfolípidos pueden pronosticar un mayor riesgo de trombosis futura después de un evento inicial de TEV y pueden afectar la selección del tratamiento.[65]Garcia D, Erkan D. Diagnosis and management of the antiphospholipid syndrome. N Engl J Med. 2018 May 24;378(21):2010-21.
http://www.ncbi.nlm.nih.gov/pubmed/29791828?tool=bestpractice.com
Existe controversia con respecto a si se debe preferir un cribado amplio de anticuerpos antifosfolípidos o un cribado solo sobre la base de la sospecha clínica.[172]Fazili M, Stevens SM, Woller SC. Direct oral anticoagulants in antiphospholipid syndrome with venous thromboembolism: impact of the European Medicines Agency guidance. Res Pract Thromb Haemost. 2020 Jan;4(1):9-12.
https://pmc.ncbi.nlm.nih.gov/articles/PMC6971326
[173]European Medicines Agency Pharmacovigilance Risk Assessment Committee (PRAC). PRAC recommendations on signals. Jun 2019 [internet publication].
https://www.ema.europa.eu/en/documents/prac-recommendation/prac-recommendations-signals-adopted-13-16-may-2019-prac-meeting_en.pdf
Algunas guías de práctica clínica sugieren la realización de pruebas solo en situaciones en las que el resultado pueda cambiar una decisión clínica (como en pacientes con TVP o EP no provocada que estén considerando dejar de tomar anticoagulantes, aunque estas guías de práctica clínica recomiendan buscar el consejo de un especialista, ya que estas pruebas pueden verse afectadas por los anticoagulantes y la trombosis aguda).[20]National Institute for Health and Care Excellence. Venous thromboembolic diseases: diagnosis, management and thrombophilia testing. Aug 2023 [internet publication].
https://www.nice.org.uk/guidance/ng158
[169]Stevens SM, Woller SC, Bauer KA, et al. Guidance for the evaluation and treatment of hereditary and acquired thrombophilia. J Thromb Thrombolysis. 2016 Jan;41(1):154-64.
https://link.springer.com/article/10.1007/s11239-015-1316-1
http://www.ncbi.nlm.nih.gov/pubmed/26780744?tool=bestpractice.com
Para el cribado de anticuerpos antifosfolípidos, los anticuerpos cardiolipina y beta-2 glucoproteína-I pueden realizarse sin tener en cuenta la presencia de anticoagulantes; pero la mayoría de los anticoagulantes interfieren con los ensayos del anticoagulante lúpico.[65]Garcia D, Erkan D. Diagnosis and management of the antiphospholipid syndrome. N Engl J Med. 2018 May 24;378(21):2010-21.
http://www.ncbi.nlm.nih.gov/pubmed/29791828?tool=bestpractice.com
Otras pruebas diagnósticas
electrocardiograma (ECG)
El ECG no puede establecer ni eliminar definitivamente el diagnóstico de EP, y los hallazgos específicos sólo pueden sugerir una EP.[118]Bajaj N, Bozarth AL, Guillot J, et al. Clinical features in patients with pulmonary embolism at a community hospital: analysis of 4 years of data. J Thromb Thrombolysis. 2014 Apr;37(3):287-92.
http://www.ncbi.nlm.nih.gov/pubmed/23681675?tool=bestpractice.com
[174]Brown G, Hogg K. Best evidence topic report: diagnostic utility of electrocardiogram for diagnosing pulmonary embolism. Emerg Med J. 2005 Oct;22(10):729-30.
http://emj.bmj.com/content/22/10/729.2.long
http://www.ncbi.nlm.nih.gov/pubmed/16189038?tool=bestpractice.com
[175]Sukhija R, Aronow WS, Ahn C, et al. Electrocardiographic abnormalities in patients with right ventricular dilation due to acute pulmonary embolism. Cardiology. 2006;105(1):57-60.
http://www.ncbi.nlm.nih.gov/pubmed/16254425?tool=bestpractice.com
No obstante, se pueden usar los ECG para evaluar la función ventricular derecha en pacientes con EP que no presentan shock ni hipotensión.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
[19]Stevens SM, Woller SC, Baumann Kreuziger L, et al. Antithrombotic therapy for VTE disease: second update of the CHEST guideline and expert panel report. 2021 Dec;160(6):e545-608.
https://journal.chestnet.org/article/S0012-3692(21)01506-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34352278?tool=bestpractice.com
La disfunción ventricular derecha es predictiva de resultados adversos y permite la estratificación del riesgo en estos pacientes.[176]Vanni S, Polidori G, Vergara R, et al. Prognostic value of ECG among patients with acute pulmonary embolism and normal blood pressure. Am J Med. 2009 Mar;122(3):257-64.
http://www.ncbi.nlm.nih.gov/pubmed/19272487?tool=bestpractice.com
[177]Jaff MR, McMurtry MS, Archer SL, et al. Management of massive and submassive pulmonary embolism, iliofemoral deep vein thrombosis, and chronic thromboembolic pulmonary hypertension: a scientific statement from the American Heart Association. Circulation. 2011 Apr 26;123(16):1788-830.
http://circ.ahajournals.org/content/123/16/1788.long
http://www.ncbi.nlm.nih.gov/pubmed/21422387?tool=bestpractice.com
[178]Weekes AJ, Thacker G, Troha D, et al. Diagnostic accuracy of right ventricular dysfunction markers in normotensive emergency department patients with acute pulmonary embolism. Ann Emerg Med. 2016 Sep;68(3):277-91.
http://www.ncbi.nlm.nih.gov/pubmed/26973178?tool=bestpractice.com
Gasometría arterial (GSA)
El análisis GSA tiene una utilidad diagnóstica muy limitada en caso de sospecha de EP, ya sea por sí misma o en combinación con otras variables clínicas.[179]Rodger MA, Carrier M, Jones GN, et al. Diagnostic value of arterial blood gas measurement in suspected pulmonary embolism. Am J Respir Crit Care Med. 2000 Dec;162(6):2105-8.
https://www.atsjournals.org/doi/full/10.1164/ajrccm.162.6.2004204
http://www.ncbi.nlm.nih.gov/pubmed/11112122?tool=bestpractice.com
Se considera que la hipoxemia es un hallazgo típico en el EP agudo, pero el análisis de la gasometría arterial tiene una utilidad diagnóstica muy limitada, ya sea por sí sola o en combinación con otras variables clínicas, si se sospecha EP.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
[179]Rodger MA, Carrier M, Jones GN, et al. Diagnostic value of arterial blood gas measurement in suspected pulmonary embolism. Am J Respir Crit Care Med. 2000 Dec;162(6):2105-8.
https://www.atsjournals.org/doi/full/10.1164/ajrccm.162.6.2004204
http://www.ncbi.nlm.nih.gov/pubmed/11112122?tool=bestpractice.com
Un PaO₂ <80 mmHg, un PaCO₂ <36 mmHg o un gradiente alveolo-arterial (A-aO₂) anormal no son factores predictivos de EP en pacientes con sospecha de EP.[179]Rodger MA, Carrier M, Jones GN, et al. Diagnostic value of arterial blood gas measurement in suspected pulmonary embolism. Am J Respir Crit Care Med. 2000 Dec;162(6):2105-8.
https://www.atsjournals.org/doi/full/10.1164/ajrccm.162.6.2004204
http://www.ncbi.nlm.nih.gov/pubmed/11112122?tool=bestpractice.com
En los pacientes con sospecha de EP aguda con resultados normales de la GSA, no se pudo descartar la EP en el 38% de los que no presentaban enfermedad cardiopulmonar y en el 14% con enfermedad cardiopulmonar preexistente, respectivamente.[180]Stein PD, Goldhaber SZ, Henry JW, et al. Arterial blood gas analysis in the assessment of suspected acute pulmonary embolism. Chest. 1996 Jan;109(1):78-81.
http://www.ncbi.nlm.nih.gov/pubmed/8549223?tool=bestpractice.com
Pruebas para enfermedades subyacentes
Un cáncer oculto está presente en aproximadamente 3 a 5% de los pacientes con una TVP no provocada.[181]Timp JF, Braekkan SK, Versteeg HH, et al. Epidemiology of cancer-associated venous thrombosis. Blood. 2013 Sep 5;122(10):1712-23.
https://ashpublications.org/blood/article/122/10/1712/31702/Epidemiology-of-cancer-associated-venous
http://www.ncbi.nlm.nih.gov/pubmed/23908465?tool=bestpractice.com
Sin embargo, las pruebas diagnósticas extensas (más allá de los análisis clínicos de rutina y las pruebas de cribado de rutina adecuados para la edad) para el cáncer en pacientes con una primera TVP no provocada no están indicadas de manera rutinaria, porque no se ha demostrado de manera convincente que mejoren el pronóstico o la mortalidad.[182]Piccioli A, Lensing AW, Prins MH, et al. Extensive screening for occult malignant disease in idiopathic venous thromboembolism: a prospective randomized clinical trial. J Thromb Haemost. 2004 Jun;2(6):884-9.
https://www.jthjournal.org/article/S1538-7836(22)15798-3/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/15140122?tool=bestpractice.com
[183]Prandoni P, Falanga A, Piccioli A. Cancer and venous thromboembolism. Lancet Oncol. 2005 Jun;6(6):401-10.
http://www.ncbi.nlm.nih.gov/pubmed/15925818?tool=bestpractice.com
[184]Carrier M, Lazo-Langner A, Shivakumar S, et al. Screening for occult cancer in unprovoked venous thromboembolism. N Engl J Med. 2015 Aug 20;373(8):697-704.
http://www.ncbi.nlm.nih.gov/pubmed/26095467?tool=bestpractice.com
[185]Robertson L, Broderick C, Yeoh SE, et al. Effect of testing for cancer on cancer- or venous thromboembolism (VTE)-related mortality and morbidity in people with unprovoked VTE. Cochrane Database Syst Rev. 2021 Oct 1;10(10):CD010837.
https://pmc.ncbi.nlm.nih.gov/articles/PMC8486018
http://www.ncbi.nlm.nih.gov/pubmed/34597414?tool=bestpractice.com
Se deben buscar signos o síntomas que sugieran una posible neoplasia maligna, si están presentes.
Poblaciones de pacientes especiales
Embarazo
Los síntomas y signos de TEV pueden ser menos específicos en mujeres embarazadas que cuando no hay embarazo.[124]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.
http://www.onlinejacc.org/content/67/8/976
http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com
Los niveles de dímero D aumentan durante el embarazo normal, lo que complica su uso como prueba para descartar la sospecha de EP.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
Sin embargo, la creciente evidencia apoya el uso de algoritmos de probabilidad previos a la prueba adaptados a pacientes embarazadas con dímero D.[136]van der Pol LM, Tromeur C, Bistervels IM, et al. Pregnancy-adapted YEARS algorithm for diagnosis of suspected pulmonary embolism. N Engl J Med. 2019 Mar 21;380(12):1139-49.
https://www.nejm.org/doi/10.1056/NEJMoa1813865
http://www.ncbi.nlm.nih.gov/pubmed/30893534?tool=bestpractice.com
[186]Righini M, Robert-Ebadi H, Elias A, et al. Diagnosis of pulmonary embolism during pregnancy: a multicenter prospective management outcome study. Ann Intern Med. 2018 Oct 23;169(11):766-73.
https://www.doi.org/10.7326/M18-1670
http://www.ncbi.nlm.nih.gov/pubmed/30357273?tool=bestpractice.com
Las guías de práctica clínica apoyan el uso de algoritmos de varios pasos en comparación con los estudios por imágenes universales en pacientes embarazadas con sospecha de EP.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
Cuando un algoritmo indica que los estudios por imágenes están indicados en una paciente embarazada con sospecha de una EP, se debe minimizar la exposición a los estudios por imágenes asociados a la radiación. Se recomienda la ecografía de compresión venosa bilateral para establecer la presencia de trombosis sugestiva de EP en pacientes embarazadas con sospecha de EP, ya que la identificación de TVP puede impulsar la instauración de tratamiento sin necesidad de confirmar la EP. Sin embargo, la ecografía normal no descarta la EP.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
[167]Leung AN, Bull TM, Jaeschke R, et al. An official American Thoracic Society/Society of Thoracic Radiology clinical practice guideline: evaluation of suspected pulmonary embolism in pregnancy. Am J Respir Crit Care Med. 2011 Nov 15;184(10):1200-8.
https://www.atsjournals.org/doi/full/10.1164/rccm.201108-1575ST#.UnJdTVNZit8
http://www.ncbi.nlm.nih.gov/pubmed/22086989?tool=bestpractice.com
La radiografía de tórax es el primer procedimiento asociado a radiación en caso de sospecha de EP.[167]Leung AN, Bull TM, Jaeschke R, et al. An official American Thoracic Society/Society of Thoracic Radiology clinical practice guideline: evaluation of suspected pulmonary embolism in pregnancy. Am J Respir Crit Care Med. 2011 Nov 15;184(10):1200-8.
https://www.atsjournals.org/doi/full/10.1164/rccm.201108-1575ST#.UnJdTVNZit8
http://www.ncbi.nlm.nih.gov/pubmed/22086989?tool=bestpractice.com
Si la radiografía de tórax es normal, la guía de práctica clínica consensuada de la American Thoracic Society recomienda usar escintigrafía pulmonar (con gammagrafía de V/P).[167]Leung AN, Bull TM, Jaeschke R, et al. An official American Thoracic Society/Society of Thoracic Radiology clinical practice guideline: evaluation of suspected pulmonary embolism in pregnancy. Am J Respir Crit Care Med. 2011 Nov 15;184(10):1200-8.
https://www.atsjournals.org/doi/full/10.1164/rccm.201108-1575ST#.UnJdTVNZit8
http://www.ncbi.nlm.nih.gov/pubmed/22086989?tool=bestpractice.com
Las mujeres embarazadas con una gammagrafía de V/P no diagnóstica para las que se considera adecuado seguir haciendo pruebas diagnósticas, pueden someterse a una APTC.[167]Leung AN, Bull TM, Jaeschke R, et al. An official American Thoracic Society/Society of Thoracic Radiology clinical practice guideline: evaluation of suspected pulmonary embolism in pregnancy. Am J Respir Crit Care Med. 2011 Nov 15;184(10):1200-8.
https://www.atsjournals.org/doi/full/10.1164/rccm.201108-1575ST#.UnJdTVNZit8
http://www.ncbi.nlm.nih.gov/pubmed/22086989?tool=bestpractice.com
Las guías de práctica clínica de la Sociedad Europea de Cardiología sugieren la realización de una APTC en pacientes con radiografía de tórax anormal y una gammagrafía V/Q o una APTC si la radiografía de tórax es normal.[3]Konstantinides SV, Meyer G, Becattini C, et al. 2019 ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603.
https://academic.oup.com/eurheartj/article/41/4/543/5556136
Cuando la gammagrafía de pulmón está indicada en una mujer embarazada, la dosis administrada de radiofármaco debe dividirse por un factor de 2; se deben usar mayores tiempos de adquisición para conseguir imágenes adecuadas.[154]Phillips JJ, Straiton J, Staff RT. Planar and SPECT ventilation/perfusion imaging and computed tomography for the diagnosis of pulmonary embolism: a systematic review and meta-analysis of the literature, and cost and dose comparison. Eur J Radiol. 2015 Jul;84(7):1392-400.
http://www.ncbi.nlm.nih.gov/pubmed/25868674?tool=bestpractice.com
Adolescentes y adultos jóvenes
La angiografía pulmonar por tomografía computarizada (APTC) se debe usar con prudencia, especialmente si se puede descartar la EP mediante otros métodos no invasivos con menos exposición a la radiación.[151]Arnold RW, Janitz E, Poulton TB, et al. Pulmonary CT angiography to evaluate for pulmonary embolism in children visiting adult-centered community hospitals. AJR Am J Roentgenol. 2011 Jun;196(6):W823-30.
https://www.ajronline.org/doi/full/10.2214/AJR.10.5951
http://www.ncbi.nlm.nih.gov/pubmed/21606276?tool=bestpractice.com
[152]Thacker PG, Lee EY. Pulmonary embolism in children. AJR Am J Roentgenol. 2015 Jun;204(6):1278-88.
https://www.ajronline.org/doi/10.2214/AJR.14.13869
http://www.ncbi.nlm.nih.gov/pubmed/26001239?tool=bestpractice.com
Si se utiliza, la exposición a las radiaciones ionizantes debe monitorizarse y minimizarse con cuidado.[153]Tang CX, Schoepf UJ, Chowdhury SM, et al. Multidetector computed tomography pulmonary angiography in childhood acute pulmonary embolism. Pediatr Radiol. 2015 Sep;45(10):1431-9.
https://www.doi.org/10.1007/s00247-015-3336-6
http://www.ncbi.nlm.nih.gov/pubmed/25846076?tool=bestpractice.com


 Si no se dispone de una modalidad de estudios por imágenes definitiva, se puede considerar la ecocardiografía en pacientes con sospecha de EP que presentan shock o hipotensión.[3][124]
Si no se dispone de una modalidad de estudios por imágenes definitiva, se puede considerar la ecocardiografía en pacientes con sospecha de EP que presentan shock o hipotensión.[3][124]