Etiología
La mayor fuente de vitamina D para la mayoría de los seres humanos es la exposición a la luz solar. Evitar la exposición al sol, incluido el uso de ropa que cubra la mayor parte de la piel (p. ej., velos) al estar confinado en casa, la estación, la latitud y la hora del día influyen fuertemente en la producción cutánea de vitamina D.[3][15] El aumento de la pigmentación de la piel da como resultado una fotoproducción menos eficaz de vitamina D.[15][66] El envejecimiento también se considera un factor de riesgo de deficiencia de vitamina D, ya que la capacidad de la piel para producirla disminuye con la edad.[15][67] El aumento de la concentración sanguínea de vitamina D en adultos jóvenes de entre 20 y 30 años tras la exposición a la radiación ultravioleta B es al menos tres veces superior en comparación con los adultos mayores de entre 62 y 80 años.[15]
La ingesta inadecuada de vitamina D a través de la dieta y de suplementos es otra causa importante de deficiencia de vitamina D.[16] Los lactantes que se alimentan exclusivamente de leche materna, sin suplementos de vitamina D, presentan un riesgo especial.[68][69] Al nacer, la mayoría de los niños extremadamente prematuros presentan una deficiencia bioquímica de vitamina D. El riesgo se reduce o se puede prevenir con la suplementación de vitamina D.[70] Los pacientes con síndromes de malabsorción intestinal, como enfermedad celíaca, fibrosis quística, enfermedad de Crohn, enfermedad de Whipple o síndrome del intestino corto, así como los que se sometieron a una cirugía de derivación gástrica, son incapaces de absorber la vitamina D o bien la absorben de manera insuficiente.[71] También existe una posible relación bidireccional por la que un estado deficiente de vitamina D puede repercutir negativamente en la evolución clínica de la enfermedad intestinal subyacente, en particular las enfermedades intestinales inflamatorias (enfermedad de Crohn, colitis ulcerosa), ya que la vitamina D tiene el potencial de regular la inmunidad de la mucosa intestinal.[71]
La insuficiencia hepática grave está asociada a la carencia de vitamina D.[72] Los mecanismos potenciales de la deficiencia de vitamina D en la enfermedad hepática crónica incluyen la reducción de las fuentes exógenas de vitamina D (dieta, exposición limitada a la luz solar), la malabsorción intestinal de vitamina D debido a la colestasis, la reducción de la producción de proteína fijadora de vitamina D y de albúmina debido a la lesión hepática, la hidroxilación hepática alterada y el aumento del catabolismo de 25-hidroxivitamina D.[73] Cuando falla más del 90% del hígado, éste es incapaz de producir suficiente 25-hidroxivitamina D.[7]
La vitamina D es liposoluble: cuando se ingiere o se produce en la piel, la mayor parte de ella se incorpora inicialmente a la grasa corporal. Para los adultos con un IMC >30 kg/m² de tejido adiposo secuestra vitamina D; por lo tanto, la obesidad aumenta el riesgo de deficiencia de vitamina D.[74] Los adultos obesos necesitan de dos a tres veces más vitamina D tanto para tratar la deficiencia de vitamina D como para prevenir su recurrencia.[75]
El uso de determinados fármacos, como los glucocorticoides, los anticonvulsivos, el tratamiento antirretroviral (TARV), la rifampicina y la hierba de San Juan, también puede provocar deficiencia de vitamina D debido a la activación de los receptores de esteroides y xenobióticos, lo que da lugar a la activación de enzimas que destruyen la 25-hidroxivitamina D y la 1,25-dihidroxivitamina D.[76]
No es habitual que se produzca un síndrome similar a la deficiencia de vitamina D como resultado de alteraciones hereditarias que reducen o previenen el metabolismo de la vitamina D a 25-hidroxivitamina D o de 25-hidroxivitamina D a 1,25-hidroxivitamina D.[9] Entre ellos se incluyen el raquitismo dependiente de la vitamina D, el raquitismo hipofosfatémico ligado al cromosoma X y el raquitismo hipofosfatémico autosómico dominante.[10][12]
Las alteraciones adquiridas del metabolismo de la vitamina D, como la enfermedad renal crónica, dan lugar a la retención de fosfato, lo que provoca un aumento en la producción del factor de crecimiento de fibroblastos 23 (FGF-23) por parte de los osteocitos. El FGF-23 inhibe la producción de 1,25-hidroxivitamina D e inicialmente resulta en hiperparatiroidismo secundario.[13] Los pacientes con ERC son incapaces de producir suficiente 1,25-dihidroxivitamina D para regular el metabolismo del calcio. En las etapas iniciales de la ERC (estadio 2: FG 60-89 mL/min/1.73 m²; etapa 3A: FG 45-59 ml/min/1.73 m²), la retención de fosfato provoca un aumento de los niveles séricos de FGF-23, lo que a su vez disminuye la eficacia de los riñones para producir 1,25-dihidroxivitamina D. En etapas posteriores (etapa 3B: TFG 30-44 mL/min/1.73 m²; etapa 4: FG 15-29 mL/min/1.73 m²; y etapa 5: FG <15 ml/min/1.73 m²), los riñones son incapaces de producir una cantidad adecuada de 1.25 - dihidroxivitamina D para mantener el metabolismo del calcio. La incapacidad de producir una cantidad suficiente de 1,25-dihidroxivitamina D provoca hiperparatiroidismo secundario y enfermedad ósea metabólica por ERC.[77]
Alteraciones granulomatosas (p. ej, sarcoidosis y tuberculosis), hiperparatiroidismo primario e hipertiroidismo provocan un aumento del metabolismo de la 25-hidroxivitamina D a 1,25-hidroxivitamina D. El aumento de la producción de 1,25-hidroxivitamina D produce un aumento de la expresión y producción de la 25-hidroxivitamina D-24-hidroxilasa en los riñones, la cual cataboliza la 25-hidroxivitamina D a un metabolito inactivo hidrosoluble en agua, resultando en reducción de los niveles de 25-hidroxivitamina D.[7] Además, un tumor benigno o maligno puede producir una cantidad excesiva de factor de crecimiento de fibroblastos 23 (FGF-23), lo que produce hipofosfatemia grave, niveles bajos de 1,25-hidroxivitamina D sérica y, en consecuencia, osteomalacia oncogénica (conocida también por osteomalacia inducida por tumor).[8]
Fisiopatología
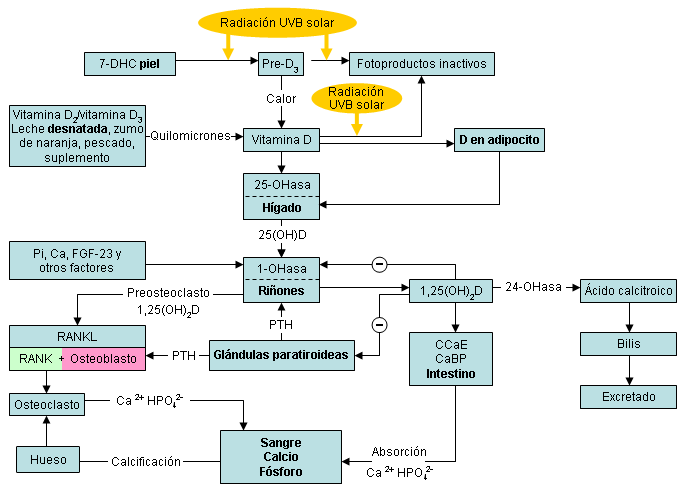
Metabolismo normal de la vitamina D, y acciones sobre el metabolismo del calcio y del fosfato
La vitamina D3 obtenida a partir de la producción inducida por el sol en la piel, y la vitamina D2 o vitamina D3 obtenida a partir de la dieta, son biológicamente inactivas y requieren hidroxilación en el hígado para formar 25-hidroxivitamina D. Ésta es la principal forma circulante de vitamina D utilizada para determinar el estado de vitamina D. La 25-hidroxivitamina D también es inactiva y se hidroxila en los riñones para convertirse en 1,25-hidroxivitamina D.[3][7]
Una vez formada, la 1,25-hidroxivitamina D se dirige hacia al intestino delgado e interactúa con su receptor nuclear (receptor de vitamina D [VDR]) para mejorar la eficiencia del intestino en la absorción del calcio de la dieta. En un estado de deficiencia de vitamina D, solo se absorbe entre el 10% y el 15% del calcio de la dieta, mientras que la suficiencia de vitamina D mejora la absorción de calcio intestinal en el rango del 30% al 40%.[7] A veces, cuando hay un gran aumento en el requerimiento de calcio (incluyendo en adolescentes durante su período de crecimiento, embarazo y lactancia), la eficiencia aumenta hasta un 60% a 80%.
La 1,25-hidroxivitamina D también aumenta la absorción de fosfato principalmente en el yeyuno. En un estado de deficiencia de vitamina D se absorbe aproximadamente el 60% del fosfato de la dieta, y en un estado de suficiencia de vitamina D esto mejora en un 80% aproximadamente.[7] La 1,25-hidroxivitamina D interactúa con su receptor de vitamina D (RVD) en los osteoblastos. Esto resulta en un aumento en la expresión y producción de la proteína no colágena más importante en el hueso, la osteocalcina. Además, estimula la expresión y producción del ligando del receptor activador del factor nuclear kappa B (RANKL). Esta proteína se une al receptor (RANK) RANKL en los monocitos. Esta interacción induce a estos monocitos a unirse y convertirse en un osteoclasto multinucleado que libera colagenasas e hidrocloruro para destruir la matriz y liberar el calcio en la circulación.[7][Figure caption and citation for the preceding image starts]: Producción, metabolismo y funciones biológicas de la vitamina D sobre el metabolismo del calcio y la salud ósea (D representa D2 y D3). Abreviaturas: CaBP, calbindina; CCaE, canal de calcio epitelial; GF-23, factor de crecimiento de fibroblastos 23; preD3, previtamina D3; RANKL, ligando del activador del receptor del factor nuclear kappa B; 1,25(OH)2D, 1,25-hidroxivitamina D; 1-OHasa, 25-hidroxivitamina-1-hidroxilasa; 7-DHC, 7-dehidrocolesterol; 24-OHasa, 1,25-hidroxivitamina D-24-hidroxilasa; 25-OHasa, vitamina D-25-hidroxilasa; 25(OH)D, 25-hidroxivitamina DCreado por M.F. Holick, PhD, MD; usado con autorización [Citation ends].
 [Figure caption and citation for the preceding image starts]: Estructura química de la vitamina DDe la colección de M.F. Holick, PhD, MD; usado con autorización [Citation ends].
[Figure caption and citation for the preceding image starts]: Estructura química de la vitamina DDe la colección de M.F. Holick, PhD, MD; usado con autorización [Citation ends].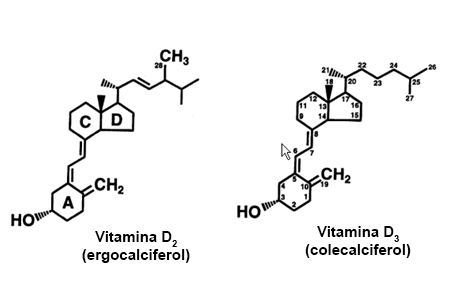
Acción ósea de la vitamina D
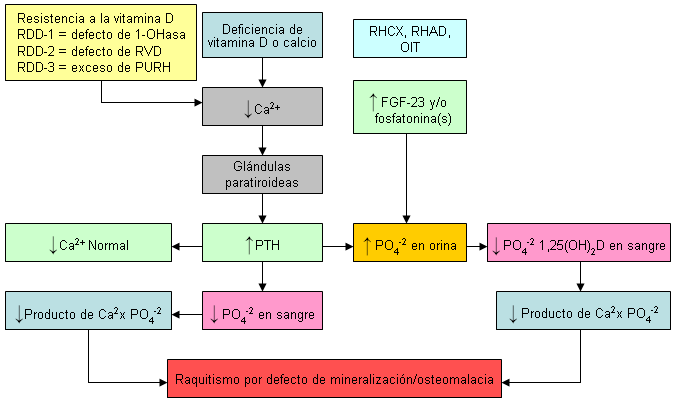
Niños: la deficiencia de vitamina D es la causa más común de raquitismo.[3][9] La carencia de vitamina D impide la absorción eficaz del calcio y el fósforo de la dieta. La mala absorción del calcio provoca una disminución del calcio ionizado sérico, lo que produce hiperparatiroidismo secundario. La hormona paratiroidea (HPT) disminuye la reabsorción del fósforo en el riñón, lo que genera una pérdida del fósforo en orina. Por lo tanto, el calcio sérico es generalmente normal en un lactante o niño con deficiencia de vitamina D. Sin embargo, el nivel de fósforo sérico es bajo o normal-bajo y, por lo tanto, hay un producto calcio-fósforo inadecuado, lo que causa un defecto en la mineralización de la matriz de colágeno.
Adultos: la deficiencia de vitamina D produce un aumento en los niveles de PTH, lo que, a su vez, aumentan la actividad osteoclástica y tiene como consecuencia la eliminación de la matriz y minerales del esqueleto. Como resultado, la deficiencia de vitamina D en los adultos reduce el contenido mineral óseo, lo que conduce a osteopenia y osteoporosis. Además, el hiperparatiroidismo secundario provoca una pérdida de fósforo en los riñones, lo que genera un nivel de calcio sérico normal con un nivel de fósforo sérico normal-bajo. Ello causa un bajo producto calcio-fósforo en la sangre, lo que imposibilita la mineralización de la matriz de colágeno y conduce a la osteomalacia. Por lo tanto, en el caso de los adultos, la deficiencia de vitamina D está ligada a un nivel de calcio sérico normal, fósforo sérico normal-bajo o normal, PTH elevado y fosfatasa alcalina normal o elevado. El nivel de 25-hidroxivitamina D en la sangre es <75 nanomoles/L (<30 nanogramos/mL) y el nivel de 1,25-dihidroxivitamina D es por lo general normal o elevado.[3][7][Figure caption and citation for the preceding image starts]: Efectos diferenciales de diversos trastornos de calcio, fosfato, óseos, y de metabolismo de vitamina D en los niveles séricos de calcio, fosfato, y 1,25-dihidroxivitamina D. Abreviaturas: ADHR, raquitismo hipofosfatémico autosomal dominante; FGF-23, factor de crecimiento fibroblasto 23; HRBP, proteína de fijación ribonucleica heterologa; TIO, osteomalacia inducida por tumor; VDR, resistente a la vitamina D; XLHR, raquitismo hipofosfatémico ligado al cromosoma X; 1-OHase, 25-hydroxivitamina-1-hidrolasaCreado por M.F. Holick, PhD, MD; usado con autorización [Citation ends].
 [Figure caption and citation for the preceding image starts]: Biopsia ósea de hueso trabecular que demuestra (A) aumento de la actividad osteoclástica debido a hiperparatiroidismo secundario; (B) normal; y (C) amplias suturas osteoides (zona de color rosa claro), típicas de la osteomalaciaDe la colección de M.F. Holick, PhD, MD; usado con autorización [Citation ends].
[Figure caption and citation for the preceding image starts]: Biopsia ósea de hueso trabecular que demuestra (A) aumento de la actividad osteoclástica debido a hiperparatiroidismo secundario; (B) normal; y (C) amplias suturas osteoides (zona de color rosa claro), típicas de la osteomalaciaDe la colección de M.F. Holick, PhD, MD; usado con autorización [Citation ends].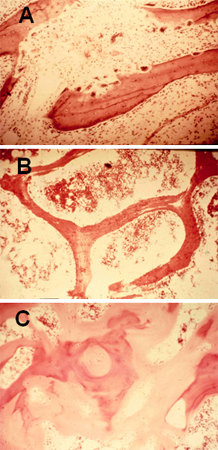
Acción no ósea de la vitamina D
La mayoría de los tejidos y células del cuerpo tienen un receptor de vitamina D. Además, la 25-hidroxivitamina D-1-hidroxilasa capaz de convertir la 25-hidroxivitamina D en 1,25-hidroxivitamina D está presente en muchos de estos tejidos y células.[3][7][26]
La vitamina D es un factor importante en la modulación inmune. Los linfocitos T y B activados poseen un receptor de vitamina D, y sus actividades inmunológicas están reguladas por la 1,25-hidroxivitamina D.[3][26] Los macrófagos fabrican 1,25-dihidroxivitamina D con el fin de inducir la producción de catelicidina, una proteína que mata a los agentes infecciosos, incluido el Mycobacterium tuberculosis.[63] Además, la 1,25-hidroxivitamina D producida en monocitos o macrófagos se libera, muy probablemente, para actuar localmente sobre los linfocitos T y B activados, que regulan la síntesis de citocinas e inmunoglobulinas, respectivamente. Se cree que estas acciones inmunológicas juegan un papel en la reducción del riesgo de enfermedades autoinmunes y enfermedades infecciosas.[26]
Está demostrado que el riesgo de cánceres habituales se reduce en presencia de niveles normales de 25-hidroxivitamina D. Se cree que ello se debe a la producción de 1,25-hidroxivitamina D en la mama, colon, próstata y otros tejidos, manteniendo la proliferación y diferenciación celulares normales. Se cree que el efecto de la vitamina D sobre la reducción de la diabetes de tipo 2 se debe a que la 1,25-hidroxivitamina D (producida en los riñones) entra en la circulación, regula a la baja la producción de renina renal y estimula la secreción de insulina en el páncreas.[3][7][Figure caption and citation for the preceding image starts]: Producción extrarrenal de 1,25-hidroxivitamina D para modular la función inmunitaria, el crecimiento celular y la producción de insulina. Abreviaturas: BA, linfocito B activado; TA, linfocito T activado; G, glucemia; CD, catelicidina; LPS, lipopolisacárido; TLR, receptor tipo Toll; RVD-RRX, receptor de vitamina D-receptor de retinoide X; 1,25(OH)2D, 1,25-hidroxivitamina D; 1-OHasa, 25-hidroxivitamina-1-hidroxilasa; 24-OHasa, 1,25-hidroxivitamina D-24-hidroxilasa; 25(OH)D, 25-hidroxivitamina DCreado por M.F. Holick, PhD, MD; usado con autorización [Citation ends].
 [Figure caption and citation for the preceding image starts]: Representación esquemática de la función paracrina e intracrina de la vitamina D y sus metabolitos y de las acciones de la 1,25-dihidroxivitamina D sobre los sistemas inmunitarios innato y adaptativo. Abreviaturas: 1,25(OH)2D: 1,25-dihidroxivitamina D; 25(OH)D: 25-hidroxivitamina D, IFN-Ƴ: interferón- Ƴ; IL: interleucina; CMH: complejo de histocompatibilidad de membrana, TH1: T helper 1; TH2: T helper 2; TH17: T helper 17; Treg: célula T reguladora, TNF-α: Factor de necrosis tumoral-α; TLR2: receptor tipo Toll 2; TLR4: receptor tipo Toll 4.Reproducido con permiso de Holick MF, copyright 2020 [Citation ends].
[Figure caption and citation for the preceding image starts]: Representación esquemática de la función paracrina e intracrina de la vitamina D y sus metabolitos y de las acciones de la 1,25-dihidroxivitamina D sobre los sistemas inmunitarios innato y adaptativo. Abreviaturas: 1,25(OH)2D: 1,25-dihidroxivitamina D; 25(OH)D: 25-hidroxivitamina D, IFN-Ƴ: interferón- Ƴ; IL: interleucina; CMH: complejo de histocompatibilidad de membrana, TH1: T helper 1; TH2: T helper 2; TH17: T helper 17; Treg: célula T reguladora, TNF-α: Factor de necrosis tumoral-α; TLR2: receptor tipo Toll 2; TLR4: receptor tipo Toll 4.Reproducido con permiso de Holick MF, copyright 2020 [Citation ends].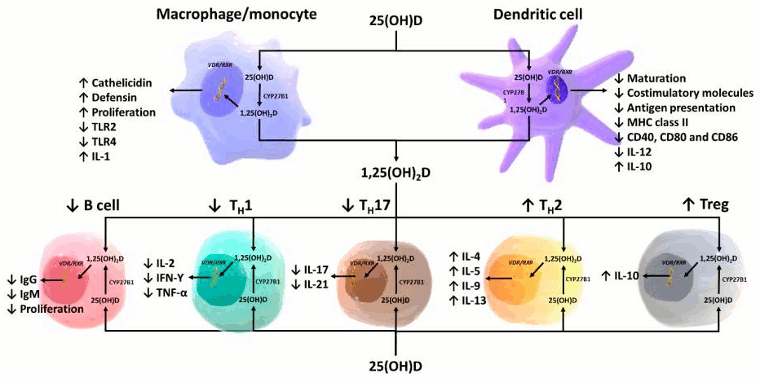
Clasificación
Clasificación etiológica[3][7]
Adquirida:
Nutricional
En relación con la deficiencia en la dieta, malabsorción o falta de exposición a la luz ultravioleta B.
Inducida por fármacos
Debido a la destrucción de 25-hidroxivitamina D y 1,25-hidroxivitamina D.
Enfermedad renal crónica
Debido a la reducción de la síntesis de 1,25-hidroxivitamina D.
Enfermedades granulomatosas
Los macrófagos en el granuloma pueden provocar un aumento del metabolismo de la 25-hidroxivitamina D a 1,25-hidroxivitamina D, lo que causa una mayor expresión de la enzima 24-hidroxilasa, lo que a su vez aumenta la destrucción de la 25-hidroxivitamina D y 1,25-hidroxivitamina D y, en consecuencia, produce deficiencia de vitamina D. Los niveles elevados de 1,25-hidroxivitamina D en la sangre pueden causar hipercalciuria e hipercalcemia.
Hiperparatiroidismo primario
Debido al aumento del metabolismo de la 25-hidroxivitamina D a 1,25-hidroxivitamina D. Sin embargo, es el aumento de la producción de 1,25-dihidroxivitamina D lo que aumenta la actividad de la 25-hidroxivitamina D-24-hidroxilasa (CYP24A), que a su vez metaboliza 25-hidroxivitamina D y 1,25-hidroxivitamina D a metabolitos inactivos solubles en agua.
Hipertiroidismo
Debido al mayor metabolismo de 25-hidroxivitamina D.
Osteomalacia oncogénica
Debido a la producción de factor de crecimiento de fibroblastos 23 (FGF-23) por un tumor benigno o maligno; la hiperfosfaturia y la hipofosfatemia graves resultantes producen osteomalacia. El FGF-23 inhibe la 25-hidroxivitamina D-1α-hidroxilasa renal, lo que da lugar a niveles bajos de 1,25-dihidroxivitamina D sérica.[8]
Hereditaria:[9]
Raquitismo dependiente de la vitamina D de tipo 1
Debido a una mutación puntual de la 25-hidroxivitamina D-1α-hidroxilasa o a mutaciones en CYP2R1 que disminuyen la expresión o la función de la enzima CYP2R1 codificada, la principal 25-hidroxilasa; asociada a un nivel bajo o indetectable de 1,25-dihidroxivitamina D sérica.[10]
Raquitismo dependiente de la vitamina D tipo 2 (también conocido como raquitismo resistente a la vitamina D)
Debido a mutaciones del gen del receptor de la vitamina D (RVD); asociado a un nivel muy elevado de 1.25-dihidroxivitamina D sérica.[10]
Raquitismo vitamina D dependiente tipo III
Debido a una mutación del gen CYP3A4 que provoca un marcado aumento del catabolismo de la 1,25-dihidroxivitamina D. Los individuos tienen concentraciones séricas detectables de la vitamina D3 biológicamente inactiva (generada por la exposición al sol u obtenida de la dieta) pero concentraciones séricas bajas de los metabolitos de la vitamina D 25-hidroxivitamina D y 1,25-dihidroxivitamina D.[11]
Raquitismo hipofosfatémico ligado al cromosoma X
Debido a una mutación del gen PHEX que resulta en una disminución del metabolismo de FGF-23, lo que produce hiperfosfaturia e hipofosfatemia graves, conduciendo a raquitismo grave. El nivel de 1,25-hidroxivitamina D sérica es inadecuadamente bajo para la presencia de hipofosfatemia.[12]
Raquitismo hipofosfatémico autosómico dominante
Debido a una mutación en el gen FGF-23 en una posición donde la proteína resultante es menos sensible a la proteólisis, lo que produce niveles marcadamente elevados de FGF-23 causando hiperfosfaturia e hipofosfatemia graves, conduciendo a raquitismo severo. El nivel de 1,25-hidroxivitamina D sérica es inadecuadamente bajo para la presencia de hipofosfatemia.[12]
El uso de este contenido está sujeto a nuestra cláusula de exención de responsabilidad