O câncer de mama pode se manifestar como uma massa mamária firme e indolor, especialmente quando descoberto nos estádios iniciais. Os aspectos que corroboram o diagnóstico incluem:
Aumento do tamanho da massa (a doença fibrocística pode oscilar de tamanho com o ciclo menstrual, mas o câncer de mama aumenta progressivamente de tamanho independentemente do ciclo menstrual)
Descarga mamilar
Linfadenopatia axilar
Espessamento ou descoloração da pele (mais provavelmente associado ao câncer de mama localmente avançado ou inflamatório)[136]Ho CM, Mak CK, Lau Y, et al. Skin involvement in invasive breast carcinoma: safety of skin-sparing mastectomy. Ann Surg Oncol. 2003 Mar;10(2):102-7.
http://www.ncbi.nlm.nih.gov/pubmed/12620902?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: Pele em casca de laranjaDo acervo da Dra. Amal Melhem-Bertrandt; usado com permissão [Citation ends].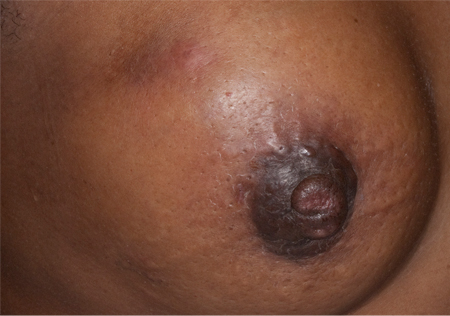
Retração, inversão ou descamação do mamilo (pode estar relacionada à doença de Paget da mama ou câncer de mama localmente avançado em associação com uma grande massa mamária com/sem envolvimento do mamilo ou da pele).[Figure caption and citation for the preceding image starts]: Retração e assimetria do mamiloDo acervo da Dra. Amal Melhem-Bertrandt; usado com permissão [Citation ends].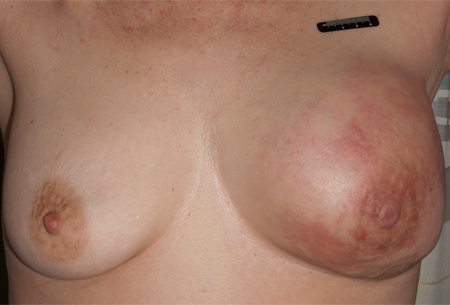
O câncer de mama nem sempre se apresenta com uma nova massa mamária. O câncer de mama pode se apresentar como anormalidades mamográficas detectadas em exames de rastreamento de rotina. Estes podem incluir calcificações com morfologia suspeita (por exemplo, calcificações lineares finas, ramificadas ou pleomórficas finas), massa mamográfica irregular e/ou espiculada, distorção arquitetônica ou densidade assimétrica.[77]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: breast cancer screening and diagnosis [internet publication].
https://www.nccn.org/guidelines/category_2
[137]Gajdos C, Tartter PI, Bleiweiss IJ, et al. Mammographic appearance of nonpalpable breast cancer reflects pathologic characteristics. Ann Surg. 2002 Feb;235(2):246-51.
https://pmc.ncbi.nlm.nih.gov/articles/PMC1422421
http://www.ncbi.nlm.nih.gov/pubmed/11807365?tool=bestpractice.com
[138]American College of Radiology. BI-RADS®: ACR breast imaging reporting and data system. [internet publication].
https://www.acr.org/Clinical-Resources/Clinical-Tools-and-Reference/Reporting-and-Data-Systems/BI-RADS
O câncer de mama oculto é encontrado em, aproximadamente, 0.3% das mulheres diagnosticadas com linfadenopatia axilar.[139]Foroudi F, Tiver KW. Occult breast carcinoma presenting as axillary metastases. Int J Radiat Oncol Biol Phys. 2000 Apr 1;47(1):143-7.
http://www.ncbi.nlm.nih.gov/pubmed/10758316?tool=bestpractice.com
Uma história familiar cuidadosa deve ser colhida. Informe-se sobre familiares consanguíneos próximos com: câncer de mama (especialmente câncer de mama de início precoce ou câncer de mama masculino); câncer de ovário; câncer de pâncreas; ou câncer de próstata metastático, de alto risco ou de risco muito elevado; ou uma variante conhecida em um gene de suscetibilidade ao câncer.[20]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: breast, ovarian, pancreatic, and prostate [internet publication].
https://www.nccn.org/guidelines/category_2
A avaliação de risco genético, incluindo aconselhamento genético e testes de linha germinativa, é recomendada para mulheres com alto risco de câncer de mama hereditário (com base na história pessoal e/ou familiar).[20]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: breast, ovarian, pancreatic, and prostate [internet publication].
https://www.nccn.org/guidelines/category_2
[77]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: breast cancer screening and diagnosis [internet publication].
https://www.nccn.org/guidelines/category_2
Exame físico
A paciente deve primeiro ser examinada sentada para se verificar se há mudanças na cor, no contorno e na ondulação da pele ou se há assimetria. A axila também é avaliada relaxando-se e aduzindo-se o braço. Os grupos nodais supraclavicular e infraclavicular devem ser avaliados para se determinar a extensão da doença linfática.
A avaliação clínica do estado dos linfonodos costuma ser imprecisa; portanto, exames de imagem (por exemplo, ultrassonografia, ressonância nuclear magnética [RNM] da mama com contraste ou tomografia computadorizada [TC]) são necessários. Um estudo realizado pelo National Surgical Adjuvant Breast Project (NSABP) encontrou evidência histológica de metástases linfáticas no exame patológico em 38% de um grupo de pacientes com câncer de mama cujo exame clínico tinha sido considerado negativo para linfonodos.[140]Fisher ER, Gregorio RM, Fisher B, et al. The pathology of invasive breast cancer. A syllabus derived from findings of the National Surgical Adjuvant Breast Project (protocol no. 4). Cancer. 1975 Jul;36(1):1-85.
https://acsjournals.onlinelibrary.wiley.com/doi/pdf/10.1002/1097-0142%28197507%2936%3A1%3C1%3A%3AAID-CNCR2820360102%3E3.0.CO%3B2-4
http://www.ncbi.nlm.nih.gov/pubmed/173455?tool=bestpractice.com
Por outro lado, nenhuma evidência de doença linfonodal foi encontrada posteriormente no exame patológico em 25% das pacientes diagnosticadas clinicamente com metástases linfáticas.[140]Fisher ER, Gregorio RM, Fisher B, et al. The pathology of invasive breast cancer. A syllabus derived from findings of the National Surgical Adjuvant Breast Project (protocol no. 4). Cancer. 1975 Jul;36(1):1-85.
https://acsjournals.onlinelibrary.wiley.com/doi/pdf/10.1002/1097-0142%28197507%2936%3A1%3C1%3A%3AAID-CNCR2820360102%3E3.0.CO%3B2-4
http://www.ncbi.nlm.nih.gov/pubmed/173455?tool=bestpractice.com
A paciente é examinada em posição supina, com o braço levantado de modo que a mão fique atrás da cabeça e o tecido mamário se distribua na parede torácica, facilitando a palpação de toda a mama e das regiões linfáticas. O tecido e a parte sob o mamilo devem ser apalpados.
O exame físico das mamas e das cavidades linfáticas deve seguir um padrão metódico para evitar a omissão de alguma região.
Exames por imagem
As modalidades de imagem recomendadas incluem mamografia, ultrassonografia e RNM. O estadiamento sistêmico para mulheres com doença localmente avançada ou suspeita de doença metastática pode envolver TC, cintilografia óssea e tomografia por emissão de pósitrons (PET)-CT.
Mamografia
A mamografia diagnóstica bilateral deve ser usada como exame de imagem inicial para avaliar pacientes adultos sintomáticos com idade ≥30 anos, ou como acompanhamento para avaliar achados anormais na mamografia de rastreamento ou outros exames de imagem.[77]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: breast cancer screening and diagnosis [internet publication].
https://www.nccn.org/guidelines/category_2
[141]American College of Radiology. ACR practice parameter for the performance of screening and diagnostic mammography. 2023 [internet publication].
https://www.acr.org/-/media/ACR/Files/Practice-Parameters/Screen-Diag-Mammo.pdf
[142]American College of Radiology. ACR appropriateness criteria: palpable breast masses. 2022 [internet publication].
https://acsearch.acr.org/docs/69495/Narrative
A sensibilidade e a especificidade da mamografia convencional para o diagnóstico de lesões mamárias foram relatadas como 78.9% e 82.7%, respectivamente.[143]Moss HA, Britton PD, Flower CD, et al. How reliable is modern breast imaging in differentiating benign from malignant breast lesions in the symptomatic population? Clin Radiol. 1999 Oct;54(10):676-82.
http://www.ncbi.nlm.nih.gov/pubmed/10541394?tool=bestpractice.com
A tomossíntese digital da mama (TMD) é uma técnica mamográfica tridimensional que pode ser usada para criar imagens reconstruídas de tecido mamário em lâmina delgada. A TMD diagnóstica pode oferecer melhor detecção e caracterização de lesões em comparação com a mamografia bidimensional convencional, especialmente em pacientes com tecido mamário denso.[141]American College of Radiology. ACR practice parameter for the performance of screening and diagnostic mammography. 2023 [internet publication].
https://www.acr.org/-/media/ACR/Files/Practice-Parameters/Screen-Diag-Mammo.pdf
Em um estudo, a TMD mostrou uma sensibilidade geral maior, em comparação com a mamografia convencional (88.2% vs. 78.3%, respectivamente), com especificidade semelhante.[144]Kim WH, Chang JM, Moon HG, et al. Comparison of the diagnostic performance of digital breast tomosynthesis and magnetic resonance imaging added to digital mammography in women with known breast cancers. Eur Radiol. 2016 Jun;26(6):1556-64.
http://www.ncbi.nlm.nih.gov/pubmed/26376882?tool=bestpractice.com
A mamografia convencional diagnóstica ou a TMD diagnóstica podem ser usadas como opções alternativas ou em combinação.[142]American College of Radiology. ACR appropriateness criteria: palpable breast masses. 2022 [internet publication].
https://acsearch.acr.org/docs/69495/Narrative
[145]Loibl S, André F, Bachelot T, et al. Early breast cancer: ESMO clinical practice guideline for diagnosis, treatment and follow-up. Ann Oncol. 2024 Feb;35(2):159-82.
https://www.esmo.org/guidelines/guidelines-by-topic/esmo-clinical-practice-guidelines-breast-cancer/early-breast-cancer
http://www.ncbi.nlm.nih.gov/pubmed/38101773?tool=bestpractice.com
As diretrizes da National Comprehensive Cancer Network (NCCN) recomendam a mamografia diagnóstica com TMD.[77]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: breast cancer screening and diagnosis [internet publication].
https://www.nccn.org/guidelines/category_2
A mamografia com contraste e ultrassonografia pode ser uma opção adicional para diagnóstico por imagem inicial.[77]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: breast cancer screening and diagnosis [internet publication].
https://www.nccn.org/guidelines/category_2
[145]Loibl S, André F, Bachelot T, et al. Early breast cancer: ESMO clinical practice guideline for diagnosis, treatment and follow-up. Ann Oncol. 2024 Feb;35(2):159-82.
https://www.esmo.org/guidelines/guidelines-by-topic/esmo-clinical-practice-guidelines-breast-cancer/early-breast-cancer
http://www.ncbi.nlm.nih.gov/pubmed/38101773?tool=bestpractice.com
Ultrassonografia das mamas
A avaliação de uma nova massa em uma mulher com idade <30 anos geralmente deve começar com ultrassonografia (seguida de mamografia diagnóstica se os resultados forem altamente sugestivos de câncer de mama).[77]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: breast cancer screening and diagnosis [internet publication].
https://www.nccn.org/guidelines/category_2
Se houver baixa suspeita clínica, pode-se considerar a observação da massa por 1-2 ciclos menstruais, seguida de ultrassonografia, se os sintomas persistirem.[77]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: breast cancer screening and diagnosis [internet publication].
https://www.nccn.org/guidelines/category_2
Para mulheres com idade ≥30 anos com sintomas palpáveis e pacientes com outros sintomas suspeitos em qualquer idade, a mamografia diagnóstica e/ou a TMD é realizada com ultrassonografia como adjuvante.[77]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: breast cancer screening and diagnosis [internet publication].
https://www.nccn.org/guidelines/category_2
[142]American College of Radiology. ACR appropriateness criteria: palpable breast masses. 2022 [internet publication].
https://acsearch.acr.org/docs/69495/Narrative
[145]Loibl S, André F, Bachelot T, et al. Early breast cancer: ESMO clinical practice guideline for diagnosis, treatment and follow-up. Ann Oncol. 2024 Feb;35(2):159-82.
https://www.esmo.org/guidelines/guidelines-by-topic/esmo-clinical-practice-guidelines-breast-cancer/early-breast-cancer
http://www.ncbi.nlm.nih.gov/pubmed/38101773?tool=bestpractice.com
[146]Expert Panel on Breast Imaging, McDonald ES, Scheel JR, et al. ACR appropriateness criteria: imaging of invasive breast cancer. J Am Coll Radiol. 2024 Jun;21(6s):S168-202.
https://www.jacr.org/article/S1546-1440(24)00262-X/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38823943?tool=bestpractice.com
A ultrassonografia da mama tem demonstrado ser útil como adjuvante à mamografia através da especificidade (diferenciando cistos de massas sólidas), avaliando massas mamárias ou axilares que não são suficientemente avaliadas pela mamografia, avaliando o envolvimento de linfonodos axilares e monitorando a resposta tumoral durante a quimioterapia neoadjuvante.[147]American College of Radiology. ACR appropriateness criteria: imaging of the axilla. 2021 [internet publication].
https://acsearch.acr.org/docs/3158165/Narrative
[148]American College of Radiology. ACR practice parameter for the performance of a breast ultrasound examination. 2021 [internet publication].
https://www.acr.org/-/media/ACR/Files/Practice-Parameters/US-Breast.pdf
[149]Flobbe K, Bosch AM, Kessels AG, et al. The additional diagnostic value of ultrasonography in the diagnosis of breast cancer. Arch Intern Med. 2003 May 26;163(10):1194-9.
https://jamanetwork.com/journals/jamainternalmedicine/fullarticle/215601
http://www.ncbi.nlm.nih.gov/pubmed/12767956?tool=bestpractice.com
[150]Expert Panel on Breast Imaging, Hayward JH, Linden OE, et al. ACR Appropriateness Criteria® monitoring response to neoadjuvant systemic therapy for breast cancer: 2022 Update. J Am Coll Radiol. 2023 May;20(5s):S125-45.
https://acsearch.acr.org/docs/3099208/Narrative
http://www.ncbi.nlm.nih.gov/pubmed/37236739?tool=bestpractice.com
A ultrassonografia tridimensional da mama tem sensibilidade de 92.3% e especificidade de 87.2% para diagnosticar o câncer de mama em mulheres com nódulos mamários ou lesão de massa.[151]Bin L, Huihui Y, Weiping Y, et al. Value of three-dimensional ultrasound in differentiating malignant from benign breast tumors: a systematic review and meta-analysis. Ultrasound Q. 2019 Mar;35(1):68-73.
https://journals.lww.com/ultrasound-quarterly/Fulltext/2019/03000/Value_of_Three_Dimensional_Ultrasound_in.11.aspx
http://www.ncbi.nlm.nih.gov/pubmed/30807546?tool=bestpractice.com
Relatório de resultados mamográficos e de ultrassonografia
Um sistema de relatórios padronizado (por exemplo, o sistema American College of Radiology Breast Imaging Reporting and Data System [BI-RADS] ou a classificação de imagens de mama do Royal College of Radiologists Breast Group) deve ser usado para relatar os resultados da avaliação mamográfica e/ou ultrassonográfica e para orientar o manejo posterior.[77]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: breast cancer screening and diagnosis [internet publication].
https://www.nccn.org/guidelines/category_2
[152]D’Orsi CJ, Sickles EA, Mendelson EB, et al. ACR BI-RADS Atlas, breast imaging reporting and data system. 5th ed. Reston,VA: American College of Radiology; 2013.[153]Maxwell AJ, Ridley NT, Rubin G, et al. The Royal College of Radiologists Breast Group breast imaging classification. Clin Radiol. 2009 Jun;64(6):624-7.
https://www.clinicalradiologyonline.net/article/S0009-9260(09)00061-0/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/19414086?tool=bestpractice.com
RNM da mama
A sensibilidade da RNM da mama é maior do que a da mamografia, mas a especificidade é limitada (a sensibilidade para o câncer de mama é de aproximadamente 88% a 91%; a especificidade é de aproximadamente 68%).[154]Bluemke DA, Gatsonis CA, Chen MH, et al. Magnetic resonance imaging of the breast prior to biopsy. JAMA. 2004 Dec 8;292(22):2735-42.
https://jamanetwork.com/journals/jama/fullarticle/199950
http://www.ncbi.nlm.nih.gov/pubmed/15585733?tool=bestpractice.com
Apesar da maior sensibilidade, a RNM não diminuiu as taxas de reoperação quando adicionada à investigação de mulheres com câncer de mama primário submetidas a excisão local ampla.[155]Turnbull L, Brown S, Harvey I, et al. Comparative effectiveness of MRI in breast cancer (COMICE) trial: a randomised controlled trial. Lancet. 2010 Feb 13;375(9714):563-71.
http://www.ncbi.nlm.nih.gov/pubmed/20159292?tool=bestpractice.com
A RNM da mama não é recomendada rotineiramente para avaliação diagnóstica devido ao risco de falsos positivos e ao potencial para tratamento excessivo.[146]Expert Panel on Breast Imaging, McDonald ES, Scheel JR, et al. ACR appropriateness criteria: imaging of invasive breast cancer. J Am Coll Radiol. 2024 Jun;21(6s):S168-202.
https://www.jacr.org/article/S1546-1440(24)00262-X/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38823943?tool=bestpractice.com
A RNM da mama (sem e com contraste) pode, no entanto, ser útil para a avaliação e a tomada de decisão em certas circunstâncias:[77]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: breast cancer screening and diagnosis [internet publication].
https://www.nccn.org/guidelines/category_2
[125]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: breast cancer [internet publication].
https://www.nccn.org/professionals/physician_gls/default.aspx
[146]Expert Panel on Breast Imaging, McDonald ES, Scheel JR, et al. ACR appropriateness criteria: imaging of invasive breast cancer. J Am Coll Radiol. 2024 Jun;21(6s):S168-202.
https://www.jacr.org/article/S1546-1440(24)00262-X/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38823943?tool=bestpractice.com
[156]American College of Radiology. ACR practice parameter for the performance of contrast-enhanced magnetic resonance imaging (MRI) of the breast. 2023 [internet publication].
https://gravitas.acr.org/PPTS/GetDocumentView?docId=6+&releaseId=2
Avaliação de descarga, inversão ou retração mamilar suspeita, ou alterações suspeitas na pele da mama quando a ultrassonografia ou a mamografia não forem diagnósticas. A RNM pode facilitar o diagnóstico de câncer de mama inflamatório.
Avaliação de estadiamento (para definir a extensão do câncer ou a presença de câncer multifocal ou multicêntrico), se indicada, ou para rastrear câncer na mama contralateral no momento do diagnóstico.
Avaliação antes e depois da terapia sistêmica pré-operatória (para definir a extensão da doença, a resposta ao tratamento e o potencial para cirurgia conservadora da mama).
Identificação de tumores primários ocultos nas pacientes com linfonodos axilares clinicamente positivos; ou com doença de Paget (para definir a extensão da doença); ou com carcinoma lobular invasivo (não identificado adequadamente na mamografia, ultrassonografia ou exame físico).
A RNM da mama geralmente não é recomendada durante a gravidez.[157]American College of Radiology. ACR appropriateness criteria: breast imaging during pregnancy. 2025 [internet publication].
https://acsearch.acr.org/docs/3199448/Narrative
A RNM da mama com contraste é contraindicada na gravidez porque o gadolínio pode atravessar a placenta e entrar na circulação fetal, enquanto a RNM sem contraste apresenta baixa sensibilidade.[77]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: breast cancer screening and diagnosis [internet publication].
https://www.nccn.org/guidelines/category_2
[157]American College of Radiology. ACR appropriateness criteria: breast imaging during pregnancy. 2025 [internet publication].
https://acsearch.acr.org/docs/3199448/Narrative
[156]American College of Radiology. ACR practice parameter for the performance of contrast-enhanced magnetic resonance imaging (MRI) of the breast. 2023 [internet publication].
https://gravitas.acr.org/PPTS/GetDocumentView?docId=6+&releaseId=2
[158]Loibl S, Azim HA Jr, Bachelot T, et al. ESMO expert consensus statements on the management of breast cancer during pregnancy (PrBC). Ann Oncol. 2023 Oct;34(10):849-66.
https://www.annalsofoncology.org/article/S0923-7534(23)00798-6/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/37572987?tool=bestpractice.com
A RNM com e sem contraste não é contraindicada em mulheres que estão amamentando.[156]American College of Radiology. ACR practice parameter for the performance of contrast-enhanced magnetic resonance imaging (MRI) of the breast. 2023 [internet publication].
https://gravitas.acr.org/PPTS/GetDocumentView?docId=6+&releaseId=2
Estadiamento sistêmico
O estadiamento sistêmico de rotina não é indicado para o câncer de mama em estádio inicial na ausência de sinais ou sintomas de metástase.[125]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: breast cancer [internet publication].
https://www.nccn.org/professionals/physician_gls/default.aspx
Em mulheres com sinais ou sintomas que sugerem doença metastática ou naquelas com doença localmente avançada (T3, N1-2, M0), deve-se considerar exames de imagem adicionais.[146]Expert Panel on Breast Imaging, McDonald ES, Scheel JR, et al. ACR appropriateness criteria: imaging of invasive breast cancer. J Am Coll Radiol. 2024 Jun;21(6s):S168-202.
https://www.jacr.org/article/S1546-1440(24)00262-X/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38823943?tool=bestpractice.com
Consulte Câncer de mama metastático.
Os sintomas pulmonares devem ser investigados com uma TC torácica (com ou sem contraste). A cintilografia óssea com radionucleotídeo ou PET-CT com fluoreto de sódio deve ser realizada nas pacientes com dor óssea localizada ou fosfatase alcalina elevada. O exame de imagem abdominal e pélvico usando TC com contraste ou RNM com contraste é indicado para sintomas ou sinais abdominais ou pélvicos, fosfatase alcalina elevada ou teste da função hepática anormal.[125]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: breast cancer [internet publication].
https://www.nccn.org/professionals/physician_gls/default.aspx
A PET-CT não é indicada para câncer de mama em estádio I, estádio II ou estádio III operável, devido a sua alta taxa de falso-negativo para pequenas lesões, baixa sensibilidade para detecção de metástases de linfonodos axilares e alta taxa de resultados falso-positivos. A PET-CT é mais útil na doença avançada e na histologia ductal invasiva quando as investigações de estadiamento padrão são ambíguas.[125]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: breast cancer [internet publication].
https://www.nccn.org/professionals/physician_gls/default.aspx
[145]Loibl S, André F, Bachelot T, et al. Early breast cancer: ESMO clinical practice guideline for diagnosis, treatment and follow-up. Ann Oncol. 2024 Feb;35(2):159-82.
https://www.esmo.org/guidelines/guidelines-by-topic/esmo-clinical-practice-guidelines-breast-cancer/early-breast-cancer
http://www.ncbi.nlm.nih.gov/pubmed/38101773?tool=bestpractice.com
[146]Expert Panel on Breast Imaging, McDonald ES, Scheel JR, et al. ACR appropriateness criteria: imaging of invasive breast cancer. J Am Coll Radiol. 2024 Jun;21(6s):S168-202.
https://www.jacr.org/article/S1546-1440(24)00262-X/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38823943?tool=bestpractice.com
Biópsia
Uma biópsia é necessária para o diagnóstico definitivo. Uma punção por agulha grossa (core biopsy) guiada por imagem geralmente é o método preferencial de diagnóstico, pois permite a diferenciação entre doença pré-invasiva e invasiva, tem menos probabilidade de estar associada à amostragem inadequada e permite avaliar o status para receptor.[Figure caption and citation for the preceding image starts]: Carcinoma de mama inflamatório mostrando invasão linfática dérmica pelas células tumoraisDo acervo do Dr. Massimo Cristofanilli; usado com permissão [Citation ends].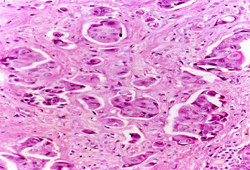
A biópsia excisional pode ser indicada se a biópsia percutânea com agulha grossa não puder ser realizada; ou se os resultados forem indeterminados, ou se forem benignos e discordantes da imagem; ou quando são necessárias amostras maiores de tecidos (por exemplo, para algumas etiologias específicas). No entanto, está associada a cosmese desfavorável e é mais invasiva que a biópsia com agulha.[77]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: breast cancer screening and diagnosis [internet publication].
https://www.nccn.org/guidelines/category_2
A aspiração por agulha fina (AAF) é útil na obtenção de um diagnóstico rápido de neoplasia maligna mamária e pode ser o único teste necessário para o diagnóstico quando já existem planos para cirurgia imediata. A sensibilidade e a especificidade da AAF são 98% e 97%, respectivamente, quando o procedimento é realizado por médicos experientes.[159]Ljung BM, Drejet A, Chiampi N, et al. Diagnostic accuracy of fine-needle aspiration biopsy is determined by physician training in sampling technique. Cancer. 2001 Aug 25;93(4):263-8.
https://acsjournals.onlinelibrary.wiley.com/doi/full/10.1002/cncr.9040
http://www.ncbi.nlm.nih.gov/pubmed/11507700?tool=bestpractice.com
No entanto, é provável que a precisão diagnóstica da AAF seja reduzida se realizada por médicos menos experientes.
Teste de receptor hormonal e do receptor tipo 2 do fator de crescimento epidérmico humano (HER2)
Caso seja feito o diagnóstico de câncer de mama invasivo, deve ser realizada a determinação do status para receptor estrogênico (RE), para receptor de progesterona (RP) e para receptor tipo 2 do fator de crescimento epidérmico humano (HER2) para auxiliar no tratamento e no prognóstico.[160]Allison KH, Hammond ME, Dowsett M, et al. Estrogen and progesterone receptor testing in breast cancer: ASCO/CAP guideline update. J Clin Oncol. 2020 Apr 20;38(12):1346-66.
https://ascopubs.org/doi/full/10.1200/JCO.19.02309
http://www.ncbi.nlm.nih.gov/pubmed/31928404?tool=bestpractice.com
[161]Wolff AC, Somerfield MR, Dowsett M, et al. Human epidermal growth factor receptor 2 testing in breast cancer: ASCO-College of American Pathologists guideline update. J Clin Oncol. 2023 Aug 1;41(22):3867-72.
https://ascopubs.org/doi/10.1200/JCO.22.02864
http://www.ncbi.nlm.nih.gov/pubmed/37284804?tool=bestpractice.com
O status para RE e RP é avaliado com o uso de coloração imuno-histoquímica. A American Society of Clinical Oncology (ASCO) e o College of American Pathologists recomendam que os ensaios para RE e RP deverão ser considerados positivos se houver pelo menos 1% do núcleo do tumor positivo na amostra da biópsia inicial.[160]Allison KH, Hammond ME, Dowsett M, et al. Estrogen and progesterone receptor testing in breast cancer: ASCO/CAP guideline update. J Clin Oncol. 2020 Apr 20;38(12):1346-66.
https://ascopubs.org/doi/full/10.1200/JCO.19.02309
http://www.ncbi.nlm.nih.gov/pubmed/31928404?tool=bestpractice.com
Mulheres que são RC limítrofe são tratadas da mesma forma que as mulheres RC positivas.
As pacientes diagnosticadas com câncer de mama (estádio inicial ou doença metastática) devem ter pelo menos uma amostra tumoral testada para expressão do HER2. Um teste para HER2 inclui a testagem para expressão da proteína do HER2 (ensaio de coloração imuno-histoquímica) ou amplificação do gene HER2 por hibridização in situ.[161]Wolff AC, Somerfield MR, Dowsett M, et al. Human epidermal growth factor receptor 2 testing in breast cancer: ASCO-College of American Pathologists guideline update. J Clin Oncol. 2023 Aug 1;41(22):3867-72.
https://ascopubs.org/doi/10.1200/JCO.22.02864
http://www.ncbi.nlm.nih.gov/pubmed/37284804?tool=bestpractice.com
Os escores da coloração imuno-histoquímica variam de 0 a 3+, conforme determinado pela intensidade da coloração e a porcentagem (>10%) de células tumorais positivas contíguas e homogêneas. O status para HER2 pode ser classificado da seguinte maneira, com base no escore de coloração imuno-histoquímica:[161]Wolff AC, Somerfield MR, Dowsett M, et al. Human epidermal growth factor receptor 2 testing in breast cancer: ASCO-College of American Pathologists guideline update. J Clin Oncol. 2023 Aug 1;41(22):3867-72.
https://ascopubs.org/doi/10.1200/JCO.22.02864
http://www.ncbi.nlm.nih.gov/pubmed/37284804?tool=bestpractice.com
Negativo para HER2: escore de coloração imuno-histoquímica 0 ou 1+
Ambíguo: escore de coloração imuno-histoquímica 2+ (requer teste do reflexo com ensaio de hibridização in situ)
Positivo para HER2: escore de coloração imuno-histoquímica 3+
Os ensaios de hibridização in situ de sonda única medem o número médio de cópias de HER2 (sinais/célula); o ensaio de hibridização in situ de sonda dupla mede a razão HER2/CEP17.[161]Wolff AC, Somerfield MR, Dowsett M, et al. Human epidermal growth factor receptor 2 testing in breast cancer: ASCO-College of American Pathologists guideline update. J Clin Oncol. 2023 Aug 1;41(22):3867-72.
https://ascopubs.org/doi/10.1200/JCO.22.02864
http://www.ncbi.nlm.nih.gov/pubmed/37284804?tool=bestpractice.com
A abordagem de sonda única não é preferencialmente recomendada; se usada, os casos com número médio de cópias HER2 ≥4.0 e <6.0 sinais/células devem basear os resultados finais na coloração imuno-histoquímica concomitante e se 2+ refletidos para a testagem de hibridização in situ com sonda dupla.[125]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: breast cancer [internet publication].
https://www.nccn.org/professionals/physician_gls/default.aspx
Caso o patologista não observe nenhuma discordância histopatológica, o status para HER2 pode ser classificado da seguinte maneira, com base nos resultados concomitantes da coloração imuno-histoquímica e da hibridização in situ:[161]Wolff AC, Somerfield MR, Dowsett M, et al. Human epidermal growth factor receptor 2 testing in breast cancer: ASCO-College of American Pathologists guideline update. J Clin Oncol. 2023 Aug 1;41(22):3867-72.
https://ascopubs.org/doi/10.1200/JCO.22.02864
http://www.ncbi.nlm.nih.gov/pubmed/37284804?tool=bestpractice.com
Negativo para HER2:
Razão HER2/CEP17 <2.0 E número médio de cópias do HER2 <4.0 sinais/célula (não é necessário o resultado concomitante da coloração imuno-histoquímica)
Razão HER2/CEP17 ≥2.0 E número médio da cópia de HER2 <4.0 sinais/célula e escore da coloração imuno-histoquímica concomitante 0, 1+ ou 2+
Razão HER2/CEP17 <2.0 E número médio da cópia de HER2 ≥6.0 sinais/célula e escore da coloração imuno-histoquímica concomitante 0 ou 1+
Razão HER2/CEP17 <2.0 E número médio da cópia de HER2 ≥4.0 e <6.0 sinais/célula e escore de coloração imuno-histoquímica concomitante 0, 1+ ou 2+
Positivo para HER2:
Razão HER2/CEP17 ≥2.0 E número médio da cópia de HER2 <4.0 sinais/célula e escore da coloração imuno-histoquímica concomitante 3+
Razão HER2/CEP17 <2.0 E número médio da cópia de HER2 ≥6.0 sinais/célula e escore da coloração imuno-histoquímica concomitante 2+ ou 3+
Razão HER2/CEP17 <2.0 E número médio da cópia de HER2 ≥4.0 e <6.0 sinais/célula e escore de coloração imuno-histoquímica concomitante 3+
Razão HER2/CEP17 ≥2.0 E número médio da cópia de HER2 ≥4.0 sinais/célula (não é necessário o resultado concomitante da coloração imuno-histoquímica)
Teste genético
Realizado para detectar mutações das linhas germinativas associadas com o aumento do risco de câncer. Estima-se que de 5% a 10% dos cânceres de mama estejam relacionados a mutações genéticas hereditárias.[14]Collaborative Group on Hormonal Factors in Breast Cancer. Familial breast cancer: collaborative reanalysis of individual data from 52 epidemiological studies including 58,209 women with breast cancer and 101,986 women without the disease. Lancet. 2001 Oct 27;358(9291):1389-99.
http://www.ncbi.nlm.nih.gov/pubmed/11705483?tool=bestpractice.com
[15]Claus EB, Schildkraut JM, Thompson WD, et al. The genetic attributable risk of breast and ovarian cancer. Cancer. 1996 Jun 1;77(11):2318-24.
http://www.ncbi.nlm.nih.gov/pubmed/8635102?tool=bestpractice.com
[16]Honrado E, Benítez J, Palacios J. The molecular pathology of hereditary breast cancer: genetic testing and therapeutic implications. Mod Pathol. 2005 Oct;18(10):1305-20.
https://www.nature.com/articles/3800453
http://www.ncbi.nlm.nih.gov/pubmed/15933754?tool=bestpractice.com
As mutações BRCA1 e BRCA2 são as mutações genéticas hereditárias mais comuns encontradas no câncer de mama.[16]Honrado E, Benítez J, Palacios J. The molecular pathology of hereditary breast cancer: genetic testing and therapeutic implications. Mod Pathol. 2005 Oct;18(10):1305-20.
https://www.nature.com/articles/3800453
http://www.ncbi.nlm.nih.gov/pubmed/15933754?tool=bestpractice.com
[17]Petrucelli N, Daly MB, Feldman GL. Hereditary breast and ovarian cancer due to mutations in BRCA1 and BRCA2. Genet Med. 2010 May;12(5):245-59.
http://www.ncbi.nlm.nih.gov/pubmed/20216074?tool=bestpractice.com
[18]Kuchenbaecker KB, Hopper JL, Barnes DR, et al. Risks of breast, ovarian, and contralateral breast cancer for BRCA1 and BRCA2 mutation carriers. JAMA. 2017 Jun 20;317(23):2402-16.
https://jamanetwork.com/journals/jama/fullarticle/2632503
http://www.ncbi.nlm.nih.gov/pubmed/28632866?tool=bestpractice.com
[162]Kurian AW, Ward KC, Howlader N, et al. Genetic testing and results in a population-based cohort of breast cancer patients and ovarian cancer patients. J Clin Oncol. 2019 May 20;37(15):1305-15.
https://ascopubs.org/doi/10.1200/JCO.18.01854
http://www.ncbi.nlm.nih.gov/pubmed/30964716?tool=bestpractice.com
Os testes genéticos podem fornecer informações sobre o prognóstico, auxiliar na terapia sistêmica e na tomada de decisões cirúrgicas (por exemplo, para identificar candidatas à terapia adjuvante com olaparibe ou cirurgia redutora de risco) e podem destacar o risco entre os membros da família.[20]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: breast, ovarian, pancreatic, and prostate [internet publication].
https://www.nccn.org/guidelines/category_2
Aconselhamento genético e testes para genes de suscetibilidade ao câncer de mama de alta penetrância são recomendados para certas pacientes no momento do diagnóstico, com base na história pessoal ou familiar, ancestralidade, diagnóstico em idade precoce, diagnóstico de câncer de mama triplo negativo, ou elegibilidade para terapia com olaparibe.[20]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: breast, ovarian, pancreatic, and prostate [internet publication].
https://www.nccn.org/guidelines/category_2
[125]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: breast cancer [internet publication].
https://www.nccn.org/professionals/physician_gls/default.aspx
[163]Bedrosian I, Somerfield MR, Achatz MI, et al. Germline testing in patients with breast cancer: ASCO-Society of Surgical Oncology guideline. J Clin Oncol. 2024 Feb 10;42(5):584-604.
https://ascopubs.org/doi/10.1200/JCO.23.02225?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
http://www.ncbi.nlm.nih.gov/pubmed/38175972?tool=bestpractice.com
Todos os pacientes do sexo masculino com câncer de mama diagnosticado em qualquer idade devem fazer testes genéticos.[20]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: breast, ovarian, pancreatic, and prostate [internet publication].
https://www.nccn.org/guidelines/category_2
[125]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: breast cancer [internet publication].
https://www.nccn.org/professionals/physician_gls/default.aspx
[163]Bedrosian I, Somerfield MR, Achatz MI, et al. Germline testing in patients with breast cancer: ASCO-Society of Surgical Oncology guideline. J Clin Oncol. 2024 Feb 10;42(5):584-604.
https://ascopubs.org/doi/10.1200/JCO.23.02225?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
http://www.ncbi.nlm.nih.gov/pubmed/38175972?tool=bestpractice.com
As diretrizes da National Comprehensive Cancer Network (NCCN) recomendam aconselhamento genético e testes para mutações em genes de suscetibilidade ao câncer de mama de alta penetrância (por exemplo, BRCA1, BRCA2, CDH1, PALB2, PTEN, STK11 e TP53) no diagnóstico para as seguintes pacientes:[20]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: breast, ovarian, pancreatic, and prostate [internet publication].
https://www.nccn.org/guidelines/category_2
Diagnosticadas com idade ≤50 anos
Com ascendência judaica asquenaze e diagnosticadas em qualquer idade
Homens diagnosticados em qualquer idade
Com câncer de mama triplo negativo, ou múltiplos cânceres de mama primários (síncronos ou metacrônicos), ou câncer de mama lobular (com história pessoal ou familiar de câncer gástrico difuso) diagnosticadas em qualquer idade
Candidatas a terapia adjuvante com olaparibe
Com familiar consanguíneo com uma variante provável ou patogênica em um gene de suscetibilidade ao câncer
Com uma história familiar forte, incluindo:
≥1 familiar consanguíneo diagnosticado com câncer de mama com idade ≤50 anos, ou com câncer de mama masculino, câncer de ovário ou pâncreas, ou câncer de próstata (com metástase, ou grupo de alto ou muito alto risco) em qualquer idade; ou
≥3 diagnósticos de câncer de mama e/ou próstata no mesmo lado da família (incluindo a paciente sendo avaliada).
A American Society of Clinical Oncology (ASCO) descobriu que a expansão dos critérios de idade da NCCN para incluir todas as mulheres diagnosticadas com ≤65 anos melhorou a sensibilidade dos critérios (para 98% para o BRCA1 ou BRCA2). A ASCO recomenda testes de linha germinativa para mutações BRCA1 e BRCA2 ao diagnóstico nas seguintes pacientes:[163]Bedrosian I, Somerfield MR, Achatz MI, et al. Germline testing in patients with breast cancer: ASCO-Society of Surgical Oncology guideline. J Clin Oncol. 2024 Feb 10;42(5):584-604.
https://ascopubs.org/doi/10.1200/JCO.23.02225?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
http://www.ncbi.nlm.nih.gov/pubmed/38175972?tool=bestpractice.com
Todas as pacientes com diagnóstico de câncer de mama com idade ≤65 anos
Pacientes selecionadas >65 anos diagnosticadas com câncer de mama, com base na história pessoal ou familiar, ancestralidade e elegibilidade para terapia com olaparibe.
As diretrizes da ASCO recomendam testes individualizados para genes de alta penetrância adicionais (por exemplo, CDH1, PALB2, PTEN, STK11 e TP53) com base na história pessoal ou familiar.[163]Bedrosian I, Somerfield MR, Achatz MI, et al. Germline testing in patients with breast cancer: ASCO-Society of Surgical Oncology guideline. J Clin Oncol. 2024 Feb 10;42(5):584-604.
https://ascopubs.org/doi/10.1200/JCO.23.02225?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
http://www.ncbi.nlm.nih.gov/pubmed/38175972?tool=bestpractice.com
Podem ser realizados testes de linha germinativa para uma variante patogênica específica, se conhecida; o teste do perfil multigênico personalizado é recomendado se a variante for desconhecida.[20]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: genetic/familial high-risk assessment: breast, ovarian, pancreatic, and prostate [internet publication].
https://www.nccn.org/guidelines/category_2
A seleção do perfil multigênico específico deve levar em consideração a história pessoal e familiar da paciente.[163]Bedrosian I, Somerfield MR, Achatz MI, et al. Germline testing in patients with breast cancer: ASCO-Society of Surgical Oncology guideline. J Clin Oncol. 2024 Feb 10;42(5):584-604.
https://ascopubs.org/doi/10.1200/JCO.23.02225?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
http://www.ncbi.nlm.nih.gov/pubmed/38175972?tool=bestpractice.com
[164]Tung N, Ricker C, Messersmith H, et al. Selection of germline genetic testing panels in patients with cancer: ASCO guideline. J Clin Oncol. 2024 Jul 20;42(21):2599-615.
https://ascopubs.org/doi/10.1200/JCO.24.00662?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
http://www.ncbi.nlm.nih.gov/pubmed/38759122?tool=bestpractice.com
Avaliação do risco de recidiva
Ensaios da expressão gênica podem ser usados para estabelecer prognósticos e para orientar as decisões sobre quimioterapia adjuvante.[165]Sparano JA, Gray RJ, Makower DF, et al. Prospective validation of a 21-gene expression assay in breast cancer. N Engl J Med. 2015 Nov 19;373(21):2005-14.
https://www.nejm.org/doi/full/10.1056/NEJMoa1510764
http://www.ncbi.nlm.nih.gov/pubmed/26412349?tool=bestpractice.com
[166]Goncalves R, Bose R. Using multigene tests to select treatment for early-stage breast cancer. J Natl Compr Canc Netw. 2013 Feb 1;11(2):174-82.
https://www.jnccn.org/content/11/2/174.long
http://www.ncbi.nlm.nih.gov/pubmed/23411384?tool=bestpractice.com
[167]Harbeck N, Sotlar K, Wuerstlein R, et al. Molecular and protein markers for clinical decision making in breast cancer: today and tomorrow. Cancer Treat Rev. 2014 Apr;40(3):434-44.
http://www.ncbi.nlm.nih.gov/pubmed/24138841?tool=bestpractice.com
[168]Sparano JA, Gray RJ, Ravdin PM, et al. Clinical and genomic risk to guide the use of adjuvant therapy for breast cancer. N Engl J Med. 2019 Jun 20;380(25):2395-405.
https://www.nejm.org/doi/10.1056/NEJMoa1904819
http://www.ncbi.nlm.nih.gov/pubmed/31157962?tool=bestpractice.com
[169]Andre F, Ismaila N, Allison KH, et al. Biomarkers for adjuvant endocrine and chemotherapy in early-stage breast cancer: ASCO guideline update. J Clin Oncol. 2022 Jun 1;40(16):1816-37.
https://ascopubs.org/doi/10.1200/JCO.22.00069
http://www.ncbi.nlm.nih.gov/pubmed/35439025?tool=bestpractice.com
Oncotype DX® é o ensaio de primeira escolha para determinar se a adição de quimioterapia à terapia endócrina seria benéfica para pacientes com doença positiva para HR, negativa para HER2, negativas para linfonodos ou menopausadas com doença positiva para linfonodos (1-3 linfonodos positivos).[125]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: breast cancer [internet publication].
https://www.nccn.org/professionals/physician_gls/default.aspx
[169]Andre F, Ismaila N, Allison KH, et al. Biomarkers for adjuvant endocrine and chemotherapy in early-stage breast cancer: ASCO guideline update. J Clin Oncol. 2022 Jun 1;40(16):1816-37.
https://ascopubs.org/doi/10.1200/JCO.22.00069
http://www.ncbi.nlm.nih.gov/pubmed/35439025?tool=bestpractice.com
[170]National Institute for Health and Care Excellence. Tumour profiling tests to guide adjuvant chemotherapy decisions in early breast cancer. Dec 2018 [internet publication]
https://www.nice.org.uk/guidance/dg34
O Oncotype DX® é um ensaio multigênico baseado na reação em cadeia da polimerase via transcriptase reversa que avalia a expressão de 21 genes nas lâminas do tumor envolvido em parafina da paciente.[171]Paik S, Shak S, Tang G, et al. A multigene assay to predict recurrence of tamoxifen-treated, node-negative breast cancer. N Engl J Med. 2004 Dec 30;351(27):2817-26.
https://www.nejm.org/doi/full/10.1056/NEJMoa041588
http://www.ncbi.nlm.nih.gov/pubmed/15591335?tool=bestpractice.com
Com base nessa expressão, um escore de recorrência baixo (≤10), intermediário (11-25) ou alto (26-100) pode ser calculado. O escore de recorrência pode ajudar a decidir se uma paciente com câncer de mama positivo para receptores hormonais, negativo para linfonodos ou positivo para 1-3 linfonodos se beneficiaria de quimioterapia adjuvante, ou se a terapia endócrina adjuvante isolada já seria suficiente.[165]Sparano JA, Gray RJ, Makower DF, et al. Prospective validation of a 21-gene expression assay in breast cancer. N Engl J Med. 2015 Nov 19;373(21):2005-14.
https://www.nejm.org/doi/full/10.1056/NEJMoa1510764
http://www.ncbi.nlm.nih.gov/pubmed/26412349?tool=bestpractice.com
[172]Sparano JA, Gray RJ, Makower DF, et al. Adjuvant chemotherapy guided by a 21-gene expression assay in breast cancer. N Engl J Med. 2018 Jul 12;379(2):111-21.
https://www.nejm.org/doi/10.1056/NEJMoa1804710
http://www.ncbi.nlm.nih.gov/pubmed/29860917?tool=bestpractice.com
[173]Sparano JA, Gray RJ, Makower DF, et al. Clinical outcomes in early breast cancer with a high 21-gene recurrence score of 26 to 100 assigned to adjuvant chemotherapy plus endocrine therapy: a secondary analysis of the TAILORx randomized clinical trial. JAMA Oncol. 2019 Sep 30;6(3):367-74.
https://jamanetwork.com/journals/jamaoncology/fullarticle/2752332
http://www.ncbi.nlm.nih.gov/pubmed/31566680?tool=bestpractice.com
[174]Kalinsky K, Barlow WE, Gralow JR, et al. 21-gene assay to inform chemotherapy benefit in node-positive breast cancer. N Engl J Med. 2021 Dec 16;385(25):2336-47.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9096864
http://www.ncbi.nlm.nih.gov/pubmed/34914339?tool=bestpractice.com
As pacientes na pré-menopausa com 1-3 linfonodos positivos se beneficiam da quimioterapia independente do resultado do ensaio genômico. A utilidade clínica dos ensaios na doença positiva para linfonodos com ≥4 linfonodos é incerta.[169]Andre F, Ismaila N, Allison KH, et al. Biomarkers for adjuvant endocrine and chemotherapy in early-stage breast cancer: ASCO guideline update. J Clin Oncol. 2022 Jun 1;40(16):1816-37.
https://ascopubs.org/doi/10.1200/JCO.22.00069
http://www.ncbi.nlm.nih.gov/pubmed/35439025?tool=bestpractice.com
Outros ensaios, como Mammaprint®, Breast Cancer Index (BCI), Prosigna® e EndoPredict®, podem ser usados para fornecer informações prognósticas em mulheres menopausadas ou mulheres >50 anos de idade que não negativas para linfonodos. Mammaprint® ae EndoPredict® também podem ser usados para mulheres menopausadas ou mulheres >50 anos de idade com 1-3 linfonodos positivos. No entanto, a capacidade desses ensaios de predizer o benefício terapêutico é menos certo.[125]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: breast cancer [internet publication].
https://www.nccn.org/professionals/physician_gls/default.aspx
[169]Andre F, Ismaila N, Allison KH, et al. Biomarkers for adjuvant endocrine and chemotherapy in early-stage breast cancer: ASCO guideline update. J Clin Oncol. 2022 Jun 1;40(16):1816-37.
https://ascopubs.org/doi/10.1200/JCO.22.00069
http://www.ncbi.nlm.nih.gov/pubmed/35439025?tool=bestpractice.com
Exames de sangue
Geralmente, o exame de sangue não é recomendado como parte do estadiamento e da investigação pré-operatória.
Um hemograma completo, um perfil metabólico abrangente, testes da função hepática e um teste de fosfatase alcalina devem ser considerados apenas se o paciente for candidato a terapia sistêmica pré-operatória ou adjuvante.[125]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: breast cancer [internet publication].
https://www.nccn.org/professionals/physician_gls/default.aspx
Pacientes com diagnóstico clínico/patológico de câncer de mama inflamatório sem metástase à distância devem realizar hemograma completo e contagem de plaquetas.[125]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: breast cancer [internet publication].
https://www.nccn.org/professionals/physician_gls/default.aspx


