História e exame físico
Principais fatores diagnósticos
comuns
presença de fatores de risco
Os principais fatores de risco incluem aumento da idade, etnia branca ou negra (em comparação com latino-americanos e nativos americanos), classe socioeconômica alta, história familiar positiva, exposição prolongada a estrogênio/progestina, consumo elevado de bebidas alcoólicas, história de exposição à radiação, doença mamária benigna existente e aumento da densidade da mama.
Incomuns
massa mamária
O médico deve determinar se a massa mamária é sensível, se existem alterações no tamanho ou na aparência da massa e se as características da massa são afetadas pelo ciclo menstrual.
O câncer de mama nem sempre se apresenta com uma nova massa mamária. Muitos cânceres de mama são diagnosticados com base em anormalidades mamográficas (como microcalcificações lineares ou pleomórficas), na ausência de uma massa palpável.[77]
O câncer de mama oculto é encontrado em, aproximadamente, 0.3% das mulheres diagnosticadas com linfadenopatia axilar.[139]
descarga mamilar
Pode ser aquosa, serosa, leitosa ou sanguinolenta. Embora a secreção sanguinolenta seja classicamente mais associada a uma neoplasia, ela também pode estar relacionada a um papiloma intraductal. A relação entre descarga mamilar e neoplasia maligna parece ser afetada pela idade. Entre as mulheres com descarga mamilar, o câncer esteve presente em 3% daquelas com menos de 40 anos, 10% daquelas entre 40-60 anos e 32% daquelas com mais de 60 anos.[175]
linfadenopatia axilar
O envolvimento linfático axilar é o fator prognóstico mais reproduzível para câncer de mama invasivo primário. A probabilidade de envolvimento nodal axilar aumenta proporcionalmente ao tamanho do tumor.[176] No entanto, essa relação linear positiva pode não se aplicar aos tumores <1 cm e >5 cm.[177] A avaliação clínica do status nodal geralmente pode ser imprecisa; portanto, um exame de imagem (por exemplo, tomografia computadorizada [TC]) é necessário.[140]
Outros fatores diagnósticos
Incomuns
espessamento ou descoloração da pele
A pele está envolvida em 20% de todos os casos de câncer de mama.[136] No entanto, alterações cutâneas, como pele em casca de laranja (ondulação da pele), eritema e ulceração, estão sempre associadas ao câncer de mama localmente avançado ou inflamatório.[Figure caption and citation for the preceding image starts]: Pele em casca de laranjaDo acervo da Dra. Amal Melhem-Bertrandt; usado com permissão [Citation ends].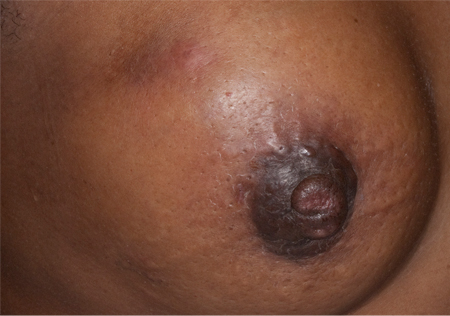
retração, inversão ou descamação do mamilo
Pode estar relacionada à doença de Paget da mama ou câncer de mama localmente avançado em associação com uma grande massa mamária com/sem envolvimento do mamilo ou da pele.[Figure caption and citation for the preceding image starts]: Retração e assimetria do mamiloDo acervo da Dra. Amal Melhem-Bertrandt; usado com permissão [Citation ends].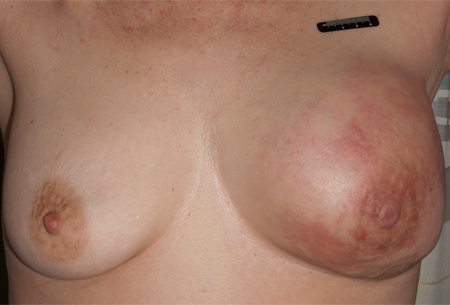
Fatores de risco
Fortes
idade mais avançada
A probabilidade de câncer de mama aumenta notavelmente com o aumento da idade durante os primeiros 60 anos de vida.[9]
Das mulheres diagnosticadas com câncer de mama entre 2018 e 2022 nos EUA, aproximadamente 2.0% foram diagnosticadas entre 20 e 34 anos; 8.5% entre 35 e 44 anos; 17.9% entre 45 e 54 anos; 24.7% entre 55 e 64 anos; 27.4% entre 65 e 74 anos; 14.6% entre 75 e 84 anos; e 4.9% >84 anos de idade.[9]
A idade mediana ao diagnóstico do câncer de mama nas mulheres nos EUA é de 63 anos.[9]
sexo feminino
Nos EUA, a incidência de câncer de mama é mais de 100 vezes maior em mulheres do que em homens.[10]
Existem evidências insuficientes para se determinar se as pessoas transgênero submetidas à terapia hormonal têm um risco geral menor, médio ou maior de desenvolver câncer de mama em comparação com os controles do sexo biológico de nascimento.[31]
origem étnica
Nos EUA, a incidência ajustada à idade do câncer de mama feminino (com base em dados de 2018 a 2022) é maior em mulheres brancas não hispânicas (140.0 por 100,000), seguidas por mulheres negras não hispânicas (131.0 por 100,000), mulheres não hispânicas indígenas norte-americanas/nativas do Alasca (116.7 por 100,000), mulheres não hispânicas asiáticas/das ilhas do Pacífico (114.3 por 100,000) e mulheres hispânicas (104.0 por 100,000).[9]
As taxas de mortalidade ajustadas à idade em mulheres negras não hispânicas permanecem mais altas do que em mulheres brancas (26.5 por 100,000 vs. 19.3 por 100,000 [com base em dados de 2019 a 2023]).[9] Isso pode estar relacionado a um estádio mais avançado no diagnóstico inicial, disparidades no acesso a cuidados médicos e tratamentos, grau mais alto do tumor e maior incidência de tumores negativos para o receptor estrogênico em pacientes negras.[32] Mulheres imigrantes e de minorias étnicas têm menor probabilidade de realizar um rastreamento mamográfico, comparadas com outras mulheres, o que, potencialmente, leva a um atraso no diagnóstico do câncer de mama.[33]
Um estudo do National Program of Cancer Registries e das Estatísticas de Câncer dos EUA observou que a prevalência de câncer de mama triplo negativo entre mulheres negras nos EUA varia de acordo com o local de origem (por exemplo, nascida no oeste da África, nascida no Caribe ou nascida no leste da África).[34]
As mutações na linha germinativa em BRCA1 e BRCA2 são as mutações genéticas hereditárias mais comuns encontradas no câncer de mama.[16][17][18] No entanto, em judeus Ashkenazi, há uma frequência populacional maior (aproximadamente 2%) de três mutações fundadoras: BRCA1 185delAG, BRCA1 5382insC e BRCA2 6174delT.[35]
história familiar positiva de câncer de mama e/ou outros tipos de câncer
Aproximadamente um terço das mulheres com câncer de mama tem ≥1 parente com câncer de mama.[36][37]
A magnitude do risco de câncer de mama aumenta com o aumento do número de parentes afetados e com o aumento do número de familiares consanguíneos próximos afetados (por exemplo, parentes de primeiro e segundo grau) em cada lado da família.[20] As razões de risco em relação ao número de parentes de primeiro grau com história de câncer de mama são 1.8, 2.93 e 3.9 para mulheres com 1, 2 e ≥3 parentes de primeiro grau afetados, respectivamente.[14]
O aumento do risco pode ser devido a mutações genéticas herdadas e/ou exposições compartilhadas a outros fatores de risco, como estilo de vida e fatores ambientais.[20]
História familiar específica associada com o aumento do risco de câncer de mama hereditário inclui um ou mais familiares consanguíneos próximos com: câncer de mama antes dos 50 anos; história de câncer de mama masculino, câncer de ovário, câncer de pâncreas ou câncer de próstata (metastático ou de grupo de risco alto ou muito alto); ≥3 diagnósticos de câncer de mama e/ou próstata no mesmo lado da família; ascendência judaica asquenaze.[20]
mutações genéticas em genes de suscetibilidade ao câncer de mama
Estima-se que de 5% a 10% dos cânceres de mama estejam relacionados a mutações genéticas hereditárias.[14][15][16] As mutações BRCA1 e BRCA2 são as mutações genéticas hereditárias mais comuns encontradas no câncer de mama.[16][17][18]
Tumores de mama relacionados ao gene BRCA1 têm menos formação de túbulos, mais pleomorfismo e uma contagem mitótica mais alta, comparados a tumores esporádicos de câncer de mama.[38] Os cânceres de mama associados ao BRCA1 ocorrem em idade precoce e têm maior probabilidade de serem negativos para receptores hormonais ou triplo-negativos.[27][39][40][41]
Os tumores de mama relacionados ao BRCA2 têm menos formação de túbulos, comparados aos tumores de câncer de mama esporádicos, mas o pleomorfismo e a contagem mitótica são similares.[38] As mutações do BRCA2 estão associadas ao câncer de mama e de ovário de início precoce, ao câncer de mama masculino, ao câncer de próstata e ao câncer de pâncreas.[28][42] Portadores de BRCA-2 podem ter maior probabilidade de apresentar doença positiva para receptor hormonal e negativa para receptor tipo 2 do fator de crescimento epidérmico humano (HER2).[41]
Em um grande estudo de coorte prospectivo internacional, relatou-se que os riscos cumulativos de câncer de mama foram de 72% e 69% para portadoras da mutação das linhas germinativas BRCA1 e BRCA2, respectivamente.[18] Os riscos cumulativos de câncer de mama contralateral 20 anos após um diagnóstico inicial de câncer de mama foram relatados como sendo de 40% e 26% para portadoras da mutação das linhas germinativas BRCA1 e BRCA2, respectivamente.[18]
Os cânceres de mama relacionados ao BRCA são mais frequentes entre a população judaica asquenaze, devido à maior frequência de mutações do BRCA nessa população (acima de 2%), comparada à população geral.[35]
Mutações nos seguintes genes estão associadas ao câncer de mama: CHEK2, PALB2, ATM, BARD1, RAD51C, RAD51D, CDH1 (câncer gástrico difuso hereditário), NF1 (neurofibromatose do tipo 1), PTEN (síndrome de Cowden), STK11 (síndrome de Peutz-Jeghers) e TP53 (síndrome de Li-Fraumeni).[20][43] As variantes de ATM, BARD1, BRCA1, BRCA2, CHEK2, PALB2, RAD51C, RAD51D e TP53 estão associadas a um maior risco de doença triplo-negativa e/ou de alto grau.[41]
O teste para mutações em genes de suscetibilidade ao câncer de mama de alta penetrância (por exemplo, BRCA1, BRCA2, CDH1, PALB2, PTEN, STK11 e TP53) é indicado em certos pacientes com história pessoal de câncer de mama ou com história familiar de câncer de mama, ovário, pâncreas e/ou próstata, ou história familiar de uma variante patogênica em um gene de suscetibilidade ao câncer.[20] Consulte Rastreamento.
exposição ao estrogênio endógeno
Ensaios clínicos prospectivos demonstraram a correlação entre níveis maiores de hormônios sexuais endógenos e uma elevação significativa no risco de câncer de mama.[21][22]
O risco de câncer de mama diminui com uma menarca tardia e um início precoce da menopausa. O risco médio de câncer de mama aumenta em 4.0% a cada ano após uma menarca de início precoce e em 3.6% a cada ano após uma menopausa de início tardio.[44] Esses fatores de risco têm um efeito mais forte na incidência dos cânceres de mama positivos para receptor estrogênico que nos cânceres de mama negativos para receptor estrogênico.[45]
A gravidez e a amamentação reduzem a exposição cumulativa a hormônios endógenos e estão associadas à diminuição do risco de câncer de mama.[46][47] No entanto, a análise combinada de dados de estudos prospectivos indicou um aumento do risco de câncer de mama (principalmente positivo para receptor estrogênico) em mulheres multíparas por até 20 anos após o parto em comparação com mulheres nulíparas.[48] O risco foi mais pronunciado entre as mulheres com história familiar de câncer de mama, as mais velhas ao primeiro parto e as que tiveram mais filhos. Com um acompanhamento mais longo, a associação inversa esperada entre o parto e o câncer de mama com receptor estrogênico positivo ficou evidente.[48]
exposição ao estrogênio exógeno/progestina
As mulheres expostas a progestina e estrogênio exógeno (por exemplo, via terapia de reposição hormonal [TRH] ou contracepção hormonal) têm um risco de câncer de mama aumentado.[23][24][25]
A Women's Health Initiative (WHI) nos EUA compreendeu dois ensaios clínicos randomizados e controlados por placebo envolvendo 27,347 mulheres menopausadas. As intervenções foram estrogênios equinos conjugados com acetato de medroxiprogesterona para mulheres com útero intacto (n = 16,608) e estrogênios equinos conjugados isolados para mulheres com histerectomia prévia (n = 10,739). O ensaio clínico que randomizou mulheres menopausadas para TRH combinada com estrogênio associado a progestina ou placebo foi interrompido precocemente quando relatou que mulheres menopausadas no braço da TRH contendo estrogênio associado a progestina do estudo apresentavam um risco 26% maior de câncer de mama, um aumento de 29% no risco de doença coronariana, um aumento de 41% no risco de AVC e um aumento de 213% no risco de embolia pulmonar, após uma média de 5.2 anos de acompanhamento.[23] No ensaio clínico paralelo da WHI, o uso de estrogênio isolado reduziu significativamente a incidência de câncer de mama em mulheres com histerectomia prévia.[49] A razão de riscos (RR) para o risco de câncer de mama invasivo foi inferior a 1 durante a fase de intervenção (RR de 0.79, IC de 95%: 0.61 a 1.02) e permaneceu inferior a 1 na fase pós-intervenção precoce (RR de 0.55, IC de 95%: 0.34 a 0.89), mas a redução do risco não foi observada durante o acompanhamento pós-intervenção tardio (RR de 1.17, IC de 95%: 0.73 a 1.87).[49]
Após mais de 20 anos de acompanhamento cumulativo mediano, a WHI concluiu que o uso de estrogênio e progestina por mulheres com útero esteve associado a um aumento significativo na incidência de câncer de mama (taxa anualizada de 0.45%), em comparação com mulheres que receberam placebo (taxa anualizada de 0.36%). No entanto, o uso de estrogênio e progestina não esteve associado a aumento da mortalidade por câncer de mama.[50]
Um estudo de coorte prospectivo, realizado na Dinamarca, relatou um aumento de 20% no risco de câncer de mama nas mulheres que eram usuárias ou tinham uso recente de contracepção hormonal (estrogênio e progestina combinados e progestina isolada), comparadas às mulheres que nunca tinham usado esse método.[24] O risco aumentou com o uso mais prolongado da contracepção hormonal.[24]
Com base na literatura disponível sobre o uso de estrogênio exógeno e progestina, a U.S. Preventive Services Task Force concluiu que os efeitos nocivos da combinação de estrogênio e progestina provavelmente são maiores que os benefícios da prevenção de doença crônica na maioria das mulheres; portanto, seu uso não é recomendado para a prevenção primária de doenças crônicas em mulheres menopausadas.[51][52]
consumo de bebidas alcoólicas
Níveis moderados de ingestão de álcool estão associados a um aumento do risco de câncer de mama, e esse risco aumenta com níveis maiores de consumo de bebidas alcoólicas.[53][54][55] Idealmente, o consumo de bebidas alcoólicas deve ser evitado. Os indivíduos que optam por consumir bebidas alcoólicas devem limitar seu consumo a, no máximo, uma dose por dia, sem exceder três doses por semana.[56]
O efeito do consumo de bebidas alcoólicas pode ser mediado pelo aumento dos níveis de estrogênio. As mulheres menopausadas que consomem altos níveis de bebidas alcoólicas demonstram uma incidência maior de cânceres de mama positivos para receptor estrogênico.[57] Outros estudos têm indicado que o ácido fólico pode reduzir o efeito das bebidas alcoólicas no risco de câncer de mama.[58]
exposição à radiação
A radioterapia para tratar câncer de mama primário invasivo pode aumentar o risco de câncer de mama contralateral >5 anos após o tratamento.[59] A mutação BRCA1/2 pode contribuir para o aumento do risco.[60]
O tratamento com radiação torácica em crianças, adolescentes ou adultos jovens aumenta o risco de câncer de mama na vida adulta.[61][62][63] O risco de câncer de mama pode, no entanto, ser elevado em mulheres expostas à radiação em idades de até 45 anos.[64]
Os pacientes com linfoma de Hodgkin que fazem radioterapia torácica entre 10 e 30 anos correm maior risco de desenvolver câncer de mama do que a população em geral.[65][66] Os pacientes que recebem radioterapia de campo do manto (envolvendo os linfonodos axilares, mediastinais e cervicais) apresentam maior risco (risco 2.7 vezes maior) do que aqueles que recebem irradiação mediastinal isolada em uma dose semelhante.[62][66]
Outras populações que apresentam aumento do risco de exposição clínica à radiação incluem: pacientes com escoliose ou tuberculose monitorados por radiografia ou exame fluoroscópico; crianças tratadas com radiação para distúrbios benignos; e mulheres recebendo terapia com raios-X para doença benigna da mama ou mastite pós-parto.[67]
Sobreviventes da bomba atômica apresentam aumento do risco de câncer de mama.[68]
Um estudo de modelagem descobriu que o rastreamento de mulheres sobreviventes de câncer infantil com ressonância nuclear magnética anual, com ou sem mamografia, a partir dos 25 anos de idade, pode prevenir até 71% das mortes por câncer de mama nesse grupo. Sem o rastreamento, o risco de mortalidade por câncer de mama ao longo da vida foi de 11%.[69]
doença atípica da mama
Estudos relataram que mulheres com doença de mama benigna apresentam um risco relativo de 1.5 a 1.6 de desenvolvimento de câncer de mama, comparadas às mulheres da população em geral.[70][71][72] O aumento do risco é clinicamente significativo naqueles com doença mamária atípica; o risco relativo aumenta para 1.88 ou 4.24 se a histologia mostrar hiperplasia sem atipia ou hiperplasia com atipia, respectivamente.[72]
aumento da densidade da mama
Estudos sugerem que o aumento da densidade da mama está associado a um maior risco de câncer de mama.[73][74][75]
Uma revisão sistemática que avaliou a associação entre a densidade mamográfica (determinada usando mamografia digital) e o risco de câncer de mama relatou uma razão de chances de 1.83 para tecido mamário extremamente denso (densidade D do Breast Imaging Reporting and Data System [BI-RADS]) e 1.28 para mamas heterogeneamente densas (densidade C do BI-RADS) em comparação com tecido mamário de densidade média (densidade B do BI-RADS).[74]
Em um estudo longitudinal de densidade mamográfica, um aumento na densidade em 3 anos estava associado a um aumento no risco de câncer de mama.[76]
A sensibilidade mamográfica é menor em mulheres com mamas densas; exames de imagem suplementares podem ser necessários além do rastreamento de rotina.[77][78][79] Consulte Rastreamento.
realce parenquimatoso de fundo leve, moderado ou acentuado na ressonância nuclear magnética (RNM) da mama
O realce parenquimatoso de fundo refere-se à captação de contraste à base de gadolínio pelo tecido mamário normal à RNM da mama. Ele pode representar micropermeabilidade e/ou vascularidade elevada do tecido.
Um estudo observacional com 4247 mulheres submetidas a rastreamento e RNM de mama para diagnóstico constatou que as mulheres com realce parenquimatoso de fundo leve, moderado ou acentuado apresentaram aumento do risco de câncer de mama invasivo, comparadas com mulheres com realce parenquimatoso de fundo mínimo (razão de riscos [RR] 2.73, IC de 95% 1.66 a 4.49). Níveis elevados de realce parenquimatoso de fundo foram associados a aumento do risco.[80]
Em uma metanálise retrospectiva de estudos observacionais (incluindo 1910 mulheres com câncer de mama e 2541 participantes de controle), um nível mais alto de realce parenquimatoso de fundo foi associado à presença de câncer de mama entre mulheres com alto risco de câncer de mama, mas não em mulheres com risco médio.[81]
Fracos
atividade física reduzida
O comportamento sedentário está associado a aumento do risco de câncer de mama.[82][83][84][85]
Nas mulheres menopausadas, a atividade física e a perda de peso sustentada têm sido associadas a reduções no risco de câncer de mama.[86][87] A capacidade do exercício físico em reduzir os níveis de estrogênio endógeno tem sido postulada como o mecanismo que está por trás desse efeito.
Em mulheres na pré-menopausa, alguns estudos têm demonstrado que a atividade física regular reduz o risco de início precoce de câncer de mama, enquanto outros têm mostrado que o exercício não tem nenhum efeito sobre a incidência do câncer de mama.[88][89][90] Uma metanálise de estudos de coorte observacionais encontrou uma associação inversa entre maior atividade física e incidências de câncer de mama pré-menopausa e pós-menopausa.[83]
Usando a randomização mendeliana para simular um ensaio clínico randomizado e controlado, a atividade física vigorosa ≥3 dias por semana foi associada a um risco 38% menor de câncer de mama em mulheres nos períodos pré e perimenopausa em comparação com nenhuma atividade vigorosa.[91]
má alimentação
Os estudos que avaliam o efeito da dieta sobre o risco de câncer de mama têm apresentado resultados inconclusivos ou inconsistentes.[92] No NIH-AARP Diet and Health Study descobriu-se que as pacientes que estão no quintil mais alto de ingestão de gordura animal têm um aumento do risco de desenvolvimento de câncer de mama.[93][94]
Revisões sistemáticas e metanálises revelaram que o consumo de frutas, vegetais e peixes gordurosos reduz o risco de câncer de mama.[95][96] Ensaios clínicos randomizados e controlados de uma dieta com baixo teor de gordura não resultaram em menor risco de câncer de mama.[97][98]
condição socioeconômica alta
O câncer de mama é diagnosticado com mais frequência nas pacientes que pertencem a uma classe socioeconômica mais alta e naquelas com grau de escolaridade mais alto.[99] Essa relação pode ser explicada por diferenças no estilo de vida, como idade ao nascimento do primeiro filho e uso de hormônios exógenos, que podem aumentar o risco de câncer de mama nessa população.
A baixa condição socioeconômica está associada ao aumento do risco de câncer de mama agressivo na pré-menopausa, estádio mais avançado no diagnóstico e pior sobrevida.[100]
tabagismo
obesidade
A obesidade está associada ao aumento do risco de câncer de mama em mulheres menopausadas e a um risco menor de câncer de mama em mulheres na pré-menopausa.[105][106]
A associação entre o IMC e a incidência de câncer de mama é mais forte em populações da Ásia-Pacífico (risco relativo [RR] 1.18) que em populações europeias-australianas ou norte-americanas.[107] Cada 5 kg de peso ganho na fase adulta aumenta o risco de câncer de mama em mulheres menopausadas que nunca fizeram terapia de reposição hormonal em 11%.[108]
Um estudo de coorte retrospectivo relatou um menor risco de câncer de mama entre mulheres pré-menopausa e no pós-menopausa que fizeram cirurgia bariática (para IMC ≥35 kg/m²) em comparação com mulheres com o mesmo IMC que não tinham feito cirurgia bariátrica.[109]
alta exposição ao dibutil-ftalato
Um pequeno estudo do tipo caso-controle relatou uma associação significativa entre a concentração urinária de dibutilftalato e o aumento do risco de câncer de mama.[110]
Um estudo de coorte dinamarquês identificou um risco duas vezes maior na taxa de câncer de mama com receptor estrogênico positivo em mulheres expostas a altas doses cumulativas (≥10,000 mg) de dibutil-ftalato nas formulações medicamentosas. Níveis mais baixos de exposição não foram associados a um aumento na incidência de câncer de mama.[111]
Os ftalatos podem promover o crescimento do tumor de mama por meio da sinalização ao receptor estrogênico. Eles são constituintes de embalagens, cosméticos, itens de cuidados pessoais e utensílios domésticos. Os dibutilftalatos são usados em cápsulas farmacêuticas para oferecer propriedades de liberação prolongada ou tardia.
O uso deste conteúdo está sujeito ao nosso aviso legal