Recomendaciones
Urgente
Utilice un enfoque ABCDE para diagnosticar el shock con el fin de tratarlo empíricamente. Identifique la causa subyacente del shock lo antes posible para reducir la mortalidad.
Comprobar si hay hipotensión[2]
La taquicardia puede ser un signo más temprano de shock.[25]
Evaluar la perfusión tisular inadecuada[1][2]
Revise la piel en busca de periferias frías y húmedas; una apariencia moteada y cenicienta; y cianosis de la piel, los labios o la lengua.
Controle la diuresis. La oliguria sugiere una mala perfusión renal.
Evaluar los cambios en el estado mental.La agitación, la confusión y la angustia se producen temprano; la falta de respuesta indica un shock más grave y avanzado.
Realizar una gasometría arterial o venosa.
La acidosis metabólica con lactato sérico elevado (>2 mmol/L [>18 mg/dL]) y exceso de base negativa siempre está presente en el shock establecido.[25]
Evaluar la gravedad del shock y reanimar.
Asegure una vía respiratoria permeable. Obtenga ayuda para personas mayores de inmediato si sospecha que las vías respiratorias están comprometidas.[26]
Verifique si hay hipoxemia y administre oxígeno si es necesario.
Monitorear la oxigenoterapia controlada. Un límite superior de SpO2 del 96% es razonable cuando se administra oxígeno suplementario a la mayoría de los pacientes con enfermedad aguda que no están en riesgo de hipercapnia.
La evidencia indica que el uso liberal de oxígeno suplementario (SpO2 objetivo >96%) en adultos gravemente enfermos se asocia con una mayor mortalidad que la oxigenoterapia más conservadora.[27]
Un objetivo más bajo de SpO2 del 88% al 92% es adecuado si el paciente está en riesgo de insuficiencia respiratoria hipercápnica.[28]
Use ventilación mecánica si es necesario pero tenga cuidado, esto puede empeorar la hipotensión.[3][29]
Administrar fluidoterapia intravenosa intravenosa en función de la evaluación del estado de los líquidos (o productos sanguíneos si el shock es secundario a una hemorragia aguda).[1][2][30][31]
Use un cristaloide, ya sea solución salina normal o de Hartmann.
Comience con un bolo de líquido de 500 ml y vuelva a evaluar la necesidad de más líquido en bolos de 250-500 ml. Use volúmenes iniciales más pequeños (por ejemplo, 250 ml) para pacientes con insuficiencia cardíaca o traumatismo conocidos.[26]
Administre fármacos vasoactivos si no responde a fluidoterapia intravenosa o hemoderivados.
Siempre mida la temperatura y la glucosa.
Identificar y tratar la causa subyacente.[1][2][3][24]
Evaluar la función cardíaca si la causa del shock no es obvia después de la evaluación inicial.
Utilice la ecografía en el punto de atención como primera prueba diagnóstica.
Principales recomendaciones
Definición
El shock es una forma generalizada de insuficiencia circulatoria aguda potencialmente mortal con un suministro inadecuado de oxígeno y, en consecuencia, una utilización de oxígeno por parte de las células.[1][2]
El término "shock" describe un estado fisiopatológico con muchas causas diferentes y no es un diagnóstico específico.[2]
Identificación del paciente en shock
Puede ser difícil reconocer el shock. Los pacientes tienen mal aspecto y, a menudo, tienen síntomas específicos de la causa subyacente (p. ej., fiebre, dolor torácico, disnea o dolor abdominal).
Presentación clínica
Las características clínicas pueden ser inespecíficas, pero a menudo incluyen:
Presión arterial sistólica de <90 mmHg o PAM de <65 mmHg, o una disminución de ≥40 mmHg desde el inicio.
Los pacientes pueden ser normotensos o hipertensos, especialmente en las primeras etapas del shock.La hipotensión no es esencial para el diagnóstico. La taquicardia puede ser un signo más temprano de shock.
Cambios en la piel[2][3][24]
Moteado, ceniciento, sudoración y cianosis de la piel, los labios o la lengua. La piel puede estar fría o húmeda periféricamente.
oliguria
cambios en el estado mental[3]
Utilice la escala de coma de Glasgow (GCS). [ Escala de Coma de Glasgow Opens in new window ]
La agitación, la confusión y la angustia se producen temprano, mientras que la falta de respuesta indica un shock más severo y avanzado.
Las características generales del shock incluyen compromiso de las vías respiratorias, disnea, hipoxemia y fiebre o hipotermia.[1][2][3][18][34]
Las características debidas a la causa subyacente pueden incluir dolor torácico en el infarto agudo de miocardio o dolor lumbar en el aneurisma aórtico abdominal roto.
Identificar la causa subyacente
Es esencial identificar y tratar rápidamente la causa subyacente para reducir la mortalidad. El shock séptico es el más frecuente (62%), seguido del cardiogénico (16%).Hay cuatro clases de shock:[2][3][30][33][35][36]
Distributivo (p. ej., sepsis, anafilaxia, neurogénico, endocrino)
Cardiogénico (p. ej., infarto de miocardio con elevación del segmento ST, cardiomiopatía, arritmia)
Hipovolémico (p. ej., hemorragia [traumatismo o hemorragia interna como rotura de aneurisma aórtico, hemorragia gastrointestinal], no hemorrágica [otras pérdidas de líquidos])
Obstructivo (p. ej., embolia pulmonar, neumotórax a tensión, pericarditis constrictiva).
Tenga en cuenta que un paciente individual puede tener más de un tipo de shock al mismo tiempo.[2]
Pruebas diagnósticas
Realice lo siguiente en todos los pacientes con shock.[1][2][3][37][38][39]
Nivel de lactato sérico: >2 mmol/L (>18 mg/dL) están presentes en el shock.
Gasometría arterial o venosa: la acidosis metabólica está presente en el shock.
Glucosa: comprobar si hay hiperglucemia.
Análisis de sangre que incluyen hemograma completo, urea y electrolitos, LFT, estudios de coagulación y proteína C-reactiva.
ECG: debe ser monitoreado continuamente. Buscar taquiarritmias o bradiarritmias.
RT: buscar edema pulmonar, neumonía, neumotórax, mediastino ensanchado (p. ej., debido a disección aórtica).
Ecografía en el punto de atención: use un protocolo como el Rapid Ultrasound in Shock and Hypotension (RUSH) para examinar los pulmones, la vena cava inferior (VCI), la aorta y el abdomen para buscar la causa del shock. Evaluar la función cardíaca con ecocardiografía para identificar la causa del shock, seleccionar el tratamiento más adecuado y evaluar la respuesta al tratamiento.[14]
Utilice su evaluación inicial para guiar pruebas diagnósticas adicionales sobre la causa del shock.
Cuándo escalar
Obtenga ayuda experta en todos los pacientes con shock. Escalar todos los pacientes complejos, como aquellos con:[30]
Sepsis
Shock cardiógeno
Edema pulmonar
Hiper/hiponatremia
Enfermedad renal o hepática.
También escale a cuidados intensivos en pacientes en cualquiera de las siguientes situaciones:[18][34]
Compromiso de las vías respiratorias
Hipoxemia grave o necesidad de ventilación no invasiva
Necesidad de vasopresores o inotrópicos
Conciencia significativamente reducida (especialmente si GCS es ≤8)
Hiperlactemia significativa (lactato >4 mmol/L [>36 mg/dL]).
Una forma generalizada de insuficiencia circulatoria aguda potencialmente mortal con suministro inadecuado de oxígeno y, en consecuencia, utilización de oxígeno por parte de las células.[2]
Practical tip
El término "shock" describe un estado fisiopatológico con muchas causas diferentes y no es un diagnóstico específico.[2]
Verifique la hipotensión arterialdefinida como una presión arterial sistólica de <90 mmHg, o una presión arterial media (PAM) de <65 mmHg, o una disminución de ≥40 mmHg desde el inicio.[2]
Se produce en la mayoría de los pacientes, pero una presión arterial normal no descarta el shock.[3]
La presión arterial puede ser normal porque los mecanismos compensatorios pueden preservar la presión arterial a través de la vasoconstricción, aunque la perfusión tisular y la oxigenación ya han disminuido significativamente.[2]
Una presión arterial diastólica baja sugiere vasodilatación arterial (como en la anafilaxia o la sepsis).[26]
Un estrechamiento de la presión del pulso (la diferencia entre las presiones sistólica y diastólica; normalmente 35-45 mmHg) sugiere vasoconstricción arterial (como en el shock cardiogénico o la hipovolemia) y puede producirse con taquiarritmias rápidas.[26]
Practical tip
Los pacientes mayores pueden tener shock a una presión arterial sistólica normal de 110 a 120 mmHg debido a la aterosclerosis, la hipertensión y los reflejos menos funcionales.[40]
Evidencia: Una presión arterial normal no descarta el shock
Una presión arterial sistólica de >95 mmHg no es una medida sensible para descartar una pérdida de sangre moderada o significativa en el shock hemorrágico.
La precisión diagnóstica de una presión arterial sistólica de <95 mmHg asociada con shock secundario a sangrado agudo se evaluó en una revisión sistemática de hallazgos físicos en pacientes con hipovolemia.[41] Un modelo de efectos aleatorios produjo una sensibilidad del 13% para la pérdida de sangre moderada y del 33% para la pérdida de sangre grave. Una disminución en el gasto cardíaco se asocia con una vasoconstricción significativa, lo que lleva a una disminución de la perfusión periférica para mantener la presión arterial.[42]
Varios estudios muestran que una presión arterial normal puede estar asociada con marcadores de perfusión tisular inadecuada.[43][44]
Estos incluyen una disminución de la saturación de oxígeno venoso central (ScvO 2) y un aumento significativo de las concentraciones de lactato en sangre.
La hipotensión persistente en pacientes con shock séptico sin aumento de los niveles de lactato puede tener un impacto limitado en la mortalidad.[45]
La taquicardia puede ser un signo más temprano de shock que la hipotensión (debido a los mecanismos compensatorios que mantienen el gasto cardíaco).[25]
La frecuencia cardíaca inicial puede ser más baja en:[24][25]
Jóvenes y adultos en forma
Personas de edad avanzada
Si hay infección, es posible que no desarrollen un aumento de la frecuencia cardíaca
Pueden desarrollar una nueva arritmia en respuesta al shock (particularmente en el shock séptico) en lugar de un aumento de la frecuencia cardíaca
Pacientes que toman determinados medicamentos que afectan la respuesta de la frecuencia cardíaca, como los betabloqueantes.
La frecuencia cardíaca inicial puede ser más alta en el embarazo.
Esto suele ser de 10 a 15 latidos por minuto más de lo normal.
Evaluar los signos de perfusión tisular alterada
Cambios en la piel[2][3][24]
Periferias frescas y húmedas
Moteado, aspecto ceniciento ysudoración
Cianosis de la piel, los labios o la lengua.
Practical tip
En la sepsis temprana, la piel puede estar caliente. Puede enfriarse si el paciente se deteriora debido a la reducción de la perfusión periférica.[46]
En la anafilaxia puede haber eritema parcheado/generalizado, urticaria y angioedema. Estos pueden estar ausentes en el 20% de los pacientes con anafilaxia.[47]
En el shock neurogénico, la piel puede estar caliente y seca. La pérdida del tono simpático por una lesión de la médula espinal conduce a vasodilatación y ausencia de sudoración.[35]
oliguria[3]
Considere insertar un catéter urinario. La oliguria es de <0.5 ml/kg/hora y es un signo de perfusión renal reducida.[2]
La reducción de la perfusión renal conduce a un volumen reducido de orina concentrada con baja excreción de sodio. Esto está mediado por la hormona antidiurética y el sistema renina-angiotensina-aldosterona para retener sodio y agua y corregir el agotamiento de líquidos.[48]
Alteración del estado mental[2][3]
Evaluar el estado mental del paciente mediante la Escala de Coma de Glasgow. [ Escala de Coma de Glasgow Opens in new window ]
La agitación, la confusión y la angustia se producen temprano. La falta de respuesta indica un shock grave y avanzado.
Practical tip
La consciencia alterada es el signo más sensible y universal de la hipoperfusión.[2]
Evaluar el compromiso de las vías respiratorias[49]
Buscar:
Labios y lengua hinchados en anafilaxia
Babeo e incapacidad para tragar secreciones
Inflamación y esputo negruzco después de una lesión térmica / quemaduras
Hematoma cervical tras lesión contundente o penetrante
Una erupción asociada en la anafilaxia y un aumento del trabajo respiratorio que se observa en el asma grave
Movimiento anormal de la pared torácica y abdominal, lo que sugiere obstrucción de las vías respiratorias
Falta de empañamiento de la máscara de oxígeno.
Escuchar:
Ronquidos de obstrucción parcial de las vías respiratorias
Voz ronca en anafilaxia
Estridor o sibilancias.
Palpar suavemente para detectar:
Fracturas faciales inestables
Las fracturas que podrían comprometer las vías respiratorias incluyen fracturas maxilares o mandibulares, dientes fracturados o exfoliados y sangrado por epistaxis o fracturas faciales
Crepitis y enfisema quirúrgico en lesión laríngea.
Practical tip
Obtenga de manera temprana la valoración de un especialista sénior en medicina intensiva en pacientes con shock, particularmente si presentan acidosis grave o alteración del nivel de conciencia.
Buscar signos de disnea[3]
Buscar taquipnea y aumento del trabajo respiratorio.
La frecuencia respiratoria aumenta en la hipoxia (p. ej., en la neumonía), pero a menudo permanecerá elevada a pesar de la corrección de la PaO2, ya que el empeoramiento de la perfusión genera una acidosis metabólica que requiere compensación respiratoria.[2]
Evaluar las saturaciones de oxígeno[37]
La hipoxemia puede ser secundaria a:
Hipoxemia hipóxica (p. ej., neumonía)
Hipoxemia estancada (p. ej., shock cardiogénico)
Hipoxemia anémica (p. ej., sangrado agudo)
Hipoxemia citotóxica (p. ej., intoxicación por monóxido de carbono).
Administrar oxígeno de alto flujo. Monitorear la oxigenoterapia controlada. Un límite superior de SpO2 del 96% es razonable cuando se administra oxígeno suplementario a la mayoría de los pacientes con enfermedad aguda que no están en riesgo de hipercapnia.
La evidencia indica que el uso liberal de oxígeno suplementario (SpO2 objetivo >96%) en adultos gravemente enfermos se asocia con una mayor mortalidad que la oxigenoterapia más conservadora.[27]
Un objetivo más bajo de SpO2 del 88% al 92% es adecuado si el paciente está en riesgo de insuficiencia respiratoria hipercápnica.[28]
La ventilación mecánica puede ser necesaria, pero puede empeorar la hipotensión.
Medir la temperatura[25]
Tratar a los pacientes con hipotermia y shock temprano. La hipotermia persistente que es resistente al tratamiento es el signo clínico más obvio de shock irreversible en etapa terminal por cualquier causa.[25]
La hipotermia puede deberse a la vasoconstricción y también se puede observar en pacientes con traumatismos.[25]
La hipertermia también puede estar presente y puede deberse a muchas causas, como sepsis, embolia pulmonar, determinadas toxinas (por ejemplo, sobredosis de salicilato) y emergencias endocrinas como feocromocitoma o una crisis de Addison.[25][51]
Evaluar el estado de los líquidos a través de los antecedentes y la exploración física en todos los pacientes con sospecha de shock.
Los signos de hipovolemia son:[30]
Reducción de la perfusión periférica de la piel y de la temperatura cutánea
Reducción de la turgencia de la piel y sequedad de las membranas mucosas.
Los signos de sobrecarga de líquidos son:[30]
Una presión venosa yugular elevada: refleja el retorno venoso a la aurícula derecha y, por lo tanto, la hidratación. Sin embargo, también se ve afectado por la enfermedad cardiopulmonar. La insuficiencia cardíaca del lado derecho, la regurgitación tricúspide y la hipertensión pulmonar también causan un aumento de la presión venosa yugular, incluso si el paciente no tiene sobrecarga de líquidos
Un soplo sistólico o un tercer ruido cardíaco (insuficiencia mitral funcional)
Crepitaciones bibasales en la auscultación pulmonar: se producen con edema pulmonar, pero también en pacientes con fibrosis pulmonar, atelectasia e infección (que a veces conduce a un tratamiento diurético inadecuado)
Edema dependiente (periférico o sacro): generalmente indica un exceso significativo de líquido extracelular
Hipertensión (p. ej., en pacientes con insuficiencia renal).
Utilice la prueba de elevación pasiva de piernas si se dispone de un monitoreo adecuado.[2][30][52]
Este es un indicador útil de la capacidad de respuesta a los fluidos que debe evaluarse utilizando dispositivos que puedan monitorear continuamente el gasto cardíaco en tiempo real (p. ej., monitor de gasto cardíaco continuo de índice de pulso [PiCCO] o Doppler esofágico) o ecocardiografía transtorácica en serie, generalmente en una unidad de cuidados intensivos (UCI) en lugar de un entorno de sala general.
Sentar al paciente en posición vertical a 45° e incline toda la cama 45°.
Los pacientes con una prueba positiva tienen un aumento del >10% en el gasto cardíaco o el volumen sistólico, lo que indica que se pueden requerir más líquidos.
Monitorizar la función cardíaca, el gasto cardíaco y la precarga en estado de shock para:[1][2][3]
Identificar el tipo de shock si no está claro en la exploración inicial
Seleccionar el tratamiento más adecuado
Evaluar la respuesta al tratamiento.
Utilizar la ecocardiografía como primera prueba diagnóstica para identificar la causa del shock si no está clara en la exploración inicial. Considere la posibilidad de realizar una ecocardiografía transtorácica seriada o una monitorización hemodinámica invasiva, como el Doppler esofágico (rara vez se utiliza la termodilución transpulmonar) en pacientes complejos para determinar el tipo de shock y la respuesta al tratamiento [1][2][53]
El shock distributivo se caracteriza por un gasto cardíaco elevado, mientras que otros tipos de shock se asocian con un gasto cardíaco bajo.
El shock hipovolémico se asocia con presiones y volúmenes sanguíneos bajos, mientras que estos aumentan en el shock cardiogénico.
El shock obstructivo se asocia con un aumento de la presión de la arteria pulmonar y cavidades dilatadas del lado derecho.
El taponamiento cardíaco, una forma de shock obstructivo, se asocia con la compresión de todas las cavidades, presiones intracardíacas elevadas, pero volúmenes cardíacos pequeños. Ver Taponamiento cardíaco.
Determinar la capacidad de respuesta de los líquidos (una medida de precarga) para evaluar si un paciente necesita líquido adicional para aumentar el gasto cardíaco. Utilizar evaluaciones dinámicas de la función cardíaca en lugar de estáticas cuando sea posible [1][2]
La respuesta a los líquidos se define como un aumento del volumen sistólico del 10% al 15% después de que el paciente recibe 500 ml de cristaloide durante 10-15 minutos.[2]
Las pruebas estáticas son menos confiables que las pruebas dinámicas.Incluyen:
Frecuencia cardíaca, presión arterial, venas colapsadas, tiempo de llenado capilar, producción de orina
Presión venosa central (CVP)
PiCCO[54]
Se trata de un monitor de gasto cardíaco que combina el análisis del contorno del pulso y las técnicas de termodilución transpulmonar.
Proporciona una estimación del agua pulmonar extravascular, que es un indicador sensible del edema pulmonar.[55]
Las pruebas dinámicas son más útiles pero están limitadas por el hecho de que muchas técnicas requieren que el paciente sea ventilado mecánicamente. Entre ellas se incluyen:[2][30][56]
Esto se puede utilizar para:
Evaluar la compresibilidad de la vena cava
Si la VCI es compresible, el paciente puede necesitar más líquido
Si la VCI no es depresible, es poco probable que el paciente responda a más líquido.
Calcular el índice de tiempo de velocidad subaórtica, que permite medir el volumen sistólico y el gasto cardíaco.
Evaluar el volumen diastólico final, que se puede utilizar para estimar la precarga.
Determinar si un paciente tiene riesgo de sobrecarga de líquidos y edema pulmonar. Una VCI pequeña que varía en tamaño con la respiración, las cavidades cardíacas derechas no dilatadas, un tabique intraventricular no desplazado, la ausencia de insuficiencia sistólica ventricular derecha e izquierda y la ausencia de marcadores de presión telediastólica ventricular izquierda elevada sugieren que la administración de líquidos no causará daño agudo.
Evaluación de la variación de la presión del pulso (VPP), la variación del volumen sistólico (SVV) y la variación de la presión sistólica (SPV)[2][14]
Estos se miden utilizando monitores hemodinámicos especializados (como dispositivos PiCCO o LiDCO®).
Decida qué parámetro usar según sus preferencias personales.
Practical tip
SVV de más del 12% predice con precisión la capacidad de respuesta de los fluidos con valores superiores al 14% que tienen un valor predictivo positivo muy alto y valores inferiores al 10% que tienen un valor predictivo negativo alto.[57]
Evaluar el gasto cardíaco y el volumen sistólico para determinar si se deben usar inotrópicos.[2]
Utilice la ecocardiografía de primera línea para evaluar el gasto cardíaco y el volumen sistólico.
Practical tip
Tenga en cuenta el estado general del paciente cuando utilice una medida de precarga (especialmente si se trata de una medición única). Un paciente con un estado normal de líquidos tiene una precarga muy baja y no requiere líquido adicional. Pero algunos pacientes con altas medidas de precarga pueden necesitar líquidos adicionales. Es mejor evaluar los cambios en estos parámetros después de las intervenciones en lugar de utilizar una sola medición.[2]
Evidencia: Técnicas utilizadas para determinar la función cardíaca, el gasto cardíaco y la precarga
La predicción de la respuesta a los líquidos con CVP y presión de oclusión de la arteria pulmonar (POAP) es controvertida. Evidencia considerable muestra que no son medidas precisas de la capacidad de respuesta a los fluidos.[58]
En un estudio de voluntarios sanos normales, tanto CVP como POAP demostraron ser malos factores pronósticos de precarga, función cardíaca y cambios en la función cardíaca después de la carga de líquido en comparación con las mediciones de volúmenes ventriculares telediastólicos. También se ha encontrado que los volúmenes ventriculares telediastólicos proporcionan estimaciones superiores de la precarga en comparación con CVP y POAP en pacientes en estado crítico.[59]
El estudio FENICE, un estudio observacional realizado en UCI de todo el mundo, mostró que los marcadores estáticos de precarga todavía se utilizan para probar la capacidad de respuesta de precarga en un tercio de los casos.[60]
Una revisión sistemática identificó 24 estudios, que incluyeron 803 pacientes. Cinco estudios compararon la CVP con el volumen sanguíneo circulante medido, mientras que 19 estudios determinaron la relación entre la CVP y el cambio en el rendimiento cardíaco después de un desafío con líquidos. La revisión mostró una relación muy pobre entre la CVP y el volumen sanguíneo, así como la incapacidad de la CVP para predecir la respuesta hemodinámica a una sobrecarga líquida.[61]
En un estudio retrospectivo se revisaron 96 pacientes con sepsis y se concluyó que la CVP y la POAP también son malos predictores de la respuesta a los líquidos en pacientes sépticos. Un CVP de <8 mmHg y un POAP de <12 mmHg pronosticaron la capacidad de respuesta al volumen con un valor predictivo positivo de solo 47% y 54%, respectivamente. Cuando esto se combinó con un índice de volumen sistólico bajo (<30 mL/m²), sus valores predictivos positivos aún eran insatisfactorios: 61% y 69%, respectivamente. Cuando se consideró la combinación de CVP y POAP en lugar de cualquiera de las presiones solas, no mejoró el grado de predicción de la capacidad de respuesta al volumen.[62]
Las guías de práctica clínica recientes aún establecen que un CVP bajo respalda una respuesta a la carga de líquidos. Las guías de práctica clínica de la Surviving Sepsis Campaign sugieren un objetivo de CVP de 8 mmHg a 12 mmHg en las primeras 6 horas (o de 12 mmHg a 15 mmHg si se ventila mecánicamente) como objetivos de reanimación iniciales si se ha colocado una vía central.[1]
Los estudios han demostrado que las medidas dinámicas de la capacidad de respuesta de los fluidos son mejores factores pronósticos de la capacidad de respuesta de los fluidos que los parámetros estáticos.
Por ejemplo, se ha demostrado que el VPP y el SVV son buenos factores pronósticos de la respuesta a los líquidos en pacientes sedados y ventilados mecánicamente sin actividades respiratorias espontáneas y en ritmo sinusal.[2] En un metanálisis que incluyó 22 estudios y 807 pacientes, se notificó una sensibilidad combinada para pronosticar la respuesta a los líquidos con VPP del 88% y una especificidad del 89%.[63]
Se ha demostrado que la elevación pasiva de las piernas es útil para predecir la capacidad de respuesta individual a los líquidos durante las respiraciones espontáneas y de presión positiva, al tiempo que evita los riesgos de una sobrecarga de líquidos innecesaria.[64][65]
Evidencia: Evaluación de la función cardíaca para orientar la reanimación
La evaluación de la función cardíaca es importante para decidir si se deben usar inotrópicos en pacientes con shock. Los inotrópicos deben administrarse solo cuando la función cardíaca alterada se acompaña de un gasto cardíaco bajo o inadecuado y hay signos de hipoperfusión tisular.[2]
En un ensayo con más de 200 pacientes con shock séptico, se observó que varios pacientes tenían una fracción de eyección del ventrículo izquierdo (FEVI) cercana al 40% a pesar de que su índice cardíaco era superior a 3 L/minuto/m². Por el contrario, varios pacientes tenían un gasto cardíaco bajo, pero la función cardíaca preservada y la estimulación inotrópica no debe usarse en estos pacientes.[66]
Un estudio prospectivo de 46 pacientes con shock séptico observó que la evaluación ecocardiográfica de la función miocárdica y la respuesta a la precarga a menudo condujo a intervenciones diferentes a las guiadas por los objetivos de reanimación propuestos por la campaña "Sobrevivir a la sepsis" (Surviving Sepsis Campaign, SSC).[1][67] En este estudio, los autores encontraron que el acuerdo sobre la indicación (o ausencia de indicación) para la administración inotrópica se produjo en 34 (74%) de los pacientes, pero que la evaluación de la FEVI sugirió el uso de agentes inotrópicos en 11 pacientes para los que las guías de práctica clínica de la campaña "Sobrevivir a la sepsis" (Surviving Sepsis Campaign, SSC) sugerían lo contrario. Por lo tanto, estos autores sugirieron que la reanimación debería guiarse por las mediciones de la FEVI en lugar de por los criterios de la campaña "Sobrevivir a la sepsis" (Surviving Sepsis Campaign, SSC). Sin embargo, estos datos deben interpretarse con precaución, ya que no se realizó ningún análisis del resultado de los pacientes.
Medir la función cardíaca y/o el gasto cardíaco para evaluar la respuesta a líquidos o inotrópicos.[2]
Un cambio en el gasto cardíaco de al menos el 10% al 15% es una respuesta positiva a los líquidos.[2]
Usar ecocardiografía seriada para evaluar la respuesta al tratamiento.[2]
Considere la posibilidad de utilizar monitores hemodinámicos avanzados(como los dispositivos PiCCO o LiDCO®) en estados de shock complejos.
Insertar una línea arterial y un catéter venoso central (CVC) en todos los pacientes con shock que no responden a la rehidratación o que necesitan vasopresores.[2]
Una línea arterial permite un control continuo de la presión arterial y un análisis regular de gases en sangre.
Se requiere un CVC para la monitorización hemodinámica avanzada utilizando un dispositivo PiCCO. Esto permite una rehidratación agresiva en pacientes con enfermedades cardíacas sin causar edema pulmonar.
Administrar todos los medicamentos vasoactivos a través de un CVC (con la excepción de metaraminol y adrenalina [epinefrina]).
Un CVC también puede medir ScvO 2. Esto refleja el equilibrio del suministro de oxígeno en comparación con el consumo de oxígeno.
ScvO 2 <65% sugiere alteración de la oxigenación de los tejidos
ScvO 2 >80% sugiere un PaO 2 alto, o sospecha:
Alteración de la utilización del oxígeno por parte de las células (p. ej., sepsis grave)
Derivación microcirculatoria (p. ej., sepsis grave, insuficiencia hepática)
Derivaciones de izquierda a derecha.
Practical tip
Una limitación importante de la CVP medida por CVC es que las presiones de llenado auricular son "inapropiadamente" altas en insuficiencia cardíaca del lado derecho, insuficiencia tricuspídea, cor pulmonale y en presencia de embolia pulmonar, incluso cuando estos pacientes son hipotensos y oligúricos y pueden necesitar rehidratación. La ventilación mecánica también aumenta la CVP.[2]
Identificar la posible causa subyacente del shock a través de los antecedentes y la exploración física. Sin embargo, no retrase el manejo de apoyo si la causa no está clara.
Hay cuatro categorías diferentes de shock: distributivo (falo de la vasorregulación); cardiogénico (disfunción de la bomba); hipovolémica (pérdida de volumen intravascular); obstructivo (barreras para el flujo cardíaco o el llenado).Tenga en cuenta que un paciente individual puede tener más de un tipo de shock al mismo tiempo.[2]
Distributivo (fallo de la vasorregulación)
Sepsis[1][24]
Identificar una posible fuente de infección a través de los antecedentes (p. ej., tos, cirugía reciente, dolor abdominal, disuria).
Buscar una erupción cutánea que no blanqueante .
Verificar si hay una violación de la integridad de la piel (p. ej., cortes, quemaduras, úlceras, infecciones de la piel, hinchazón o secreción en el sitio de la herida quirúrgica). Retirar los vendajes.
Verificar la temperatura: puede haber fiebre O hipotermia.
Ver Sepsis en adultos.
Practical tip
Considere la sepsis en todos los pacientes, especialmente aquellos que presentan signos o síntomas que indican una posible infección.[24]
Es posible que los pacientes no tengan una fuente de infección obvia. Pueden describir sentirse muy mal y pueden no tener una temperatura alta.[24]
Evalúe a los pacientes que podrían tener sepsis con especial cuidado si no pueden dar un buen historial (por ejemplo, personas con inglés como segundo idioma o personas con problemas de comunicación como discapacidades de aprendizaje o autismo).[24]
Anafilaxia[47]
Puede haber antecedentes de desencadenantes (p. ej., alimentos, medicamentos e insectos que pican).
Evaluar el estridor o el broncoespasmo.
Auscultar el pecho para escuchar si hay sibilancias.
El paciente puede tener una voz ronca.
Buscar enrojecimiento, urticaria (las ronchas pueden ser pálidas, rosadas o rojas, y pueden verse como picaduras de ortiga y generalmente pican) y angioedema (más frecuentemente en los párpados y los labios, y a veces en la boca y la garganta).
Puede haber síntomas gastrointestinales como dolor abdominal, vómitos o incontinencia.
Ver Anafilaxia.
Neurogénico[35]
Suele manifestarse por una parálisis inicialmente flácida debajo del nivel de la lesión, con antecedentes compatibles con traumatismo medular o lesión medular.
La vejiga se puede palpar debido a retención urinaria.
Cardiogénico (disfunción de la bomba)
Puede haber pistas en los antecedentes como dolor torácico, disnea, síncope, palpitaciones o náuseas y vómitos.[3]
El infarto de miocardio es la causa más frecuente de insuficiencia ventricular izquierda que causa shock cardiógeno (75%-80% de los casos).[25][36]
Otras causas incluyen taquiarritmias (p. ej., fibrilación auricular o taquicardia ventricular), bradiarritmias, sustancias tóxicas (p. ej., alcohol, drogas recreativas), falta de cumplimiento con la ingesta de sal/líquidos o medicamentos, aumento excesivo de la presión arterial, infección (p. ej., neumonía, endocarditis infecciosa, sepsis) y causas mecánicas agudas (p. ej., rotura miocárdica, traumatismo torácico, incompetencia valvular aguda).[3]
Evaluar los síntomas y signos de insuficiencia cardíaca, como edema periférico bilateral, aumento de la presión venosa yugular, ortopnea, hepatomegalia congestionada o reflejo hepatoyugular.[3]
Hipovolémico (pérdida de volumen intravascular)
Hemorrágica
El sangrado gastrointestinal y el trauma son causas comunes de shock hemorrágico.[18][19] Entre otras causas se incluyen las siguientes:
Rotura de aneurisma aórtico abdominal
Sangrado espontáneo por anticoagulación
Sangrado posparto secundario a placenta previa o desprendimiento prematuro de placenta, y rotura de embarazo ectópico o rotura de quiste ovárico.
Verificar si hay melena si se sospecha sangrado gastrointestinal.
Buscar hemorragia externa de heridas o drenajes o evidencia de hemorragia oculta (p. ej., torácica, intraperitoneal, retroperitoneal o intestinal).[26]
Practical tip
La pérdida de sangre intratorácica, intra-abdominal o pélvica puede ser significativa después de la cirugía, incluso si los drenajes están vacíos.[26]
Siempre solicite una prueba de embarazo en una mujer en edad fértil con shock. Una rotura de embarazo ectópico o una rotura de quiste ovárico pueden causar shock hemorrágico sin una fuente obvia de pérdida de sangre.
Realizar una encuesta primaria en pacientes con traumatismos. Los principales sitios de sangrado interno son el tórax, el abdomen, la pelvis y los huesos largos.[18]
Practical tip
Una mnemotecnia útil para recordar los sitios de sangrado grave en el trauma es 'sangre en el suelo (sangrado externo) y cuatro más (sangrado interno: pecho, abdomen, pelvis y huesos largos)'.
Las fracturas de la pelvis pueden ocultar cantidades masivas de sangrado.Si la pelvis es inestable, sospeche una pérdida de sangre significativa.[68]
El sangrado espontáneo en el retroperitoneo puede causar shock sin hallazgos físicos significativos.[68]
Las fracturas de las extremidades inferiores, especialmente las fracturas cerradas de fémur, pueden ocultar fácilmente 2–3 unidades de sangre.[68]
La lesión en la cabeza rara vez es una causa de hipotensión y nunca es la causa de una pérdida masiva de sangre, a menos que haya una hemorragia externa.[68]
No hemorrágico
Quemaduras
Cetoacidosis diabética (CAD)
Buscar la tríada de cetonemia, hiperglucemia y acidosis.[33]
Obstructivo (barreras para el flujo cardíaco o el llenado)
Embolia pulmonar (EP)
La disnea aguda, el dolor torácico pleurítico o las características de trombosis venosa profunda se producen en el 97% de los pacientes con EP.[69]
El shock en la EP indica una EP masiva (de alto riesgo).[70]
Ver Embolia pulmonar.
Taponamiento cardíaco
A menudo se presenta con disnea, taquicardia y dolor torácico.
Escuche los ruidos cardíacos apagados y un roce pericárdico (presente en el 50% pero puede ser transitorio).[71]
Neumotórax a tensión
Evaluar la tórax distendido ipsilateral del hemitórax con disminución de los ruidos respiratorios e hipersonoridad a la percusión. Puede haber desviación traqueal hacia el hemitórax contralateral.[72]
Ver Neumotórax a tensión.
Evidencia: El shock séptico es la causa más común de shock
El shock séptico fue la causa más frecuente de shock en 1679 pacientes de la UCI en el ensayo European Sepsis Occurrence in Acutely Ill Patients II (SOAP II), que representó el 62% de los casos, seguido del shock cardiógeno (17%) y la hipovolemia (16%).[4]
El shock séptico tiene tasas de letalidad del 40% al 50%, llegando hasta el 80%.[73] Hay datos limitados sobre la epidemiología del shock séptico, particularmente en los países de bajos ingresos, pero su incidencia parece estar aumentando.[74][75][76] Entre el 6.3% y el 14.7% de los ingresos en la UCI son por shock séptico.[2][77]
El shock cardiógeno se ha estudiado con mayor frecuencia en el contexto de un infarto agudo de miocardio; la incidencia en esta población se mantiene bastante constante entre el 6% y el 9%.[9][10] En un estudio observacional multinacional de 65,119 pacientes hospitalizados por síndrome coronario agudo entre 1999 y 2007, el 4.6% desarrolló shock cardiógeno y la tasa de letalidad intrahospitalaria fue del 59.4%.[78] La anafilaxia rara vez es fatal y causa alrededor de 20 muertes al año en el Reino Unido.[79]
Ordenar siempre
Lactato (de la gasometría arterial)
Por lo general, >2 mmol/L (>18 mg/dL)si hay shock[1][2][3]
Realizar mediciones seriadas si el lactato es de >2 mmol/L (>18 mg/dL).
El nivel de lactato debe disminuir si el paciente está mejorando clínicamente.
La frecuencia de la repetición de las pruebas depende de la causa del shock y del tratamiento administrado.
Anteriormente se pensaba que el aumento del lactato sérico indicaba hipoperfusión tisular, disminución de la oxigenación tisular y metabolismo anaeróbico.[25] Más recientemente, esto se está desafiando con la opinión de que el lactato está elevado debido a la respuesta de estrés, ya que el metabolismo anaeróbico es un evento preterminal.[32]
Practical tip
Involucrar al personal de apoyo sénior si los niveles de lactato permanecen persistentemente >4 mmol/L (>36 mg/dL), ya que esto indica un alto riesgo de muerte.[25]
Evidencia: Medición del lactato
Utilice la medición en serie de lactato para guiar la reanimación.
Cinco ensayos aleatorizados controlados (647 pacientes) han evaluado la reanimación guiada por lactato de pacientes con shock séptico.[80][81][82][83][84] Mostraron una reducción significativa de la mortalidad en la reanimación guiada por lactato en comparación con la reanimación sin monitorización del lactato. Otros dos metanálisis de los 647 pacientes que se inscribieron en estos ensayos demostraron evidencia moderada de reducción de la mortalidad cuando se utilizó una estrategia de eliminación temprana de lactato, en comparación con la atención habitual o con el tratamiento guiado por la medición de ScvO 2 .[85][86]
La evidencia también ha demostrado el valor de las mediciones seriadas de lactato para predecir el pronóstico.
Un estudio prospectivo identificó a 76 pacientes con shock hipovolémico y mostró que los cambios en las concentraciones de lactato proporcionan una evaluación temprana y objetiva de la respuesta de un paciente a la terapia. Sugirió que las determinaciones repetidas de lactato representan un índice pronóstico confiable para pacientes con shock circulatorio.[87]
Otro estudio observacional en pacientes con shock secundario a traumatismo múltiple evaluó la correlación entre el aclaramiento de lactato y la supervivencia. Todos los pacientes en los que los niveles de lactato volvieron al rango normal (≤2 mmol/L [≤18 mg/dL]) en un plazo de 24 horas sobrevivieron. La supervivencia disminuyó al 77.8% si la normalización se produjo en un plazo de 48 horas y al 13.6% en aquellos pacientes en los que los niveles de lactato se elevaron por encima de 2 mmol / L [18 mg / dL] durante más de 48 horas.[88]
Gasometría venosa (VBG) o gasometría arterial (GSA)
Se utiliza para detectar acidosis metabólicas con un alto lactato y un exceso de base negativo, más frecuentemente presente en shock.[25][37]
VBG se usa cada vez más ya que es menos invasivo y doloroso.
La evidencia sugiere que el pH venoso tiene suficiente concordancia con el pH arterial para que sea una alternativa aceptable en la práctica clínica para la mayoría de los pacientes.
Evidencia: Déficit alcalino como marcador pronóstico
El déficit alcalino inicial en GSA es un buen factor pronóstico independiente de mortalidad en pacientes con shock hemorrágico.
Un estudio estratificó la extensión del déficit alcalino en tres categorías de leve (-3 a -5 mEq/L), moderado (-6 a -9 mEq/L) y grave (<-10 mEq/L) y encontró una correlación significativa entre el déficit alcalino al ingreso y los requerimientos de transfusiones o líquidos en las primeras 24 horas y el riesgo de disfunción orgánica o muerte.[89]
El déficit alcalino es un mejor marcador pronóstico de muerte que el pH en los análisis de gasometría arterial.[90]
Además, el déficit alcalino representa un marcador altamente sensible para el alcance del shock y la mortalidad, tanto en pacientes adultos como pediátricos.[91][92]
Glucosa
Puede aumentar debido a la respuesta de estrés iniciada debido al shock.[32]
Un nivel de glucosa >7 mmol/L (>126 mg/dL) es anormal en un paciente no diabético.
Puede aumentar en otras causas, como la cetoacidosis diabética.[33]
Evidencia: La hiperglucemia es una respuesta a una enfermedad crítica
La hiperglucemia por estrés y la resistencia a la insulina son respuestas preservadas evolutivamente que permiten al huésped sobrevivir durante períodos de estrés grave.[32]
En modelos animales de shock hemorrágico, la administración de solución de glucosa hipertónica aumentó el gasto cardíaco y la presión arterial, y mejoró la supervivencia.
En estos experimentos, dosis osmolares similares de solución salina o manitol, con mayores volúmenes de líquido acompañantes, no lograron producir los cambios sostenidos en la presión arterial ni mejorar la supervivencia.[93]
Hemograma completo
La hemoglobina (Hb) puede disminuir con sangrado agudo[39][94]
La Hb <100 g/L (<10 g/dL) sugiere hemorragia como causa; sin embargo, puede ser normal en las primeras etapas debido a la vasoconstricción.
Practical tip
La hemoglobina no disminuye inmediatamente en la pérdida de sangre aguda. Por lo tanto, no se tranquilice falsamente con una Hb normal, especialmente si la muestra de sangre se ha tomado temprano.
Los leucocitos pueden aumentar con cualquier causa de infección o inflamación.[24]
Puede ser de >12 x 10³/microlitro si hay sepsis.
Urea y electrolitos
Úselo para detectar:[95]
Evidencia de insuficiencia renal si la perfusión renal está comprometida.
La urea aumenta de manera desproporcionada con hemorragia digestiva alta, deshidratación o insuficiencia cardíaca.[48]
Hiperpotasemia en traumatismos, daño renal agudo, CAD e insuficiencia suprarrenal.
Hipopotasemia con diarrea o vómitos.
Hipernatremia en quemaduras y diarrea o vómitos.
Hiponatremia en traumatismos y también a veces en diarrea y vómitos.
Estudios de coagulación
Úselo como prueba inicial, especialmente antes de la inserción del catéter venoso central.[2]
También puede tener alteraciones en pacientes con traumatismos y es un factor pronóstico de mortalidad.[38]
También puede estar alterada en la coagulación intravascular diseminada secundaria a sepsis.
Evidencia: La coagulopatía es frecuente en pacientes traumatizados con shock
La incidencia de alteraciones de la coagulación, precoz después del traumatismo, es alta, y son factores pronósticos independientes de mortalidad incluso en presencia de otros factores de riesgo.
Un estudio recopiló prospectivamente datos sobre pacientes con traumatismos que acudieron a un centro de traumatología de nivel 1. Se realizó un análisis de regresión logística del tiempo de protrombina (TP), el tiempo de tromboplastina parcial (TTP), el recuento de plaquetas y los factores de confusión para determinar si la coagulopatía es un factor pronóstico de mortalidad por cualquier causa. Un TP anormal inicial aumentó las probabilidades ajustadas de morir en un 35% y un PTT anormal inicial aumentó las probabilidades ajustadas de morir en un 326%.[38]
proteína C-reactiva
Niveles altos de proteína C-reactiva (>1904.8 nanomol/L [>200 mg/L]) indican inflamación grave.
Cuanto más alto el nivel, mayor el grado de inflamación.
Concentraciones más bajas (<1904.8 nanomol/L [<200 mg/L]) se puede encontrar en estados sépticos pero también después de un infarto de miocardio o cirugía.
procalcitonina (PCT)
Los niveles elevados de procalcitonina (PCT) se han asociado con sepsis y pueden ayudar a diferenciar la sepsis de otras formas de reacciones inflamatorias sistémicas.[96][97] Los niveles elevados de PCT se asocian con una mortalidad por sepsis en el seguimiento a los 90 días. Otros estados proinflamatorios, como la pancreatitis aguda, los traumatismos, las cirugías mayores y las quemaduras, también pueden aumentar la procalcitonina.[98] Los cambios en los niveles de procalcitonina pueden producirse más tarde que los del lactato, aunque los cambios en ambos marcadores combinados son altamente predictivos del resultado entre 24 y 48 horas.[99]
electrocardiograma (ECG)
Puede mostrar evidencia de:[3][14][36][69]
Isquemia miocárdica en el shock cardiógeno
Tensión cardíaca derecha en la EP masiva
Alteraciones electrolíticas subyacentes (p. ej., hipopotasemia o hiperpotasemia).
Considere la posibilidad de repetir los ECG o la monitorización continua del trazado del ECG si el paciente se encuentra gravemente enfermo. Asegúrese de que todos los pacientes con shock cardiógeno tengan un monitoreo cardíaco continuo.[14]
Úselo para buscar la causa subyacente
Radiografía de tórax
No lo use para neumotórax a tensión : la descompresión urgente es la intervención de primera línea. Ver Neumotórax a tensión.
Cómo descomprimir un neumotórax a tensión. Demuestra la inserción de una cánula intravenosa de gran calibre en el cuarto espacio intercostal en un adulto.
Considerar específicamente:[24][103]
Consolidación en sepsis secundaria a neumonía
Derrame pleural en insuficiencia cardíaca aguda secundaria a infarto de miocardio
Neumotórax
Infarto pulmonar secundario a EP
Mediastino ensanchado con disección aórtica.
análisis de orina y prueba de embarazo en orina
Úselo para buscar signos de infección en la sospecha de sepsis.
Realizar en todas las mujeres en edad fértil para detectar embarazos ectópicos.
cribado de infección
Solicitar si sospecha infección, especialmente en sepsis.
Decida qué pruebas solicitar según la fuente de infección sospechosa. Las pruebas específicas incluyen:
Hemocultivos
Hisopos respiratorios para la reacción en cadena de la polimerasa
Muestras de esputo, orina, líquido cefalorraquídeo o heridas para microscopía, cultivo y sensibilidad.
Ecografía en el punto de atención
Solo debe ser realizado por un médico sénior con capacitación especializada en ecografía.
Siga un protocolo como Rapid Ultrasound in Shock (RUSH) para identificar la causa subyacente del shock evaluando lo siguiente.[104]
Pulmones: las líneas B sugieren edema pulmonar; el deslizamiento pulmonar sugiere neumotórax.
Vena cava inferior: la compresibilidad sugiere que el paciente necesita más líquido; la falta de compresibilidad sugiere que el paciente puede no responder a más líquido.
Aorta abdominal: aneurisma aórtico abdominal.
Abdomen: embarazo ectópico.
Usar la ecocardiografía para evaluar la función cardíaca en todos los pacientes con shock cardiogénico y shock indiferenciado.[14]
No hay ningún beneficio en solicitar un ecocardiograma en pacientes con shock hemorrágico, anafiláctico o neurogénico.
No usar de forma rutinaria en pacientes en los que la causa del shock es clara y que están respondiendo al tratamiento inicial.[2]
Se utiliza para:
Identificar la causa del shock si no está clara en la evaluación inicial
La insuficiencia ventricular izquierda sugiere infarto de miocardio; la tensión ventricular derecha sugiere EP; el derrame pericárdico sugiere un taponamiento cardíaco.
Seleccionar el tratamiento más adecuado
Úselo para evaluar el gasto cardíaco y el volumen sistólico para determinar si se necesitan inotrópicos.
Evaluar la respuesta al tratamiento
Uso para evaluar la respuesta a los líquidos: se define como un aumento del volumen sistólico del 10% al 15% después de que el paciente recibe 500 ml de cristaloide durante 10-15 minutos.
Utilice Focused Assessment with Sonography in Trauma (FAST) en pacientes con sospecha de traumatismo en el tórax, el abdomen o la pelvis para buscar líquido libre.[105]
Tomografía computarizada (TC) de tórax, abdomen y pelvis
Uso especial en pacientes con traumatismos importantes.[31]
Otras indicaciones pueden incluir sospecha de rotura de aneurisma aórtico o de una colección intra-abdominal.
Potencialmente inseguro en un paciente hemodinámicamente inestable. Los pacientes deben estar estables antes de ser trasladados a la sala de imágenes.
Angiografía pulmonar por tomografía computarizada (APTC)
Si sospecha una embolia pulmonar (EP), use APTC (si está indicado) junto con otras herramientas de evaluación adecuadas.[106][107]
APTC es la prueba diagnóstica preferida para la confirmación definitiva de EP; es adecuado usar APTC en la mayoría (pero no en todos) los pacientes.[106]
Ver Embolia pulmonar.
radiografía de los huesos largos
Se utiliza para detectar fracturas del fémur, que pueden causar shock debido a la pérdida de sangre, especialmente en pacientes mayores.
radiografía de la columna vertebral
Realizar donde exista sospecha de lesión medular en casos de shock neurogénico.
Cómo tomar una muestra de sangre venosa de la fosa antecubital utilizando una aguja de vacío.
Cómo registrar un ECG. Demuestra la colocación de electrodos torácicos y de extremidades.
Cómo obtener una muestra de sangre arterial de la arteria radial.
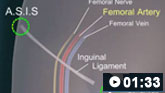
Cómo realizar una punción de la arteria femoral para recoger una muestra de sangre arterial.
El uso de este contenido está sujeto a nuestra cláusula de exención de responsabilidad