Pruebas diagnósticas
Primeras pruebas diagnósticas para solicitar
hemograma completo (HC) con diferencial
Prueba
La mayoría de los pacientes con leucemia mieloide aguda (LMA) o leucemia promielocítica aguda (LPA) tienen anemia, neutropenia y/o trombocitopenia, pero el hemograma puede variar mucho.
Un recuento de leucocitos elevado >100 × 10⁹/L (>100,000/microlitro; hiperleucocitosis) se produce en aproximadamente el 5% al 20% de los pacientes con LMA, predisponiéndoles a complicaciones como el síndrome de lisis tumoral, la afectación del sistema nervioso central y la leucostasia (hiperleucocitosis sintomática; los síntomas incluyen dificultad respiratoria y alteración del estado mental).[3][4] Se trata de emergencias médicas que requieren tratamiento inmediato. A pesar de la elevación en el recuento de leucocitos, muchos pacientes tienen neutropenia grave (recuento absoluto de neutrófilos [RAN] <0.5 × 10⁹/L [<500/microlitro]), lo que les pone en alto riesgo de infecciones graves.
Resultado
anemia, macrocitosis, leucocitosis, neutropenia y/o trombocitopenia
frotis de sangre periférica
Prueba
Los blastos son células inmaduras y normalmente no se observan en la sangre periférica.
La extensión de sangre en la leucemia mieloide aguda (LMA) puede mostrar blastos mieloides caracterizados por bastones de Auer o cuerpos Phi.
En la leucemia promielocítica aguda (LPA), la película de sangre mostrará por lo general promielocitos hipergranulares con núcleos bilobulados y haces de bastones de Auer (así como blastos mieloides).
Una variante de la LPA se caracteriza por promielocitos hipogranulares (ausencia de bastones de Auer), pero es menos frecuente.
[Figure caption and citation for the preceding image starts]: Extensión de sangre periférica de un paciente con leucemia promielocítica aguda que muestra promielocitos hipergranulares, algunos con paquetes de bastones de AuerDe la colección de los doctores K. Raj y P. Mehta; utilizado con el consentimiento del paciente [Citation ends].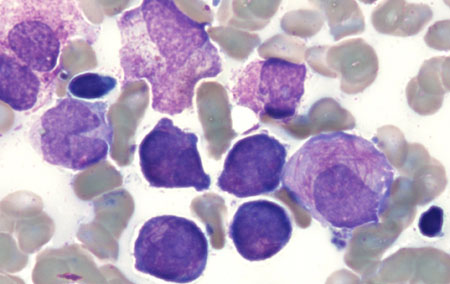 [Figure caption and citation for the preceding image starts]: Extensión de sangre periférica de un paciente con leucemia promielocítica aguda que muestra promielocitos hipergranulares con núcleos de dos lóbulos y paquetes de bastones de AuerDe la colección de los doctores K. Raj y P. Mehta; utilizado con el consentimiento del paciente [Citation ends].
[Figure caption and citation for the preceding image starts]: Extensión de sangre periférica de un paciente con leucemia promielocítica aguda que muestra promielocitos hipergranulares con núcleos de dos lóbulos y paquetes de bastones de AuerDe la colección de los doctores K. Raj y P. Mehta; utilizado con el consentimiento del paciente [Citation ends].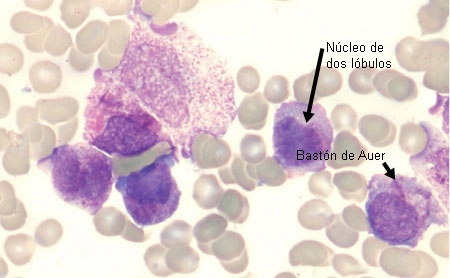 [Figure caption and citation for the preceding image starts]: Frotis de sangre periférica de un paciente con leucemia mieloide aguda con maduración que muestra blastos mieloides con un bastón de AuerDe la colección de los doctores K. Raj y P. Mehta; utilizado con el consentimiento del paciente [Citation ends].
[Figure caption and citation for the preceding image starts]: Frotis de sangre periférica de un paciente con leucemia mieloide aguda con maduración que muestra blastos mieloides con un bastón de AuerDe la colección de los doctores K. Raj y P. Mehta; utilizado con el consentimiento del paciente [Citation ends].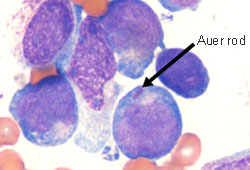
Resultado
blastos mieloides en la película de sangre; presencia de bastones de Auer o cuerpos Phi (en la LMA); presencia de promielocitos hipergranulares con núcleos bilobulados y haces de bastones de Auer, o promielocitos hipogranulares sin bastones de Auer (en LPMA)
perfil de coagulación
Prueba
Solicitada al inicio y controlada durante todo el tratamiento.
El tiempo de protrombina (TP) y el tiempo de tromboplastina parcial activada (TTP) pueden ser levemente prolongados con fibrinógeno y dímero D normales.
Si las pruebas de coagulación son anormales (TP y TTPa prolongados, disminución del fibrinógeno y/o dímero D elevado), debe sospecharse una coagulación intravascular diseminada (CID) y se justifica una derivación urgente para iniciar el tratamiento. Consulte el sistema de puntuación de la International Society on Thrombosis and Haemostasis (ISTH) para la coagulación intravascular diseminada (CID).[61]
La CID se produce con mayor frecuencia en la leucemia promielocítica aguda y es potencialmente mortal.[62]
Una disminución grave del fibrinógeno sugiere fibrinólisis primaria.
Resultado
TP, TTPa, fibrinógeno y/o dímero D pueden ser normales o anormales; si son anormales, debe sospecharse CID
electrolitos séricos
Prueba
Solicitada al inicio y controlada durante todo el tratamiento.
La hiperpotasemia, la hiperfosfatemia y la hipocalcemia (junto con hiperuricemia y elevación de la lactato deshidrogenasa sérica) pueden producirse debido al síndrome de lisis tumoral (SLT), especialmente durante el tratamiento y si el recuento de leucocitos (carga tumoral) es elevado. Esto puede provocar arritmias cardíacas, convulsiones, daño renal agudo y la muerte, si no se trata. El SLT es una emergencia oncológica.[60] Véase el apartado Síndrome de lisis tumoral.
La hipercalcemia puede deberse a una infiltración ósea o a la liberación ectópica de una sustancia similar a la hormona paratiroidea.
Resultado
el potasio y el fósforo séricos pueden estar elevados; el calcio sérico puede estar disminuido o elevado
ácido úrico sérico
Prueba
Solicitada al inicio y controlada durante todo el tratamiento.
La hiperuricemia (junto con hiperpotasemia, hiperfosfatemia, hipocalcemia y elevación de la lactato deshidrogenasa sérica) puede producirse debido al síndrome de lisis tumoral (SLT), especialmente durante el tratamiento y si el recuento de leucocitos (carga tumoral) es elevado. Esto puede provocar arritmias cardíacas, convulsiones, daño renal agudo y la muerte, si no se trata. El SLT es una emergencia oncológica.[60] Véase el apartado Síndrome de lisis tumoral.
El grado de elevación del ácido úrico puede reflejar la extensión de la carga de la enfermedad y es útil para el pronóstico.[65]
Resultado
puede estar elevada
lactato deshidrogenasa (LDH) sérica
Prueba
Solicitada al inicio y controlada durante todo el tratamiento.
Puede producirse una elevación de la LDH sérica (junto con hiperpotasemia, hiperfosfatemia, hiperuricemia e hipocalcemia) debido al síndrome de lisis tumoral (SLT), especialmente durante el tratamiento y si el recuento de leucocitos (carga tumoral) es elevado. Esto puede provocar arritmias cardíacas, convulsiones, daño renal agudo y la muerte, si no se trata. El SLT es una emergencia oncológica.[60] Véase el apartado Síndrome de lisis tumoral.
El grado de elevación de la LDH puede reflejar la extensión de la carga de la enfermedad y es útil para el pronóstico.[66]
Resultado
puede estar elevada
función renal
Prueba
Solicitada al inicio y controlada durante todo el tratamiento.
Incluye medición de urea y creatinina.
Daño renal agudo puede producirse si se desarrolla el síndrome de lisis tumoral (SLT). El SLT es una emergencia oncológica.[60] Véase el apartado Síndrome de lisis tumoral.
Resultado
puede ser anormal si hay disfunción renal
pruebas de función hepática
Prueba
Solicitada al inicio y controlada durante todo el tratamiento.
Incluye la medición de la bilirrubina total, la albúmina, la alanina aminotransferasa (ALT) y la aspartato aminotransferasa (AST).
Resultado
puede ser anormal si hay disfunción hepática
evaluación de la médula ósea
Prueba
El diagnóstico requiere aspirado de médula ósea y análisis de biopsia por trépano.[27][45]
La evaluación citomorfológica demuestra hipercelularidad de la médula ósea e infiltración por blastocitos mieloides en la LMA (así como promielocitos hipergranulares o hipogranulares [menos frecuentes] en la leucemia promielocítica aguda [LPA]). Las células blásticas mieloides son negativas para la desoxinucleotidil transferasa terminal (TdT) y se tiñen de forma positiva para la mieloperoxidasa.
El inmunofenotipado mediante citometría de flujo (en aspirado de médula ósea) e inmunohistoquímica (mediante muestra de biopsia con aguja gruesa) identifica marcadores de superficie celular y citoplasmáticos de blastos mieloides (p. ej., CD34, CD33) y establece el linaje.
La confirmación de un origen mieloide de las células leucémicas mediante inmunofenotipado es esencial para diferenciar la leucemia mieloide aguda (LMA) y la leucemia linfoblástica aguda (LLA), ya que a menudo son clínicamente indistinguibles.
Si las muestras de médula ósea son inadecuadas o imposibles de obtener, puede utilizarse sangre periférica para la evaluación patológica siempre que haya un número suficiente de blastos circulantes.[63]
Resultado
hipercelularidad de la médula ósea e infiltración por blastocitos mieloides; presencia de bastones de Auer o cuerpos Phi (en la LMA); presencia de promielocitos hipergranulares con núcleos bilobulados y haces de bastones de Auer, o promielocitos hipogranulares sin bastones de Auer (en la LPMA); positivo para marcadores citoplasmáticos y de superficie celular para blastocitos mieloides (por ejemplo, CD34, CD33, mieloperoxidasa); negativo para TdT
pruebas genéticas
Prueba
El análisis citogenético (cariotipo, hibridación in situ fluorescente [FISH] o secuenciación del genoma completo) y las pruebas genéticas moleculares (por ejemplo, reacción en cadena de la polimerasa [PCR], ensayos de secuenciación de próxima generación [NGS]) se deben realizar en muestras de médula ósea (o sangre periférica si hay blastocitos circulantes) para orientar el diagnóstico, el pronóstico, la estratificación del riesgo y el tratamiento.[27][45]
En la leucemia mieloide aguda (LMA), se deben investigar las siguientes alteraciones genéticas debido a su relación con pronósticos específicos y objetivos de tratamiento: RUNX1::RUNX1T1; CBFB::MYH11; MLLT3::KMT2A (u otros reordenamientos de KMT2A); DEK::NUP214; BCR::ABL1; KAT6A::CREBBP; KIT; MNP1; FLT3 (ITD y TKD); IDH1; IDH2; CEBPA (dominio básico de cremallera de leucina [bZIP]); -5 o del(5q); -7; -17/ABN(17P); GATA2; MECOM (EVI1); ASXL1; BCOR; EZH2; RUNX1; SF3B1; SRSF2; STAG2; U2AF1; ZRSR2; y TP53.[27][45] Véase el apartado Criterios.
La leucemia promielocítica aguda (LPMA, un subtipo de LMA) se caracteriza por el gen de fusión PML::RARA causado por un reordenamiento cromosómico equilibrado t(15; 17) (q 22; q12).[27][44]
Resultado
puede identificar alteraciones genéticas definitorias de LMA
Pruebas diagnósticas que deben considerarse
pruebas genéticas para el síndrome de predisposición hereditaria a neoplasias malignas hematológicas
Prueba
Se debe considerar para determinados pacientes, como los de <50 años de edad y aquellos con antecedentes familiares de un trastorno hematológico hereditario.[27][45]
Los hallazgos pueden orientar el tratamiento.
Resultado
pueden identificar un síndrome de predisposición hereditaria a neoplasias malignas hematológicas (p. ej., síndrome de deficiencia de GATA2, síndrome de Shwachman-Diamond, disqueratosis congénita)
tipificación del antígeno leucocitario humano (HLA)
Prueba
Se solicita evaluar y emparejar a un donante adecuado para un trasplante de células madre alogénico.[45]
Resultado
variable
Estudios por imágenes del SNC y punción lumbar
Prueba
Se deben realizar estudios por imágenes del SNC (p. ej., IRM o TC del cerebro) para detectar sangrado del SNC, enfermedad meníngea o lesiones masivas en pacientes que presentan signos o síntomas neurológicos que sugieren afectación del SNC.[27][45]
Si los estudios por imágenes del SNC no identifican sangrado o un efecto de masa, y los signos y síntomas neurológicos persisten, se recomienda la punción lumbar.[45]
Se puede considerar una dosis de quimioterapia intratecal (p. ej., metotrexato o citarabina, o una combinación de ambos fármacos) en el momento de la punción lumbar diagnóstica.[45]
La coagulopatía debe tratarse antes de la punción lumbar, especialmente en pacientes con leucemia promielocítica aguda.
Resultado
Las imágenes del SNC pueden mostrar sangrado intracraneal, enfermedad leptomeníngea, lesión masiva; la punción lumbar puede detectar células malignas
exploración TEP-FDG/TC
Prueba
Se debe considerar en pacientes con sospecha de enfermedad extramedular.[45]
Resultado
puede mostrar lesiones extramedulares
radiografía de tórax
Prueba
Puede realizarse para identificar neumonía, masas mediastínicas, infiltrados pulmonares o cardiomegalia.
Resultado
puede mostrar evidencia de neumonía, masas mediastínicas, infiltrados pulmonares, cardiomegalia
ecocardiograma
ventriculografía con radionúclidos
tipificación del antígeno leucocitario humano (HLA)
Prueba
Se solicita evaluar y emparejar a un donante adecuado para un trasplante de células madre alogénico.[45]
Resultado
variable
El uso de este contenido está sujeto a nuestra cláusula de exención de responsabilidad