Nipocalimab aprobado por la FDA para el tratamiento de la miastenia grave generalizada
Nipocalimab, un anticuerpo monoclonal antagonista neonatal del receptor Fc (FcRn), ha sido aprobado por la Administración de Medicamentos y Alimentos de EE. UU. (FDA) para el tratamiento de la miastenia grave generalizada en adultos y niños ≥12 años que son positivos para anticuerpos contra el receptor de acetilcolina (AChR) o la tirosina quinasa específica del músculo (MuSK). La aprobación sigue a la designación de revisión prioritaria de la FDA y proporciona una opción de tratamiento alternativa para ofrecer un control sostenido de la enfermedad para una amplia gama de pacientes con síntomas molestos causados por la miastenia grave.
La aprobación se basó en los resultados de Vivacity-MG3, un ensayo de fase 3 de pacientes con miastenia grave generalizada inadecuadamente controlada con la terapia estándar. El nipocalimab agregado a la atención estándar se asoció con reducciones duraderas en los anticuerpos IgG y AChR circulantes totales, y mejoras en los resultados informados por los pacientes, con un buen perfil de seguridad.
Resumen
Definición
Anamnesis y examen
Principales factores de diagnóstico
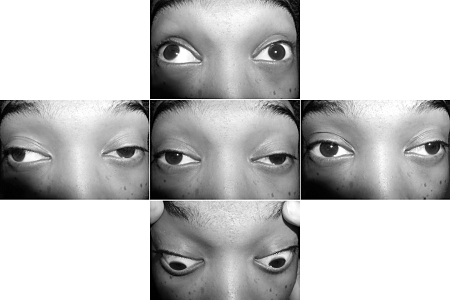
- fuerza muscular fatiga
- ptosis
- diplopía
- disfagia
- disartría
- paresia facial
- debilidad en las extremidades proximales
- disnea
Factores de riesgo
- antecedentes familiares de trastornos autoinmunes
- marcadores genéticos
- tratamiento dirigido contra el cáncer
Pruebas diagnósticas
Primeras pruebas diagnósticas para solicitar
- análisis sérico de anticuerpos frente a los receptores de acetilcolina (AChR)
- anticuerpos frente a la tirosina cinasa específica del músculo (MuSK)
- pruebas funcionales respiratorias en serie
Pruebas diagnósticas que deben considerarse
- ensayos de anticuerpos contra el receptor estriado
- estimulación nerviosa repetitiva
- electromiograma (EMG) de fibra aislada
- tomografía computarizada (TC) de tórax
Algoritmo de tratamiento
Colaboradores
Autores
David P. Richman, MD
Distinguished Professor
Professor of Neurology
University of California - Davis
Davis
CA
Divulgaciones
DPR declares that he has no competing interests.
Agradecimientos
Dr David Richman would like to gratefully acknowledge Dr Robert Lisak, Dr Andrea Corse, and Dr Ami Mankodi, previous contributors to this topic.
Divulgaciones
AC and AM declare that they have no competing interests. RPL is a Data and Safety Monitoring Board Member for the COUR myasthenia gravis clinical trial. RPL is a site principal investigator for clinical trials and a co-author for the clinical trial reports for myasthenia gravis therapies for Alexion, Argenx, and UCB Ra. RPL's institution receives payment for the time spent on these clinical trials. RPL has received book royalties from Oxford University Press and Blackstone, and has carried out consultancy work for Avilar.
Revisores por pares
Vern C. Juel, MD
Associate Professor of Medicine (Neurology)
Duke University
Durham
NC
Divulgaciones
VCJ declares that he has no competing interests.
Agradecimiento de los revisores por pares
Los temas de BMJ Best Practice se actualizan de forma continua de acuerdo con los desarrollos en la evidencia y en las guías. Los revisores por pares listados aquí han revisado el contenido al menos una vez durante la historia del tema.
Divulgaciones
Las afiliaciones y divulgaciones de los revisores por pares se refieren al momento de la revisión.
Referencias
Artículos principales
Narayanaswami P, Sanders DB, Wolfe G, et al. International consensus guidance for management of myasthenia gravis: 2020 update. Neurology. 2021 Jan 19;96(3):114-22.Texto completo Resumen
Skeie GO, Apostolski S, Evoli A, et al. Guidelines for treatment of autoimmune neuromuscular transmission disorders. Eur J Neurol. 2010 Jul;17(7):893-902.Texto completo Resumen
Gronseth GS, Barohn R, Narayanaswami P. Practice advisory: thymectomy for myasthenia gravis (practice parameter update). Report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology. Neurology. 2020 Apr 21;94(16):705-9.Texto completo Resumen
Elovaara I, Apostolski S, van Doorn P, et al. EFNS guidelines for the use of intravenous immunoglobulin in treatment of neurological diseases: EFNS task force on the use of intravenous immunoglobulin in treatment of neurological diseases. Eur J Neurol. 2008 Sep;15(9):893-908.Texto completo Resumen
Artículos de referencia
Una lista completa de las fuentes a las que se hace referencia en este tema está disponible aquí.
El uso de este contenido está sujeto a nuestra cláusula de exención de responsabilidad