Apresentação inicial
A corticoterapia é considerada a principal terapia e é o tratamento inicial administrado a todos os pacientes, a menos que haja contraindicação.[3]Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 clinical practice guideline for the management of glomerular diseases. Kidney Int. 2021 Oct;100(4s):S1-276.
https://www.kidney-international.org/article/S0085-2538(21)00562-7/fulltext
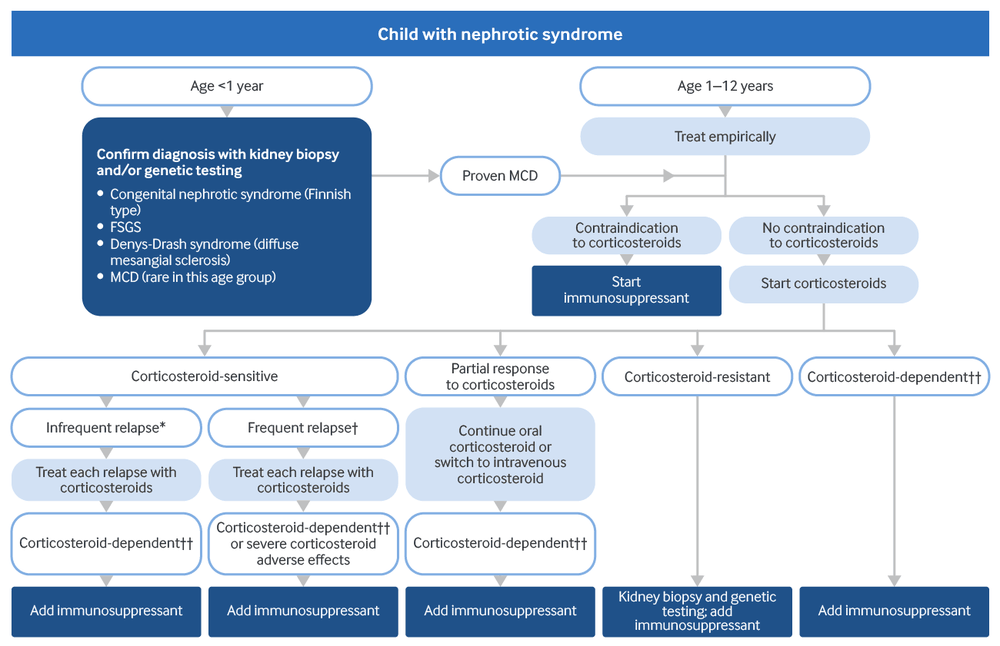
Uma criança com SN tem chance de 85% a 90% de alcançar a remissão completa da proteinúria em 4-6 semanas de corticoterapia (síndrome nefrótica sensível a corticosteroide ou SNSC).[2]Trautmann A, Boyer O, Hodson E, et al. IPNA clinical practice recommendations for the diagnosis and management of children with steroid-sensitive nephrotic syndrome. Pediatr Nephrol. 2023 Mar;38(3):877-919.
https://link.springer.com/article/10.1007/s00467-022-05739-3
http://www.ncbi.nlm.nih.gov/pubmed/36269406?tool=bestpractice.com
Em adultos com DLM, a resposta aos corticosteroides pode demorar muito mais do que em crianças.[25]Hogan J, Radhakrishnan J. The treatment of minimal change disease in adults. J Am Soc Nephrol. 2013 Apr;24(5):702-11.
http://www.ncbi.nlm.nih.gov/pubmed/23431071?tool=bestpractice.com
[27]Azukaitis K, Palmer SC, Strippoli GF, et al. Interventions for minimal change disease in adults with nephrotic syndrome. Cochrane Database Syst Rev. 2022 Mar 1;3(3):CD001537.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001537.pub5/full
http://www.ncbi.nlm.nih.gov/pubmed/35230699?tool=bestpractice.com
Graças aos esforços do International Study of Kidney Disease in Children (ISKDC), os principais ensaios clínicos da década de 1970 definiram a função inicial da corticoterapia na doença de lesão mínima (DLM).[20]International Study of Kidney Disease in Children. Nephrotic syndrome in children: prediction of histopathology from clinical and laboratory characteristics at time of diagnosis. A report of the International Study of Kidney Disease in Children. Kidney Int. 1978;13:159-65.
http://www.ncbi.nlm.nih.gov/pubmed/713276?tool=bestpractice.com
Embora a abordagem terapêutica inicial tenha permanecido amplamente inalterada, a duração do tratamento com corticosteroide em crianças no início da SN é debatida. Nos EUA, o programa de iniciativa de qualidade da National Kidney Foundation recomenda flexibilidade na duração do ciclo de tratamento inicial com corticosteroides (8 ou 12 semanas), dependendo da resposta da criança e das características clínicas.[28]Beck LH Jr, Ayoub I, Caster D, et al. KDOQI US commentary on the 2021 KDIGO clinical practice guideline for the management of glomerular diseases. Am J Kidney Dis. 2023 Aug;82(2):121-75.
https://www.ajkd.org/article/S0272-6386(23)00591-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/37341661?tool=bestpractice.com
As diretrizes da Kidney Disease Improving Global Outcomes (KDIGO) fazem uma recomendação similar.[3]Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 clinical practice guideline for the management of glomerular diseases. Kidney Int. 2021 Oct;100(4s):S1-276.
https://www.kidney-international.org/article/S0085-2538(21)00562-7/fulltext
Uma metanálise concluiu que o esquema de 8 semanas para o primeiro episódio de SNSC pode não ser tão eficaz quanto o esquema de 12 semanas.[29]Schijvens AM, Teeninga N, Dorresteijn EM, et al. Steroid treatment for the first episode of childhood nephrotic syndrome: comparison of the 8 and 12 weeks regimen using an individual patient data meta-analysis. Eur J Pediatr. 2021 Sep;180(9):2849-59.
https://link.springer.com/article/10.1007/s00431-021-04035-w
http://www.ncbi.nlm.nih.gov/pubmed/33774744?tool=bestpractice.com
Em um estudo realizado no Reino Unido, os desfechos clínicos não melhoraram quando o ciclo inicial do tratamento com corticosteroide foi estendido de 8 para 16 semanas em crianças com SNSC. No entanto, o ciclo de tratamento estendido foi associado ao aumento da qualidade de vida.[30]Webb NJA, Woolley RL, Lambe T, et al. Long term tapering versus standard prednisolone treatment for first episode of childhood nephrotic syndrome: phase III randomised controlled trial and economic evaluation. BMJ. 2019 May 23;365:l1800.
https://www.bmj.com/content/365/bmj.l1800
http://www.ncbi.nlm.nih.gov/pubmed/31335316?tool=bestpractice.com
Uma revisão Cochrane concluiu que não há benefício em prolongar a corticoterapia em crianças por mais de 2-3 meses no primeiro episódio de SNSC.[31]Hahn D, Samuel SM, Willis NS, et al. Corticosteroid therapy for nephrotic syndrome in children. Cochrane Database Syst Rev. 2024 Aug 22;8(8):CD001533.
http://www.ncbi.nlm.nih.gov/pubmed/39171624?tool=bestpractice.com
[  ]
For children with a first episode of steroid‐sensitive nephrotic syndrome (SSNS), how do different durations of corticosteroid treatment compare?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4565/fullMostre-me a resposta Nos adultos, o tratamento com corticosteroide em altas doses para a DLM deve ser administrado por, no máximo, 16 semanas.[3]Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 clinical practice guideline for the management of glomerular diseases. Kidney Int. 2021 Oct;100(4s):S1-276.
https://www.kidney-international.org/article/S0085-2538(21)00562-7/fulltext
]
For children with a first episode of steroid‐sensitive nephrotic syndrome (SSNS), how do different durations of corticosteroid treatment compare?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4565/fullMostre-me a resposta Nos adultos, o tratamento com corticosteroide em altas doses para a DLM deve ser administrado por, no máximo, 16 semanas.[3]Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 clinical practice guideline for the management of glomerular diseases. Kidney Int. 2021 Oct;100(4s):S1-276.
https://www.kidney-international.org/article/S0085-2538(21)00562-7/fulltext
Em pacientes com contraindicação a corticosteroides, um imunossupressor pode ser administrado para a terapia inicial, como ciclofosfamida ou um inibidor de calcineurina (por exemplo, ciclosporina, tacrolimo).[3]Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 clinical practice guideline for the management of glomerular diseases. Kidney Int. 2021 Oct;100(4s):S1-276.
https://www.kidney-international.org/article/S0085-2538(21)00562-7/fulltext
Em crianças, a SN será considerada resistente aos corticosteroides (SNSC) se não houver resposta completa em 4 semanas de tratamento.[3]Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 clinical practice guideline for the management of glomerular diseases. Kidney Int. 2021 Oct;100(4s):S1-276.
https://www.kidney-international.org/article/S0085-2538(21)00562-7/fulltext
Caso seja observada remissão parcial, pode-se considerar a continuação do corticosteroide oral ou a troca para um corticosteroide intravenoso em doses altas por mais 2 semanas, pois alguns pacientes podem apresentar resposta tardia.[3]Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 clinical practice guideline for the management of glomerular diseases. Kidney Int. 2021 Oct;100(4s):S1-276.
https://www.kidney-international.org/article/S0085-2538(21)00562-7/fulltext
[32]Trautmann A, Vivarelli M, Samuel S, et al. IPNA clinical practice recommendations for the diagnosis and management of children with steroid-resistant nephrotic syndrome. Pediatr Nephrol. 2020 Aug;35(8):1529-61.
https://link.springer.com/article/10.1007/s00467-020-04519-1
http://www.ncbi.nlm.nih.gov/pubmed/32382828?tool=bestpractice.com
SNRE é uma indicação para biópsia renal.[3]Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 clinical practice guideline for the management of glomerular diseases. Kidney Int. 2021 Oct;100(4s):S1-276.
https://www.kidney-international.org/article/S0085-2538(21)00562-7/fulltext
[32]Trautmann A, Vivarelli M, Samuel S, et al. IPNA clinical practice recommendations for the diagnosis and management of children with steroid-resistant nephrotic syndrome. Pediatr Nephrol. 2020 Aug;35(8):1529-61.
https://link.springer.com/article/10.1007/s00467-020-04519-1
http://www.ncbi.nlm.nih.gov/pubmed/32382828?tool=bestpractice.com
É recomendável realizar teste genético para uma causa monogênica de SN, pois a imunossupressão pode não ser benéfica em alguns desses casos.[3]Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 clinical practice guideline for the management of glomerular diseases. Kidney Int. 2021 Oct;100(4s):S1-276.
https://www.kidney-international.org/article/S0085-2538(21)00562-7/fulltext
[28]Beck LH Jr, Ayoub I, Caster D, et al. KDOQI US commentary on the 2021 KDIGO clinical practice guideline for the management of glomerular diseases. Am J Kidney Dis. 2023 Aug;82(2):121-75.
https://www.ajkd.org/article/S0272-6386(23)00591-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/37341661?tool=bestpractice.com
O tratamento da SNRE em crianças melhorou na última década, mas continua sendo desafiador. A maioria dos pacientes não permanece livre de proteinúria e pode mostrar danos renais progressivos. Em crianças com uma forma não genética de SN, o tratamento com um inibidor de calcineurina aumenta as taxas de remissão.[3]Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 clinical practice guideline for the management of glomerular diseases. Kidney Int. 2021 Oct;100(4s):S1-276.
https://www.kidney-international.org/article/S0085-2538(21)00562-7/fulltext
[32]Trautmann A, Vivarelli M, Samuel S, et al. IPNA clinical practice recommendations for the diagnosis and management of children with steroid-resistant nephrotic syndrome. Pediatr Nephrol. 2020 Aug;35(8):1529-61.
https://link.springer.com/article/10.1007/s00467-020-04519-1
http://www.ncbi.nlm.nih.gov/pubmed/32382828?tool=bestpractice.com
[33]Liu ID, Willis NS, Craig JC, et al. Interventions for idiopathic steroid-resistant nephrotic syndrome in children. Cochrane Database Syst Rev. 2019 Nov 21;2019(11):CD003594.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD003594.pub6/full
http://www.ncbi.nlm.nih.gov/pubmed/31749142?tool=bestpractice.com
Se a avaliação genética e/ou histopatológica não estiver disponível, o tratamento imunossupressor imediato com um inibidor de calcineurina pode ser iniciado.[32]Trautmann A, Vivarelli M, Samuel S, et al. IPNA clinical practice recommendations for the diagnosis and management of children with steroid-resistant nephrotic syndrome. Pediatr Nephrol. 2020 Aug;35(8):1529-61.
https://link.springer.com/article/10.1007/s00467-020-04519-1
http://www.ncbi.nlm.nih.gov/pubmed/32382828?tool=bestpractice.com
Se não houver inibidores de calcineurina disponíveis, a ciclofosfamida pode ser usada.[32]Trautmann A, Vivarelli M, Samuel S, et al. IPNA clinical practice recommendations for the diagnosis and management of children with steroid-resistant nephrotic syndrome. Pediatr Nephrol. 2020 Aug;35(8):1529-61.
https://link.springer.com/article/10.1007/s00467-020-04519-1
http://www.ncbi.nlm.nih.gov/pubmed/32382828?tool=bestpractice.com
A maioria dos estudos publicados sobre SNRE é com crianças, mas, na prática, o tratamento de SNRE é similar para adultos. Em adultos com DLM, apenas 50% apresentam resposta ao tratamento com corticosteroide em 4 semanas, e 80% alcançam a remissão em 16 semanas.[25]Hogan J, Radhakrishnan J. The treatment of minimal change disease in adults. J Am Soc Nephrol. 2013 Apr;24(5):702-11.
http://www.ncbi.nlm.nih.gov/pubmed/23431071?tool=bestpractice.com
Entre 10% e 20% dos adultos com DLM são resistentes a corticosteroide (definidos como ausência de resposta ao tratamento com corticosteroide por 16 semanas).[1]Vivarelli M, Massella L, Ruggiero B, et al. Minimal change disease. Clin J Am Soc Nephrol. 2017 Feb 7;12(2):332-45.
https://cjasn.asnjournals.org/content/12/2/332.long
http://www.ncbi.nlm.nih.gov/pubmed/27940460?tool=bestpractice.com
[3]Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 clinical practice guideline for the management of glomerular diseases. Kidney Int. 2021 Oct;100(4s):S1-276.
https://www.kidney-international.org/article/S0085-2538(21)00562-7/fulltext
É provável que a repetição da biópsia mostre lesões de glomeruloesclerose segmentar focal, o que reflete uma mudança patológica no ciclo da doença.[1]Vivarelli M, Massella L, Ruggiero B, et al. Minimal change disease. Clin J Am Soc Nephrol. 2017 Feb 7;12(2):332-45.
https://cjasn.asnjournals.org/content/12/2/332.long
http://www.ncbi.nlm.nih.gov/pubmed/27940460?tool=bestpractice.com
[3]Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 clinical practice guideline for the management of glomerular diseases. Kidney Int. 2021 Oct;100(4s):S1-276.
https://www.kidney-international.org/article/S0085-2538(21)00562-7/fulltext
[25]Hogan J, Radhakrishnan J. The treatment of minimal change disease in adults. J Am Soc Nephrol. 2013 Apr;24(5):702-11.
http://www.ncbi.nlm.nih.gov/pubmed/23431071?tool=bestpractice.com
Consulte Glomeruloesclerose segmentar focal.
Para minimizar o risco de osteoporose, assegure a ingestão adequada de cálcio alimentar, ou inicie a suplementação de cálcio naqueles com ingestão inadequada, em todas as crianças tratadas com corticosteroides.[2]Trautmann A, Boyer O, Hodson E, et al. IPNA clinical practice recommendations for the diagnosis and management of children with steroid-sensitive nephrotic syndrome. Pediatr Nephrol. 2023 Mar;38(3):877-919.
https://link.springer.com/article/10.1007/s00467-022-05739-3
http://www.ncbi.nlm.nih.gov/pubmed/36269406?tool=bestpractice.com
Os níveis de vitamina D devem ser avaliados em pacientes com SN frequentemente recidivante ou dependente de corticosteroide e suplementação orientada pelo nível sérico.[2]Trautmann A, Boyer O, Hodson E, et al. IPNA clinical practice recommendations for the diagnosis and management of children with steroid-sensitive nephrotic syndrome. Pediatr Nephrol. 2023 Mar;38(3):877-919.
https://link.springer.com/article/10.1007/s00467-022-05739-3
http://www.ncbi.nlm.nih.gov/pubmed/36269406?tool=bestpractice.com
[3]Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 clinical practice guideline for the management of glomerular diseases. Kidney Int. 2021 Oct;100(4s):S1-276.
https://www.kidney-international.org/article/S0085-2538(21)00562-7/fulltext
Recidiva
Recidiva é o reaparecimento da proteinúria na faixa nefrótica; em crianças, isso é definido como uma tira reagente ≥ 3+ por 3 dias consecutivos.[3]Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 clinical practice guideline for the management of glomerular diseases. Kidney Int. 2021 Oct;100(4s):S1-276.
https://www.kidney-international.org/article/S0085-2538(21)00562-7/fulltext
Aproximadamente 70% a 80% das crianças com SNSC terão pelo menos uma recidiva, e até 50% terão recidivas frequentes ou se tornarão dependentes de corticosteroide para manter a remissão.[2]Trautmann A, Boyer O, Hodson E, et al. IPNA clinical practice recommendations for the diagnosis and management of children with steroid-sensitive nephrotic syndrome. Pediatr Nephrol. 2023 Mar;38(3):877-919.
https://link.springer.com/article/10.1007/s00467-022-05739-3
http://www.ncbi.nlm.nih.gov/pubmed/36269406?tool=bestpractice.com
Recidivas infrequentes (<2 recidivas por 6 meses até 6 meses após o início da doença ou <4 recidivas por 12 meses em qualquer período de 12 meses subsequente) podem ser tratadas com corticosteroides em crianças e adultos.[3]Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 clinical practice guideline for the management of glomerular diseases. Kidney Int. 2021 Oct;100(4s):S1-276.
https://www.kidney-international.org/article/S0085-2538(21)00562-7/fulltext
Os pacientes com diagnóstico recente que apresentam recidiva recebem o mesmo tratamento da manifestação inicial, mas passam a tomar uma dose menor de corticosteroide quando a urina fica livre de proteínas por 3 dias. A dose do medicamento é reduzida ou mantida por 4 semanas ou mais, dependendo da história de recidivas do paciente e da incidência de efeitos adversos dos corticosteroides.
Em crianças com SNSC que, subsequentemente, não apresentam resposta a corticosteroides, a biópsia renal é indicada.[3]Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 clinical practice guideline for the management of glomerular diseases. Kidney Int. 2021 Oct;100(4s):S1-276.
https://www.kidney-international.org/article/S0085-2538(21)00562-7/fulltext
A terapia poupadora de corticosteroide é recomendada para:[3]Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 clinical practice guideline for the management of glomerular diseases. Kidney Int. 2021 Oct;100(4s):S1-276.
https://www.kidney-international.org/article/S0085-2538(21)00562-7/fulltext
[28]Beck LH Jr, Ayoub I, Caster D, et al. KDOQI US commentary on the 2021 KDIGO clinical practice guideline for the management of glomerular diseases. Am J Kidney Dis. 2023 Aug;82(2):121-75.
https://www.ajkd.org/article/S0272-6386(23)00591-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/37341661?tool=bestpractice.com
pacientes com SN frequentemente recidivante (≥2 recidivas por 6 meses até 6 meses após o início da doença ou ≥4 recidivas por 12 meses em qualquer período subsequente de 12 meses) que desenvolvem efeitos adversos graves associados ao corticosteroide (por exemplo, deficit de crescimento, ganho de peso significativo, hipertensão, diabetes, osteoporose, preocupações comportamentais ou catarata)
pacientes dependentes de corticosteroide (as recidivas ocorrem durante a retirada gradual do corticosteroide ou até 2 semanas após a descontinuação do corticosteroide).
Idealmente, os agentes poupadores de corticosteroide são iniciados enquanto o paciente está em remissão com tratamento com corticosteroide e incluem as seguintes opções: ciclofosfamida, micofenolato, rituximabe ou um inibidor de calcineurina.[2]Trautmann A, Boyer O, Hodson E, et al. IPNA clinical practice recommendations for the diagnosis and management of children with steroid-sensitive nephrotic syndrome. Pediatr Nephrol. 2023 Mar;38(3):877-919.
https://link.springer.com/article/10.1007/s00467-022-05739-3
http://www.ncbi.nlm.nih.gov/pubmed/36269406?tool=bestpractice.com
[3]Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 clinical practice guideline for the management of glomerular diseases. Kidney Int. 2021 Oct;100(4s):S1-276.
https://www.kidney-international.org/article/S0085-2538(21)00562-7/fulltext
Não há eficácia clara de um agente em relação a outro, e a decisão de uso baseia-se em questões como recursos, adesão, perfil de efeitos adversos e preferências do paciente.[3]Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 clinical practice guideline for the management of glomerular diseases. Kidney Int. 2021 Oct;100(4s):S1-276.
https://www.kidney-international.org/article/S0085-2538(21)00562-7/fulltext
[27]Azukaitis K, Palmer SC, Strippoli GF, et al. Interventions for minimal change disease in adults with nephrotic syndrome. Cochrane Database Syst Rev. 2022 Mar 1;3(3):CD001537.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001537.pub5/full
http://www.ncbi.nlm.nih.gov/pubmed/35230699?tool=bestpractice.com
[28]Beck LH Jr, Ayoub I, Caster D, et al. KDOQI US commentary on the 2021 KDIGO clinical practice guideline for the management of glomerular diseases. Am J Kidney Dis. 2023 Aug;82(2):121-75.
https://www.ajkd.org/article/S0272-6386(23)00591-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/37341661?tool=bestpractice.com
[34]Larkins NG, Liu ID, Willis NS, et al. Non-corticosteroid immunosuppressive medications for steroid-sensitive nephrotic syndrome in children. Cochrane Database Syst Rev. 2020 Apr 16;4(4):CD002290.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002290.pub5/full
http://www.ncbi.nlm.nih.gov/pubmed/32297308?tool=bestpractice.com
Depois que os pacientes iniciam o agente poupador de corticosteroide, normalmente o corticosteroide é retirado gradualmente e suprimido, ou retirado gradualmente até a menor dose possível.
As diretrizes da KDIGO também recomendam levamisol (um agente anti-helmíntico) como opção poupadora de corticosteroide; no entanto, esse medicamento foi retirado em alguns países (inclusive nos EUA) devido a preocupações relativas a efeitos adversos graves, mas ainda pode estar disponível em outros lugares.[3]Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 clinical practice guideline for the management of glomerular diseases. Kidney Int. 2021 Oct;100(4s):S1-276.
https://www.kidney-international.org/article/S0085-2538(21)00562-7/fulltext
Tratamento do edema
A base do tratamento do edema inclui uma dieta com baixo teor de sal e avaliação do estado fluídico do paciente, com restrição de ingestão de líquidos se estiver com excesso de líquidos.[1]Vivarelli M, Massella L, Ruggiero B, et al. Minimal change disease. Clin J Am Soc Nephrol. 2017 Feb 7;12(2):332-45.
https://cjasn.asnjournals.org/content/12/2/332.long
http://www.ncbi.nlm.nih.gov/pubmed/27940460?tool=bestpractice.com
[2]Trautmann A, Boyer O, Hodson E, et al. IPNA clinical practice recommendations for the diagnosis and management of children with steroid-sensitive nephrotic syndrome. Pediatr Nephrol. 2023 Mar;38(3):877-919.
https://link.springer.com/article/10.1007/s00467-022-05739-3
http://www.ncbi.nlm.nih.gov/pubmed/36269406?tool=bestpractice.com
Dependendo do estágio da DLM, da taxa de progressão de hipoproteinemia e dos níveis absolutos de pressão oncótica plasmática, pode ocorrer o desenvolvimento de hipovolemia funcional, a qual estimula mecanismos hemostáticos e a retenção de sódio secundária.[35]Haws RM, Baum M. Efficacy of albumin and diuretic therapy in children with nephrotic syndrome. Pediatrics. 1993;91:1142-6.
http://www.ncbi.nlm.nih.gov/pubmed/8502517?tool=bestpractice.com
A restrição de líquidos é equivalente ao débito diário mais as perdas de água insensíveis.
Na presença de anasarca maciça ou dificuldade respiratória significativa, albumina e furosemida hipertônicas devem ser consideradas.[35]Haws RM, Baum M. Efficacy of albumin and diuretic therapy in children with nephrotic syndrome. Pediatrics. 1993;91:1142-6.
http://www.ncbi.nlm.nih.gov/pubmed/8502517?tool=bestpractice.com
A furosemida é administrada por via intravenosa com cada infusão de albumina para promover a diurese.[35]Haws RM, Baum M. Efficacy of albumin and diuretic therapy in children with nephrotic syndrome. Pediatrics. 1993;91:1142-6.
http://www.ncbi.nlm.nih.gov/pubmed/8502517?tool=bestpractice.com
A pressão arterial e o estado respiratório devem ser monitorados rigorosamente durante essas infusões, pois hipertensão, agravamento da dificuldade respiratória e hipercoagulabilidade podem ocorrer com diurese agressiva.[35]Haws RM, Baum M. Efficacy of albumin and diuretic therapy in children with nephrotic syndrome. Pediatrics. 1993;91:1142-6.
http://www.ncbi.nlm.nih.gov/pubmed/8502517?tool=bestpractice.com
Embora a terapia com albumina e diuréticos resulte na remoção de líquido e na perda de peso em crianças com SN, esse efeito é temporário, a não ser que ocorra remissão de proteinúria.[35]Haws RM, Baum M. Efficacy of albumin and diuretic therapy in children with nephrotic syndrome. Pediatrics. 1993;91:1142-6.
http://www.ncbi.nlm.nih.gov/pubmed/8502517?tool=bestpractice.com
 ]
Nos adultos, o tratamento com corticosteroide em altas doses para a DLM deve ser administrado por, no máximo, 16 semanas.[3]
]
Nos adultos, o tratamento com corticosteroide em altas doses para a DLM deve ser administrado por, no máximo, 16 semanas.[3]