Abordagem
A síndrome nefrótica (SN) é uma doença crônica importante em crianças, atribuível, na maior parte dos casos, à doença de lesão mínima (DLM). Edema periférico associado a proteinúria na faixa nefrótica (relação proteína-creatinina em 24 horas ou na primeira urina matinal ≥200 mg/mmol ou ≥2 mg/mg ou ≥3+ na tira reagente), hipoalbuminemia (albumina sérica <3 g/dL) e hiperlipidemia é o traço característico dessa síndrome.[3] Como nem sempre é prático realizar urinálise de 24 horas em crianças, uma amostra da primeira urina matinal para a relação proteína/creatinina urinária (≥200 mg/mmol) é um exame diagnóstico alternativo.[3][Figure caption and citation for the preceding image starts]: Algoritmo de diagnóstico para síndrome nefrótica associada à doença de lesão mínima (DLM)Criado pelos autores [Citation ends].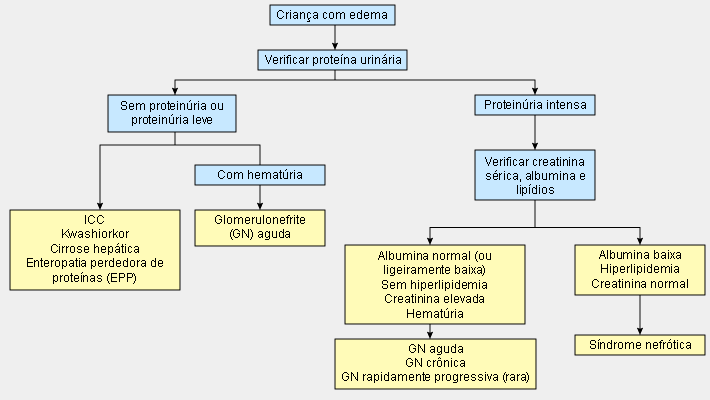
Anamnese e exame físico
Crianças com DLM subjacente geralmente têm entre 1 e 12 anos. Os pacientes costumam relatar uma história de edema facial, com ou sem inchaço nas mãos e/ou nos pés. Edema abdominal com ou sem dor abdominal também pode ser uma das queixas iniciais.[4] Náuseas e vômitos podem ocorrer, embora sejam inespecíficos. O início é gradual, variando de alguns dias a várias semanas, e normalmente ocorre depois de uma doença viral recente (sugerindo o envolvimento do sistema imunológico). Uma história de linfoma de Hodgkin ou leucemia é sugestiva de SN de DLM (glomeruloesclerose segmentar focal [GESF], glomerulonefrite membranoproliferativa [GNMP] e nefropatia membranosa também têm sido associadas à leucemia).[22]
Edema facial ou generalizado no exame físico são achados típicos. Alguns pacientes podem apresentar sinais de complicações, incluindo hipertensão ou dificuldade respiratória (uma consequência de derrame pleural ou pneumonia).[4]
Adultos com DLM também apresentam SN (edema, proteinúria na faixa necrótica, hipoalbuminemia e hiperlipidemia), mas diferem das crianças no fato de terem maior probabilidade de hipertensão (25% a 50%), hematúria (20% a 30%) e lesão renal aguda (20% a 25%) no momento do diagnóstico.[24][25]
Rastreamento de síndrome nefrótica
Todas as crianças que apresentam um primeiro episódio de edema facial ou generalizado devem fazer uma urinálise para verificar a presença de proteína na urina. Os resultados típicos mostram 3+ a 4+ proteinúria na tira reagente.[3] O sedimento urinário na SN idiopática geralmente é benigno, exceto pela presença de cilindros hialinos e corpos ovais ocasionais. Outros tipos de cilindros celulares são incomuns. A hematúria microscópica pode ser encontrada em pacientes com DLM ou GESF. No International Study of Kidney Disease in Children (ISKDC), a hematúria foi observada em 23% dos pacientes com DLM, 49% dos pacientes com GESF e 50% dos pacientes com GNMP.[20] Se a proteinúria estiver ausente ou for <3+ na tira reagente, um diagnóstico diferente de SN deverá ser considerado (por exemplo, kwashiorkor, insuficiência cardíaca congestiva e cirrose). Se a hematúria for significativa, haverá maior probabilidade de glomerulonefrite aguda.
Investigações laboratoriais
Depois de estabelecer a presença de proteína significativa na urinálise, a proteinúria deve ser medida pela relação proteína/creatinina na primeira urina da manhã ou pela proteína na urina de 24 horas. A relação proteína/creatinina é obtida com mais facilidade. Em crianças, uma relação proteína-creatinina ≥200 mg/mmol é considerada proteinúria na faixa nefrótica.[3] A proteinúria na faixa nefrótica pode variar dependendo da idade e do tamanho da criança. Por exemplo, uma relação de 1 (aproximadamente 1 g/24 horas) em um paciente de 20 kg pode indicar proteinúria na faixa nefrótica, enquanto uma relação de 1 representa proteinúria leve a moderada em um paciente adolescente.[4][20] Se houver medição da proteína urinária de 24 horas, a proteinúria na faixa nefrótica é definida por um resultado de ≥1000 mg/metro quadrado de área de superfície corporal/dia.[2]
As investigações iniciais também incluem níveis séricos de albumina, lipídios e complemento, bem como um hemograma completo e o perfil de eletrólitos.[1] A taxa de filtração glomerular (TFG) deve ser estimada e geralmente é normal na SN da DLM. São necessários TFHs (inclusive enzima hepática), pois níveis séricos elevados de aspartato aminotransferase e alanina aminotransferase podem sugerir hepatite subjacente. Se eles estiverem elevados, é necessário obter um perfil de hepatite aguda para incluir estudos de hepatite B e C.
Os níveis de albumina sérica costumam ser <30 g/L (<3 g/dL) e, em alguns casos, a albumina sérica pode ser tão baixa quanto 10 g/L (1 g/dL).[2][3] Os níveis séricos de triglicerídeos e colesterol são elevados. Existe uma relação inversa entre o nível de albumina sérica e o nível de colesterol total: quanto menor o nível de albumina sérica, maior o nível de colesterol.
Os níveis do complemento sérico na SN idiopática (DLM, GESF, nefropatia membranosa) são normais. Os níveis de C3 são baixos na GNMP, glomerulonefrite pós-infecciosa e no lúpus eritematoso sistêmico. Se o nível de C3 for baixo, exames adicionais deverão ser realizados para diferenciar essas condições, incluindo níveis de fator antinuclear (FAN), anticorpo antiácido desoxirribonucleico (anti-DNA) de fita dupla, anticorpo antiestreptolisina O, anticorpo anti-DNase e CH50.
O nível de hemoglobina e o hematócrito podem estar elevados na SN se o paciente apresentar diminuição de volume. A contagem plaquetária também pode estar elevada.
O nível de sódio sérico pode ser baixo em parte devido à diminuição da excreção de água livre (a redução de volume pode estimular a secreção de hormônio antidiurético) ou em parte devido à hiperlipidemia (pseudo-hiponatremia). A ureia pode estar levemente elevada em estados de redução de volume.
Exames por imagem
Embora os estudos de imagem talvez não forneçam informações úteis na SN não complicada, a ultrassonografia renal ajuda a confirmar a presença de dois rins e avalia seu tamanho e estrutura.[2] Na SN, os rins geralmente parecem normais. Em alguns pacientes com edema grave, os rins podem ser ecogênicos e mostrar perda de diferenciação corticomedular. Os rins também podem se apresentar aumentados.
Uma radiografia torácica é indicada em pacientes com sintomas respiratórios para excluir pneumonia ou derrame pleural, que podem ocorrer como uma complicação. A radiografia torácica também deve ser obtida em casos de suspeita de DLM associada com linfoma.[2] Em alguns países onde a tuberculose é endêmica, é prática de rotina obter uma radiografia torácica antes de iniciar a corticoterapia para descartar tuberculose.[26]
biópsia renal
Em crianças <12 anos, a biópsia geralmente é reservada para aqueles pacientes que não apresentam resposta a corticosteroides, têm quadro clínico atípico (por exemplo, creatinina sérica persistentemente elevada, hematúria significativa) e têm recidivas frequentes apesar da adição da terapia poupadora de corticosteroide. Além disso, a biópsia renal deve ser considerada quando existem fatores na manifestação que sugerem histologia diferente da de DLM, pois o tratamento pode ser diferente. Por exemplo, a DLM é incomum em bebês com <1 ano de idade; a SN congênita (tipo finlandês) ou GESF é mais provável. Portanto, todos os bebês com idade <1 ano com SN devem fazer uma biópsia renal e/ou teste genético, se disponível.[2] A obliteração de podócitos na microscopia eletrônica confirma o diagnóstico de DLM.
Em adultos, a biópsia renal é necessária para diagnosticar DLM e, em crianças ≥12 anos de idade, a biópsia deve ser considerada.[2][3]
Se a biópsia for indicada e dois rins saudáveis estiverem presentes, uma biópsia por agulha em sistema fechado orientada por ultrassonografia e com sedação consciente (ou anestesia geral em caso de lactente ou criança) será um procedimento com risco relativamente baixo. Se houver um único rim, uma biópsia laparoscópica aberta feita por um cirurgião deverá ser considerada. Se os rins forem pequenos ou estiverem obstruídos, uma biópsia talvez seja contraindicada.
Teste genético
Em lactentes com <1 ano que apresentam SN, o teste genético está se tornando mais comum, quando disponível, como alternativa ou em associação com a biópsia renal.[2] Cerca de 50% das crianças com SN de início na infância (3-12 meses de idade) apresentam causa genética de SN.[2]
O uso deste conteúdo está sujeito ao nosso aviso legal