Abordagem
O diagnóstico de leucemia mieloide aguda (LMA) requer uma abordagem multifacetada que inclui história médica, exame físico, exames laboratoriais, avaliação da medula óssea (incluindo avaliação citomorfológica e imunofenotipagem) e testes genéticos.[27][45]
Como a LMA e a leucemia linfoide aguda (LLA) em geral são clinicamente indistinguíveis, é essencial a confirmação da origem mieloide das células leucêmicas por imunofenotipagem. Isso pode ser feito no sangue periférico antes da confirmação com base na medula óssea.
História
Em todos os pacientes, uma anamnese completa (incluindo a história familiar, se conhecida) é importante para o diagnóstico.
O risco de LMA aumenta em certos grupos de pacientes, incluindo aqueles com:
história prévia de distúrbios hematológicos
tratamento prévio com quimioterapia (particularmente agentes alquilantes e inibidores da topoisomerase II)
distúrbios genéticos (por exemplo, distúrbios de fragilidade cromossômica hereditária, síndrome de falência medular, síndrome de Li-Fraumeni, neurofibromatose, anormalidades cromossômicas [por exemplo, distúrbios de trissomia])
aumento da idade (≥65 anos)
história de tabagismo
exposição prévia à radiação ionizante ou ao benzeno.
Os pacientes com LMA geralmente apresentam história recente de sintomas relacionados à citopenia, incluindo fadiga, tontura, palpitações, dispneia, febres, infecções, sangramento da mucosa (por exemplo, gengivas, nariz, sangramento menstrual intenso) e erupção petequial.
Alguns pacientes podem relatar sintomas relacionados à infiltração leucêmica, incluindo dor óssea (devido à infiltração da medula óssea); massas na pele (por exemplo, sarcoma mieloide, devido à infiltração da pele); ou sintomas neurológicos (por exemplo, cefaleia, confusão, devido à infiltração meníngea).[54][55]
Sintomas pulmonares (por exemplo, dispneia) e sintomas gastrointestinais (por exemplo, dor abdominal intensa) podem estar presentes devido à infiltração leucêmica ou infecção nos pulmões e no trato gastrointestinal, respectivamente.[56][57]
Exame físico
Os achados podem incluir sinais de citopenia (por exemplo, palidez, equimoses e petéquias).
Sinais de infiltração leucêmica extramedular podem ser evidentes (por exemplo, hepatoesplenomegalia, linfadenopatia, aumento da gengiva, massas cutâneas, massas testiculares).
Na pele, infiltração leucêmica da cútis pode estar presente, e úlceras cutâneas (por exemplo, síndrome de Sweet ou pioderma gangrenoso) podem indicar malignidade subjacente.
Sinais de infecção oral/dentária (por exemplo, abscesso dentário), infecção nasofaríngea, infecção pulmonar ou infecção perianal podem estar presentes devido à neutropenia.[58][59]
Raramente, um abdome agudo é observado no exame físico.
Exames laboratoriais iniciais
Todos os pacientes com suspeita de LMA devem ser submetidos aos seguintes exames iniciais:[27][45]
Hemograma completo com diferencial
Esfregaço de sangue periférico
Perfil metabólico completo (eletrólitos séricos, perfil renal e hepático, ácido úrico sérico e lactato desidrogenase sérica [LDH])
Painel da coagulação (tempo de protrombina [TP], tempo de tromboplastina parcial ativada [TTPa], fibrinogênio e dímero D)
Achados laboratoriais
A maioria dos pacientes com LMA (inclusive aqueles com leucemia promielocítica aguda [LPA], um subtipo de LMA) tem anemia, neutropenia e/ou trombocitopenia, mas o hemograma pode variar muito.
Uma contagem leucocitária elevada >100 × 10⁹/L (>100,000/microlitro; hiperleucocitose) ocorre em aproximadamente 5% a 20% dos pacientes com LMA, o que os predispõe a complicações tais como síndrome da lise tumoral (SLT), comprometimento do sistema nervoso central (SNC) e leucostase (hiperleucocitose sintomática; os sintomas incluem desconforto respiratório e estado mental alterado).[3][4] São emergências médicas e requerem tratamento imediato. Apesar da elevação na contagem leucocitária, muitos pacientes apresentam neutropenia grave (contagem absoluta de neutrófilos [ANC] <0.5 x 10⁹/L [<500 células/microlitro]), o que os coloca em alto risco para infecções graves.
Na LMA, o esfregaço pode mostrar blastos mieloides caracterizados por bastonetes de Auer ou corpos Phi (fusiformes). Na LPA, o esfregaço geralmente mostra promielócitos hipergranulares com núcleos bilobados e grupos de bastonetes de Auer (bem como blastos mieloides). Uma variante da LPA é caracterizada por promielócitos hipogranulares (ausência de bastonetes de Auer), mas é menos comum.[Figure caption and citation for the preceding image starts]: Esfregaço de sangue periférico de paciente com leucemia mieloide aguda com maturação mostrando blastos mieloides com bastonete de AuerDo acervo dos Drs. K. Raj e P. Mehta; usado com a permissão do paciente [Citation ends].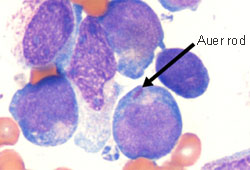 [Figure caption and citation for the preceding image starts]: Esfregaço periférico de um paciente com leucemia promielocítica aguda mostrando promielócitos hipergranulares, alguns com grupos de bastonetes de AuerDo acervo dos Drs. K. Raj e P. Mehta; usado com a permissão do paciente [Citation ends].
[Figure caption and citation for the preceding image starts]: Esfregaço periférico de um paciente com leucemia promielocítica aguda mostrando promielócitos hipergranulares, alguns com grupos de bastonetes de AuerDo acervo dos Drs. K. Raj e P. Mehta; usado com a permissão do paciente [Citation ends].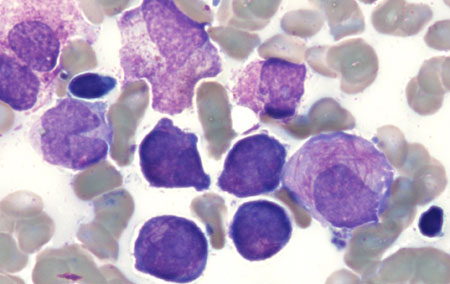 [Figure caption and citation for the preceding image starts]: Esfregaço periférico de um paciente com leucemia promielocítica aguda mostrando promielócitos hipergranulares com núcleo bilobado e grupos de bastonetes de AuerDo acervo dos Drs. K. Raj e P. Mehta; usado com a permissão do paciente [Citation ends].
[Figure caption and citation for the preceding image starts]: Esfregaço periférico de um paciente com leucemia promielocítica aguda mostrando promielócitos hipergranulares com núcleo bilobado e grupos de bastonetes de AuerDo acervo dos Drs. K. Raj e P. Mehta; usado com a permissão do paciente [Citation ends].
Hipercalemia, hiperfosfatemia, hiperuricemia, hipocalcemia e LDH sérica elevada podem ocorrer devido à SLT, particularmente durante o tratamento e se a contagem leucocitária (carga tumoral) for elevada. Isso pode levar a arritmias cardíacas, convulsões, lesão renal aguda e morte, se não for tratada. A SLT é uma emergência oncológica.[60] Consulte Síndrome da lise tumoral.
Pode ocorrer hipercalcemia por infiltração óssea ou liberação ectópica de uma substância semelhante ao paratormônio.
Os testes da coagulação TP e TTPa podem estar ligeiramente prolongados com fibrinogênio normal e dímero D.
Se os testes de coagulação estiverem anormais (TP e TTPa prolongados, fibrinogênio reduzido e/ou dímero D elevado), deve-se suspeitar de coagulação intravascular disseminada (CIVD), sendo necessário encaminhamento urgente para iniciar o tratamento. Consulte o escore da International Society on Thrombosis and Haemostasis (ISTH) para CIVD.[61] A CIVD ocorre com mais frequência na LPA e é potencialmente de risco de vida.[62].
Avaliação da medula óssea
O diagnóstico requer análise de aspirado de medula óssea e biópsia por trefina. Os seguintes exames devem ser realizados.[27][45]
Avaliação citomorfológica: demonstra hipercelularidade da medula óssea e infiltração por blastos mieloides (bem como promielócitos hipergranulares ou hipogranulares [menos comuns] na LPA). Os blastos mieloides são negativos para o deoxinucleotidil transferase terminal (TdT) e positivos para a coloração de mieloperoxidase.
Imunofenotipagem usando citometria de fluxo (em aspirado de medula óssea) e imuno-histoquímica (em amostra de punção por agulha grossa [core biopsy]): identifica marcadores de superfície celular e citoplasmáticos de blastos mieloides (por exemplo, CD34, CD33) e estabelece a linhagem.
Caso as amostras da medula óssea sejam inadequadas ou irrealizáveis, o sangue periférico pode ser usado para a avaliação patológica, desde que haja números suficientes de blastos circulantes.[63]
Teste genético
Análises citogenéticas (cariotipagem, hibridização in situ fluorescente [FISH] ou sequenciamento do genoma completo) e testes genéticos moleculares (por exemplo, reação em cadeia da polimerase, ensaios de sequenciamento de nova geração [NGS]) devem ser realizados em amostras de medula óssea (ou sangue periférico se houver blastos circulantes) para orientar o diagnóstico, prognóstico, estratificação de risco e tratamento.[27][45]
Na LMA, as seguintes anormalidades genéticas devem ser investigadas devido a sua associação com prognósticos e objetivos de tratamento específicos: RUNX1::RUNX1T1; CBFB::MYH11; MLLT3::KMT2A (ou outros rearranjos de KMT2A); DEK::NUP214; BCR::ABL1; KAT6A::CREBBP; KIT; NPM1; FLT3 (ITD e TKD); IDH1; IDH2; CEBPA (domínio zíper de leucina básica [bZIP]); -5 ou del(5q); -7; -17/abn(17p); GATA2; MECOM(EVI1); ASXL1; BCOR; EZH2; RUNX1; SF3B1; SRSF2; STAG2; U2AF1; ZRSR2; e TP53.[27][45] Consulte Critérios.
A LPA é caracterizada pelo gene de fusão PML::RARA causado por um rearranjo cromossômico equilibrado t(15;17)(q22;q12).[27][44]
Diagnóstico e classificação definitivos
A LMA pode ser diagnosticada e classificada de acordo com a última classificação de tumores hematolinfoides da Organização Mundial da Saúde (OMS) (5ª edição, 2022) ou a Classificação de Consenso Internacional (ICC).[1][2] Em ambas as classificações, a avaliação da medula óssea, testes genéticos e fatores predisponentes (por exemplo, terapia prévia, neoplasias mieloides antecedentes, mutações genéticas hereditárias ou síndrome) são necessários para fazer um diagnóstico definitivo de LMA. No entanto, as classificações diferem em relação a como os subtipos específicos de LMA são categorizados e em relação aos requisitos de limiar de contagem de blastos para determinados subtipos de LMA.
A 5ª edição da Classificação da OMS não necessita de um limite de blastos, com exceção da LMA com fusão BCR::ABL1 e da LMA com mutação CEBPA, que necessitam de ≥20% de blastos para o diagnóstico.[1] A classificação do ICC, no entanto, exige uma contagem de blastos ≥10% para diagnosticar LMA com anormalidades genéticas definidoras (exceto para fusão BCR::ABL1, onde uma contagem de blastos ≥20% é necessária).[2]
Consulte a seção Classificação para obter detalhes adicionais.
Exames adicionais
Testes genéticos para síndromes de predisposição à neoplasia hematológica hereditária (por exemplo, síndrome de deficiência de GATA2, síndrome de Shwachman-Diamond, disceratose congênita) devem ser considerados para certos pacientes, como aqueles com menos de 50 anos de idade e aqueles com história familiar de distúrbio hematológico hereditário.[27][45] Os achados podem orientar o manejo.
Imagens do SNC (por exemplo, RNM ou TC do cérebro) devem ser realizadas para detectar sangramento do SNC, doença meníngea ou lesões de massa em pacientes que apresentam sinais ou sintomas neurológicos que sugerem envolvimento do SNC.[27][45] Se a imagem do SNC não identificar sangramento ou efeito de massa no SNC, e os sinais e sintomas neurológicos persistirem, a punção lombar é recomendada.[45] Uma dose de quimioterapia intratecal (por exemplo, metotrexato ou citarabina, ou uma combinação de ambos os agentes) pode ser considerada no momento da punção lombar diagnóstica.[45] A coagulopatia deve ser tratada antes da punção lombar, principalmente em pacientes com LPA.
Uma FDG-PET/CT deve ser considerada em pacientes com suspeita de doença extramedular.[45]
A avaliação da função cardíaca (ecocardiograma ou angiografia sincronizada multinuclear) deve ser realizada em pacientes:
com história ou sintomas de doença cardíaca,
com exposição prévia a medicamentos cardiotóxicos ou radioterapia no tórax, ou
Os achados cardíacos podem orientar o tratamento.
A radiografia torácica pode ser realizada para identificar pneumonia, massas mediastinais, infiltrados pulmonares ou cardiomegalia.
A tipagem do antígeno leucocitário humano deve ser realizada em todos os pacientes considerados para um transplante alogênico de células-tronco.[45]
O uso deste conteúdo está sujeito ao nosso aviso legal