A leucemia linfoide aguda (LLA) geralmente se apresenta de forma rápida e agressiva nos adultos. Ela pode mimetizar muitas outras doenças, o que muitas vezes gera confusão diagnóstica.
O diagnóstico definitivo pode ser estabelecido por aspiração da medula óssea e biópsia por trefina. Os linfoblastos leucêmicos podem circular no sangue; se presentes em quantidade suficiente, essa constatação pode ser usada para encaminhar para um exame de medula óssea na apresentação.
Quadro clínico e história
O aparecimento de sintomas constitucionais (febre, sudorese noturna, perda de peso) ou sinais e sintomas de citopenias costuma ser a causa inicial de procura de atendimento médico por pacientes com LLA. A maioria dos pacientes se apresenta dentro de algumas semanas após o início dos sintomas.
A anemia geralmente se manifesta como fadiga, dispneia, palpitações e tontura; a trombocitopenia se manifesta com sangramento (por exemplo, epistaxe, sangramento menstrual intenso) e formação fácil de hematomas; a neutropenia se manifesta com infecções recorrentes, as quais podem provocar febre.
O envolvimento dos linfonodos é comum na LLA. Linfonodos aumentados pode ser um sinal da apresentação inicial.
Dores abdominais e ósseas podem se manifestar por infiltração de linfoblastos leucêmicos no baço e na medula óssea, respectivamente.[51]Gallagher DJ, Phillips DJ, Heinrich SD. Orthopedic manifestations of acute pediatric leukemia. Orthop Clin North Am. 1996 Jul;27(3):635-44.
http://www.ncbi.nlm.nih.gov/pubmed/8649744?tool=bestpractice.com
As características clínicas menos comuns na apresentação incluem eosinofilia, insuficiência renal isolada, nódulos pulmonares, necrose da medula óssea, derrame pleural/pericárdico, obstrução da veia cava superior, hipoglicemia, dor nas articulações e nódulos na pele.[1]Pui CH, Relling MV, Downing JR. Acute lymphoblastic leukemia. N Engl J Med. 2004 Apr 8;350(15):1535-48.
http://www.ncbi.nlm.nih.gov/pubmed/15071128?tool=bestpractice.com
[6]Haferlach T, Bacher U, Kern W, et al. Diagnostic pathways in acute leukemias: a proposal for a multimodal approach. Ann Hematol. 2007 May;86(5):311-27.
http://www.ncbi.nlm.nih.gov/pubmed/17375301?tool=bestpractice.com
Fatores genéticos associados ao desenvolvimento da LLA
Fatores históricos sugestivos de LLA incluem história de neoplasia maligna, história familiar de LLA, doença genética (por exemplo, trissomia do cromossomo 21, síndrome de Li-Fraumeni, neurofibromatose, síndrome de Klinefelter, anemia de Fanconi, síndrome de Shwachman-Diamond, síndrome de Bloom, ataxia-telangiectasia), tratamento com quimioterapia, exposição à radiação, tabagismo e infecções virais (por exemplo, vírus Epstein-Barr).[1]Pui CH, Relling MV, Downing JR. Acute lymphoblastic leukemia. N Engl J Med. 2004 Apr 8;350(15):1535-48.
http://www.ncbi.nlm.nih.gov/pubmed/15071128?tool=bestpractice.com
[2]Jabbour EJ, Faderl S, Kantarjian HM. Adult acute lymphoblastic leukemia. Mayo Clin Proc. 2005 Nov;80(11):1517-27.
http://www.ncbi.nlm.nih.gov/pubmed/16295033?tool=bestpractice.com
[12]Greaves MF, Maia AT, Wiemels JL, et al. Leukemia in twins: lessons in natural history. Blood. 2003 Oct 1;102(7):2321-33.
http://www.ncbi.nlm.nih.gov/pubmed/12791663?tool=bestpractice.com
[13]Machatschek JN, Schrauder A, Helm F, et al. Acute lymphoblastic leukemia and Klinefelter syndrome in children: two cases and review of the literature. Pediatr Hematol Oncol. 2004 Oct-Nov;21(7):621-6.
http://www.ncbi.nlm.nih.gov/pubmed/15626018?tool=bestpractice.com
[14]Bloom M, Maciaszek JL, Clark ME, et al. Recent advances in genetic predisposition to pediatric acute lymphoblastic leukemia. Expert Rev Hematol. 2020 Jan;13(1):55-70.
http://www.ncbi.nlm.nih.gov/pubmed/31657974?tool=bestpractice.com
[15]Strevens MJ, Lilleyman JS, Williams RB. Shwachman's syndrome and acute lymphoblastic leukaemia. Br Med J. 1978 Jul 1;2(6129):18.
https://www.bmj.com/content/bmj/2/6129/18.1.full.pdf
http://www.ncbi.nlm.nih.gov/pubmed/277273?tool=bestpractice.com
[16]Woods WG, Roloff JS, Lukens JN, et al. The occurrence of leukemia in patients with the Shwachman syndrome. J Pediatr. 1981 Sep;99(3):425-8.
http://www.ncbi.nlm.nih.gov/pubmed/7264801?tool=bestpractice.com
[21]Snyder DS, Stein AS, O'Donnell MR, et al, Philadelphia chromosome-positive acute lymphoblastic leukemia secondary to chemoradiotherapy for Ewing sarcoma. Report of two cases and concise review of the literature. Am J Hematol. 2005 Jan;78(1):74-8.
http://www.ncbi.nlm.nih.gov/pubmed/15609284?tool=bestpractice.com
[22]Guan H, Miao H, Ma N, et al. Correlations between Epstein-Barr virus and acute leukemia. J Med Virol. 2017 Aug;89(8):1453-1460.
http://www.ncbi.nlm.nih.gov/pubmed/28225168?tool=bestpractice.com
[23]De Keersmaecker K, Marynen P, Cools J. Genetic insights in the pathogenesis of T-cell acute lymphoblastic leukemia. Haematologica. 2005 Aug;90(8):1116-27.
http://www.ncbi.nlm.nih.gov/pubmed/16079112?tool=bestpractice.com
[52]Hoelzer D, Gökbuget N, Ottmann O, et al. Acute lymphoblastic leukemia. Hematology Am Soc Hematol Educ Program. 2002 Jan;(1):162-92.
https://ashpublications.org/hematology/article/2002/1/162/18610/Acute-Lymphoblastic-Leukemia
http://www.ncbi.nlm.nih.gov/pubmed/12446423?tool=bestpractice.com
Exame físico
Os achados podem incluir palidez, equimoses, petéquias, linfadenopatia, hepatoesplenomegalia, massas mediastinais, massas abdominais, aumento testicular (unilateral e indolor), aumento renal e infiltrações na pele (nódulos cutâneos).
A linfadenopatia é classicamente generalizada, e os linfonodos aumentados são indolores e totalmente móveis.[1]Pui CH, Relling MV, Downing JR. Acute lymphoblastic leukemia. N Engl J Med. 2004 Apr 8;350(15):1535-48.
http://www.ncbi.nlm.nih.gov/pubmed/15071128?tool=bestpractice.com
[6]Haferlach T, Bacher U, Kern W, et al. Diagnostic pathways in acute leukemias: a proposal for a multimodal approach. Ann Hematol. 2007 May;86(5):311-27.
http://www.ncbi.nlm.nih.gov/pubmed/17375301?tool=bestpractice.com
É mais comum que a LLA-T cause massas mediastinais, enquanto a LLA-B causa massas abdominais com mais frequência. Os achados de estridor, sibilância, derrame pericárdico e síndrome da veia cava superior podem estar associados a massas mediastinais. A LLA-B madura (linfoma de Burkitt/leucemia) pode se apresentar inicialmente como uma grande massa abdominal palpável proveniente de um tumor de proliferação rápida.[34]Hoffman R, Shattil SJ, Furie B, et al. Hematology: basic principles and practice. Vol 1. 4th ed. Orlando, FL: Churchill Livingstone / W.B. Saunders; 2005.[53]Abeloff MD, Armitage J, Niederhuber JE, et al. Clinical oncology. 3rd ed. Vol 1. Philadelphia, PA: Churchill Livingstone; 2004:3232.
O envolvimento testicular ocorre mais comumente em crianças e adolescentes com LLA-T.[54]Nguyen HTK, Terao MA, Green DM, et al. Testicular involvement of acute lymphoblastic leukemia in children and adolescents: diagnosis, biology, and management. Cancer. 2021 Sep 1;127(17):3067-81.
https://acsjournals.onlinelibrary.wiley.com/doi/10.1002/cncr.33609
http://www.ncbi.nlm.nih.gov/pubmed/34031876?tool=bestpractice.com
O exame testicular deve ser realizado no momento do diagnóstico em todos os pacientes do sexo masculino. Os testículos podem representar um local de difícil alcance da medicação, relativamente protegido dos efeitos da terapia sistêmica por meio da barreira hematotesticular.[54]Nguyen HTK, Terao MA, Green DM, et al. Testicular involvement of acute lymphoblastic leukemia in children and adolescents: diagnosis, biology, and management. Cancer. 2021 Sep 1;127(17):3067-81.
https://acsjournals.onlinelibrary.wiley.com/doi/10.1002/cncr.33609
http://www.ncbi.nlm.nih.gov/pubmed/34031876?tool=bestpractice.com
Avaliação neurológica
Necessária para descartar envolvimento do sistema nervoso central (SNC), que é uma das principais complicações da LLA. O envolvimento do SNC ocorre em aproximadamente 5% a 7% dos pacientes no momento do diagnóstico; a incidência é maior nos pacientes com LLA-T (8%) e LLA-B madura (linfoma de Burkitt/leucemia, 13%).[9]Pui CH. Central nervous system disease in acute lymphoblastic leukemia: prophylaxis and treatment. Hematology Am Soc Hematol Educ Program. 2006 Jan;(1):142-6.
https://ashpublications.org/hematology/article/2006/1/142/19688/Central-Nervous-System-Disease-in-Acute
http://www.ncbi.nlm.nih.gov/pubmed/17124053?tool=bestpractice.com
[55]Reman O, Pigneux A, Huguet F, et al. Central nervous system involvement in adult acute lymphoblastic leukemia at diagnosis and/or at first relapse: results from the GET-LALA group. Leuk Res. 2008 Nov;32(11):1741-50.
http://www.ncbi.nlm.nih.gov/pubmed/18508120?tool=bestpractice.com
[56]Lazarus HM, Richards SM, Chopra R, et al. Central nervous system involvement in adult acute lymphoblastic leukemia at diagnosis: results from the international ALL trial MRC UKALL XII/ECOG E2993. Blood. 2006 Jul 15;108(2):465-72.
https://ashpublications.org/blood/article/108/2/465/109893/Central-nervous-system-involvement-in-adult-acute
http://www.ncbi.nlm.nih.gov/pubmed/16556888?tool=bestpractice.com
[57]Lamanna N, Weiss M. Treatment options for newly diagnosed patients with adult acute lymphoblastic leukemia. Curr Hematol Rep. 2004 Jan;3(1):40-6.
http://www.ncbi.nlm.nih.gov/pubmed/14695849?tool=bestpractice.com
[58]Richards S, Pui CH, Gayon P, et al. Systematic review and meta-analysis of randomized trials of central nervous system directed therapy for childhood acute lymphoblastic leukemia. Pediatr Blood Cancer. 2013 Feb;60(2):185-95.
https://onlinelibrary.wiley.com/doi/10.1002/pbc.24228
http://www.ncbi.nlm.nih.gov/pubmed/22693038?tool=bestpractice.com
As meninges são o local primário de doenças do SNC.[59]Frishman-Levy L, Izraeli S. Advances in understanding the pathogenesis of CNS acute lymphoblastic leukaemia and potential for therapy. Br J Haematol. 2017 Jan;176(2):157-67.
https://onlinelibrary.wiley.com/doi/10.1111/bjh.14411
http://www.ncbi.nlm.nih.gov/pubmed/27766623?tool=bestpractice.com
As características apresentadas da doença do SNC incluem alterações do estado mental, sinais/deficits neurológicos focais (por exemplo, diplopia, dormência no queixo), cefaleia, papiledema, rigidez da nuca e meningismo.[3]Terwilliger T, Abdul-Hay M. Acute lymphoblastic leukemia: a comprehensive review and 2017 update. Blood Cancer J. 2017 Jun 30;7(6):e577.
https://www.nature.com/articles/bcj201753
http://www.ncbi.nlm.nih.gov/pubmed/28665419?tool=bestpractice.com
[7]Deak D, Gorcea-Andronic N, Sas V, et al. A narrative review of central nervous system involvement in acute leukemias. Ann Transl Med. 2021 Jan;9(1):68.
https://atm.amegroups.org/article/view/59808/html
http://www.ncbi.nlm.nih.gov/pubmed/33553361?tool=bestpractice.com
[8]Del Principe MI, Maurillo L, Buccisano F, et al. Central nervous system involvement in adult acute lymphoblastic leukemia: diagnostic tools, prophylaxis, and therapy. Mediterr J Hematol Infect Dis. 2014;6(1):e2014075.
http://www.ncbi.nlm.nih.gov/pubmed/25408861?tool=bestpractice.com
Exames laboratoriais iniciais
Devem incluir hemograma completo com diferencial, esfregaço de sangue periférico, perfil metabólico completo (eletrólitos séricos; ácido úrico sérico; lactato desidrogenase [LDH] sérica; testes da função renal; testes da função hepática), perfil de coagulação (tempo de protrombina, tempo de tromboplastina parcial, fibrinogênio e dímero D), grupo sanguíneo e rastreamento de anticorpos (para suporte a uma transfusão), e testes de anticorpos virais (inclusive sorologias para hepatites B e C e HIV).[60]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: acute lymphoblastic leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
[61]RM Partners. Pan-London haemato-oncology clinical guidelines. Acute leukaemias and myeloid neoplasms. Part 1: acute lymphoblastic leukaemia. Jan 2020 [internet publication].
https://rmpartners.nhs.uk/wp-content/uploads/2020/01/Pan-London-ALL-Guidelines-Jan-2020.pdf
Achados laboratoriais
Mais de 90% dos pacientes apresentam anormalidades hematológicas clinicamente evidentes no momento do diagnóstico inicial.
A anemia normocítica normocrômica com baixa contagem de reticulócitos está presente em 80% dos pacientes. A trombocitopenia é muito comum, afetando 75% dos pacientes.[1]Pui CH, Relling MV, Downing JR. Acute lymphoblastic leukemia. N Engl J Med. 2004 Apr 8;350(15):1535-48.
http://www.ncbi.nlm.nih.gov/pubmed/15071128?tool=bestpractice.com
[6]Haferlach T, Bacher U, Kern W, et al. Diagnostic pathways in acute leukemias: a proposal for a multimodal approach. Ann Hematol. 2007 May;86(5):311-27.
http://www.ncbi.nlm.nih.gov/pubmed/17375301?tool=bestpractice.com
A leucocitose é encontrada em 50% dos pacientes; em 25% desses pacientes, a contagem leucocitária é >50 × 10⁹/L (>50,000/microlitro). A contagem leucocitária alta à apresentação está associada a um prognóstico mais desfavorável. Apesar da elevação nos leucócitos, muitos pacientes apresentam neutropenia grave (contagem absoluta de neutrófilos <0.5 x 10⁹/L [<500 células/microlitro]), o que os coloca em alto risco para infecções graves.[62]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: prevention and treatment of cancer-related infections [internet publication].
https://www.nccn.org/guidelines/category_3
Consulte Neutropenia febril.
Linfoblastos leucêmicos podem ser detectados no esfregaço de sangue periférico. A presença de linfoblastos leucêmicos ≥1 x 10⁹/L (≥1000/microlitro) no sangue periférico é suficiente para o encaminhamento para um exame da medula óssea à apresentação.[60]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: acute lymphoblastic leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
Pode ocorrer hipercalcemia por infiltração óssea ou liberação ectópica de uma substância semelhante ao paratormônio.
Hipercalemia, hiperfosfatemia, hiperuricemia, hipocalcemia e LDH sérica elevada podem ocorrer devido à síndrome da lise tumoral (SLT), particularmente durante o tratamento e se a contagem leucocitária (carga tumoral) for elevada. Isso pode levar a arritmias cardíacas, convulsões, insuficiência renal aguda e morte, se não tratada. A SLT é uma emergência oncológica. Consulte Síndrome da lise tumoral.
Avaliação da medula óssea
A investigação diagnóstica da LLA requer avaliação hematopatológica do aspirado de medula óssea e amostras de biópsia por trefina (ou sangue periférico se houver número suficiente de linfoblastos circulantes), que deve incluir:[60]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: acute lymphoblastic leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
[63]de Haas V, Ismaila N, Advani A, et al. Initial diagnostic work-up of acute leukemia: ASCO clinical practice guideline endorsement of the College of American Pathologists and American Society of Hematology guideline. J Clin Oncol. 2019 Jan 20;37(3):239-53.
https://ascopubs.org/doi/10.1200/JCO.18.01468
http://www.ncbi.nlm.nih.gov/pubmed/30523709?tool=bestpractice.com
Essas investigações podem determinar o subtipo de LLA; informar a estratificação do risco e o planejamento do tratamento; e estabelecer uma linha basal para avaliação da doença residual mensurável (DRM) durante o tratamento (veja abaixo).[60]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: acute lymphoblastic leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
Avaliação citomorfológica
Uma biópsia que demonstre hipercelularidade da medula óssea e infiltração por linfoblastos é característica de LLA.
Não há consenso em relação à proporção de linfoblastos na medula óssea necessária para se fazer o diagnóstico de LLA; no entanto, geralmente recomenda-se um limiar de ≥20%.[60]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: acute lymphoblastic leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
Observe que o limiar de linfoblastos definido na medula óssea (ou sangue periférico) nem sempre é necessário para o diagnóstico de LLA (por exemplo, a LLA-T pode ser diagnosticada com base na imunofenotipagem). Consulte Classificação.
A proporção de linfoblastos na medula óssea pode ajudar a distinguir entre LLA e linfoma linfoblástico. Consulte Diagnóstico diferencial.
A coloração citoquímica da mieloperoxidase (MPO) de amostras de biópsia deve ser realizada para ajudar a diferenciar a LLA da leucemia mieloide aguda (LMA). A MPO será negativa na LLA e positiva na LMA.[64]Gökbuget N, Boissel N, Chiaretti S, et al. Diagnosis, prognostic factors, and assessment of ALL in adults: 2024 ELN recommendations from a European expert panel. Blood. 2024 May 9;143(19):1891-902.
https://ashpublications.org/blood/article/143/19/1891/514792/Diagnosis-prognostic-factors-and-assessment-of-ALL
http://www.ncbi.nlm.nih.gov/pubmed/38295337?tool=bestpractice.com
Consulte Diagnóstico diferencial.
Achados de imunofenotipagem
A imunofenotipagem (em amostras de medula óssea ou sangue periférico, se houver um número suficiente de linfoblastos circulantes) é necessária para avaliar marcadores celulares para:[60]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: acute lymphoblastic leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
determinar a linhagem linfoide (célula B ou célula T)
definir um fenótipo aberrante para avaliação de DRM; e
detectar antígenos de superfície celular de importância clínica e terapêutica (por exemplo, CD20).
Geralmente, as células leucêmicas exibem marcadores de um único tipo celular. Raramente, a expressão simultânea dos marcadores linfoides e mieloides ocorre na LLA, seja como LLA com expressão aberrante de antígenos mieloides (My + LLA) ou como leucemia aguda bifenotípica verdadeira.
Avaliação citogenética e molecular
Análises citogenéticas (por exemplo, cariotipagem; hibridização in situ fluorescente [FISH]) e testes moleculares (por exemplo, reação em cadeia da polimerase via transcriptase reversa [RT-PCR]) de linfoblastos leucêmicos (em amostras de medula óssea ou sangue periférico) são necessárias para detectar anormalidades genéticas recorrentes (por exemplo, BCR::ABL1 [cromossomo Filadélfia]; rearranjos de KMT2A).[60]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: acute lymphoblastic leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
[63]de Haas V, Ismaila N, Advani A, et al. Initial diagnostic work-up of acute leukemia: ASCO clinical practice guideline endorsement of the College of American Pathologists and American Society of Hematology guideline. J Clin Oncol. 2019 Jan 20;37(3):239-53.
https://ascopubs.org/doi/10.1200/JCO.18.01468
http://www.ncbi.nlm.nih.gov/pubmed/30523709?tool=bestpractice.com
Os ensaios de sequenciamento de última geração (NGS) podem ser usados juntamente com a análise citogenética e os testes de RT-PCR para detectar fusões/rearranjos genéticos adicionais (por exemplo, DUX4, MEF2D, ZNF384) e mutações patogênicas (por exemplo, SH2B3, IL7R e JAK1/2/3 na LLA-B semelhante ao cromossomo Filadélfia [LLA-B semelhante a Ph]).[60]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: acute lymphoblastic leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
[63]de Haas V, Ismaila N, Advani A, et al. Initial diagnostic work-up of acute leukemia: ASCO clinical practice guideline endorsement of the College of American Pathologists and American Society of Hematology guideline. J Clin Oncol. 2019 Jan 20;37(3):239-53.
https://ascopubs.org/doi/10.1200/JCO.18.01468
http://www.ncbi.nlm.nih.gov/pubmed/30523709?tool=bestpractice.com
A caracterização citogenética e molecular abrangente dos linfoblastos leucêmicos (junto com a avaliação hematopatológica da medula óssea) determina o subtipo da LLA; informa a estratificação de risco e o planejamento do tratamento; e facilita a avaliação da DRM.[60]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: acute lymphoblastic leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
[63]de Haas V, Ismaila N, Advani A, et al. Initial diagnostic work-up of acute leukemia: ASCO clinical practice guideline endorsement of the College of American Pathologists and American Society of Hematology guideline. J Clin Oncol. 2019 Jan 20;37(3):239-53.
https://ascopubs.org/doi/10.1200/JCO.18.01468
http://www.ncbi.nlm.nih.gov/pubmed/30523709?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: Linfoblastos em esfregaço de medula óssea de um paciente masculino, com 3 anos de idade, com LLA (coloração de Wright-Giemsa)Imagem e descrição extraídas do AFIP Atlas of Tumor Pathology [Citation ends].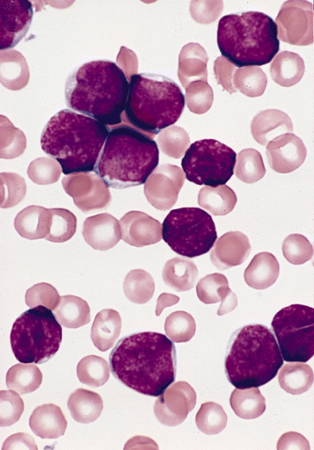
Teste da doença residual mensurável (DRM) basal
É importante estabelecer uma linha basal para os testes da DRM com base em características imunofenotípicas e moleculares do linfoblasto leucêmico.
O teste da DRM permite a avaliação da intensidade e da velocidade de remissão durante o tratamento. Ele é importante do ponto de vista prognóstico e pode orientar decisões terapêuticas. O método usado para o teste da DRM depende do paciente e dos ensaios disponíveis no centro de tratamento.
A amostra preferível para o teste da DRM é o primeiro pequeno volume (de até 3 mL) extraído do aspirado de medula óssea, se possível.[60]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: acute lymphoblastic leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
Punção lombar
Uma punção lombar é necessária em todos os pacientes, dada a frequência de envolvimento do SNC. O procedimento só deve ser realizado depois que for descartada pressão intracraniana elevada.
A punção lombar deve ser realizada em um momento condizente com o protocolo de tratamento em uso. Os protocolos baseados em esquemas pediátricos normalmente incluem uma punção lombar na investigação diagnóstica. No entanto, o Painel de LLA da National Comprehensive Cancer Network recomenda que a primeira punção lombar seja realizada de maneira concomitante com a terapia intratecal para evitar a contaminação do SNC por linfoblastos leucêmicos circulantes, a menos que os sintomas requeiram que a punção lombar seja realizada antes.[60]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: acute lymphoblastic leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
A detecção de linfoblastos na amostra inicial de líquido cefalorraquidiano (LCR) por citometria de fluxo multiparamétrica pode identificar os pacientes com alto risco de recidiva no SNC.[71]Del Principe MI, Buzzatti E, Piciocchi A, et al. Clinical significance of occult central nervous system disease in adult acute lymphoblastic leukemia. A multicenter report from the Campus ALL Network. Haematologica. 2021 Jan 1;106(1):39-45.
https://haematologica.org/article/view/9587
http://www.ncbi.nlm.nih.gov/pubmed/31879328?tool=bestpractice.com
[72]Garcia KA, Cherian S, Stevenson PA, et al. Cerebrospinal fluid flow cytometry and risk of central nervous system relapse after hyperCVAD in adults with acute lymphoblastic leukemia. Cancer. 2022 Apr 1;128(7):1411-7.
http://www.ncbi.nlm.nih.gov/pubmed/34931301?tool=bestpractice.com
O comprometimento do SNC ao diagnóstico pode ser classificado com base na presença de linfoblastos, leucócitos e eritrócitos no LCR, usando-se a classificação do Children's Oncology Group.[73]Winick N, Devidas M, Chen S, et al. Impact of initial CSF findings on outcome among patients with National Cancer Institute standard- and high-risk B-cell acute lymphoblastic leukemia: a report from the children's oncology group. J Clin Oncol. 2017 Aug 1;35(22):2527-34.
https://ascopubs.org/doi/10.1200/JCO.2016.71.4774
http://www.ncbi.nlm.nih.gov/pubmed/28535084?tool=bestpractice.com
[74]Kopmar NE, Cassaday RD. How I prevent and treat central nervous system disease in adults with acute lymphoblastic leukemia. Blood. 2023 Mar 23;141(12):1379-88.
https://ashpublications.org/blood/article/141/12/1379/493851/How-I-prevent-and-treat-central-nervous-system
http://www.ncbi.nlm.nih.gov/pubmed/36548957?tool=bestpractice.com
Graus mais elevados (ou seja, aumento de linfoblastos, leucócitos e eritrócitos [punção lombar traumática] no LCR) estão associados a desfechos mais desfavoráveis. Consulte Critérios diagnósticos.
Exames por imagem
Uma radiografia torácica deve ser realizada para identificar uma massa mediastinal, derrame pleural ou infecção do trato respiratório inferior.[75]Smith WT, Shiao KT, Varotto E, et al. Evaluation of chest radiographs of children with newly diagnosed acute lymphoblastic leukemia. J Pediatr. 2020 Aug;223:120-127.e3.
http://www.ncbi.nlm.nih.gov/pubmed/32711740?tool=bestpractice.com
Os derrames pleurais devem ser coletados e as amostras devem ser enviadas para citologia e imunofenotipagem. A biópsia do mediastino deve ser evitada, se possível, embora este possa ser o sítio primário de envolvimento em alguns pacientes. Nesses casos ela é inevitável.
Deve-se realizar um exame de imagem do SNC (por exemplo, tomografia computadorizada [TC]/ressonância nuclear magnética [RNM] do cérebro) nos pacientes com sinais e sintomas neurológicos importantes (por exemplo, nível de consciência reduzido, meningismo ou sinais/deficits neurológicos focais) para identificar envolvimento meníngeo ou sangramento no SNC.[60]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: acute lymphoblastic leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
Pode ocorrer envolvimento da medula espinhal e do parênquima cerebral, embora muito raro.
A TC do tórax deve ser realizada na presença de um mediastino alargado à radiografia torácica. Uma TC do pescoço, do tórax, do abdome e da pelve deve ser realizada se houver linfadenopatia palpável ou outra evidência de doença extramedular.[60]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: acute lymphoblastic leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
Em homens com exame ou sintomas testiculares anormais, deve-se realizar uma ultrassonografia escrotal para caracterizar a natureza da anormalidade e estabelecer uma linha basal antes do início do tratamento.[60]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: acute lymphoblastic leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
A ecocardiografia ou a angiografia sincronizada multinuclear (MUGA) devem ser consideradas em todos os pacientes para avaliar a função cardíaca antes de se iniciar o tratamento.[60]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: acute lymphoblastic leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
As antraciclinas são usadas na maioria dos esquemas de tratamento para LLA e são potencialmente cardiotóxicas.[Figure caption and citation for the preceding image starts]: Radiografia torácica de paciente com dispneia, mostrando mediastino alargado e deslocamento da traqueiaDo acervo pessoal de CR Kelsey [Citation ends].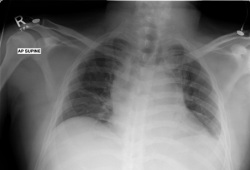
Outras investigações
Os seguintes exames podem ser realizados uma vez que o diagnóstico de LLA for confirmado:[60]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: acute lymphoblastic leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
[76]Relling MV, Schwab M, Whirl-Carrillo M, et al. Clinical pharmacogenetics implementation consortium guideline for thiopurine dosing based on TPMT and NUDT15 genotypes: 2018 update. Clin Pharmacol Ther. 2019 May;105(5):1095-105.
https://ascpt.onlinelibrary.wiley.com/doi/10.1002/cpt.1304
http://www.ncbi.nlm.nih.gov/pubmed/30447069?tool=bestpractice.com
Tipagem do antígeno leucocitário humano (HLA)
Fenotipagem da tiopurina metiltransferase (TPMT)
fenotipagem da nudix hidrolase 15 (NUDT15)
A tipagem do HLA é necessária para identificar um doador adequado para o transplante de células-tronco e para a obtenção de plaquetas com HLA compatíveis em caso de aloimunização plaquetária durante a transfusão plaquetária.
A fenotipagem de TPMT e NUDT15 ajuda a orientar a dosagem de mercaptopurina durante a terapia de manutenção.[76]Relling MV, Schwab M, Whirl-Carrillo M, et al. Clinical pharmacogenetics implementation consortium guideline for thiopurine dosing based on TPMT and NUDT15 genotypes: 2018 update. Clin Pharmacol Ther. 2019 May;105(5):1095-105.
https://ascpt.onlinelibrary.wiley.com/doi/10.1002/cpt.1304
http://www.ncbi.nlm.nih.gov/pubmed/30447069?tool=bestpractice.com


