Los pacientes con un aneurisma roto requieren reparación urgente.
Se indica la reparación en pacientes con aneurismas aórticos sintomáticos, independientemente de su diámetro.[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
[79]National Institute for Health and Care Excellence. Abdominal aortic aneurysm: diagnosis and management. Mar 2020 [internet publication].
https://www.nice.org.uk/guidance/ng156
[106]Authors/Task Force Members, Czerny M, Grabenwöger M, et al. EACTS/STS guidelines for diagnosing and treating acute and chronic syndromes of the Aortic Organ. Ann Thorac Surg. 2024 Jul;118(1):5-115.
https://www.annalsthoracicsurgery.org/article/S0003-4975(24)00077-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38416090?tool=bestpractice.com
Para los AAA asintomáticos detectados como un hallazgo incidental, se prefiere la vigilancia para reparar hasta que el riesgo teórico de ruptura supere el riesgo estimado de mortalidad quirúrgica. En general, está indicada la reparación en pacientes con aneurisma de aorta abdominal (AAA) asintomático de gran tamaño (p. ej., con un diámetro que excede los 5.5 cm en hombres, o 5.0 cm en mujeres, en los EE. UU., aunque las decisiones de tratamiento basadas en un tamaño mayor pueden diferir en otros países (como p. ej. en el Reino Unido).[1]Dehlin JM, Upchurch GR. Management of abdominal aortic aneurysms. Curr Treat Options Cardiovasc Med. 2005 Jun;7(2):119-30.
http://www.ncbi.nlm.nih.gov/pubmed/15935120?tool=bestpractice.com
[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
[79]National Institute for Health and Care Excellence. Abdominal aortic aneurysm: diagnosis and management. Mar 2020 [internet publication].
https://www.nice.org.uk/guidance/ng156
[107]Lederle FA, Wilson SE, Johnson GR, et al; Aneurysm Detection and Management Veterans Affairs Cooperative Study Group. Immediate repair compared with surveillance of small abdominal aortic aneurysms. N Engl J Med. 2002 May 9;346(19):1437-44.
http://www.ncbi.nlm.nih.gov/pubmed/12000813?tool=bestpractice.com
[108]UK Small Aneurysm Trial Participants. Mortality results for randomized controlled trial of early elective surgery or ultrasonographic surveillance for small abdominal aortic aneurysms. Lancet. 1998 Nov 21;352(9141):1649-55.
http://www.ncbi.nlm.nih.gov/pubmed/9853436?tool=bestpractice.com
[109]Powell JT, Brady AR, Brown LC, et al; United Kingdom Small Aneurysm Trial Participants. Long-term outcomes of immediate repair compared with surveillance of small abdominal aortic aneurysms. N Engl J Med. 2002 May 9;346(19):1445-52.
https://www.nejm.org/doi/full/10.1056/NEJMoa013527
http://www.ncbi.nlm.nih.gov/pubmed/12000814?tool=bestpractice.com
[110]Powell JT, Brown LC, Forbes JF, et al. Final 12-year follow-up of surgery versus surveillance in the UK Small Aneurysm Trial. Br J Surg. 2007 Jun;94(6):702-8.
http://www.ncbi.nlm.nih.gov/pubmed/17514693?tool=bestpractice.com
La reparación de aneurismas asintomáticos, sintomáticos y rotos puede lograrse usando una técnica endovascular o quirúrgica abierta; la selección de la técnica quirúrgica debe tener en cuenta la preferencia del paciente, edad, sexo, factores de riesgo perioperatorios y factores anatómicos. Se recomienda un enfoque de toma de decisiones compartida que tenga en cuenta los riesgos y beneficios de los procedimientos.[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
Rotura de AAA
Los pacientes que presentan la tríada de dolor de espalda y/o dolor abdominal, masa abdominal pulsátil e hipotensión justifican la reanimación inmediata y la evaluación quirúrgica, ya que la reparación constituye la única cura potencial.[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
[111]Harkin DW, Dillon M, Blair PH, et al. Endovascular ruptured abdominal aortic aneurysm repair (EVRAR): a systematic review. Eur J Vasc Endovasc Surg. 2007 Dec;34(6):673-81.
http://www.ncbi.nlm.nih.gov/pubmed/17719809?tool=bestpractice.com
Sin embargo, la mayoría de los pacientes con rotura no sobrevivirán hasta llegar al quirófano.[Figure caption and citation for the preceding image starts]: Tomografía computarizada de un AAA rotoUniversity of Michigan, específicamente los casos del Dr. Upchurch que reflejan los Departamentos de Cirugía Vascular y Radiología [Citation ends].
El American College of Cardiology/American Heart Association (ACC/AHA) recomienda realizar una tomografía computarizada (TC) a los pacientes que presenten un AAA roto y se encuentren hemodinámicamente estables para evaluar si el AAA es susceptible de reparación endovascular.[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
Esta recomendación está respaldada por los resultados del ensayo controlado aleatorizado multicéntrico IMPROVE, que sugieren que, para la mayoría de los pacientes, la TC confirmatoria no añadió retrasos significativos al tratamiento y facilitó una planificación preoperatoria adecuada.[112]Powell JT, Hinchcliffe RJ, Thompson MM, et al; IMPROVE Trial Investigators. Observations from the IMPROVE trial concerning the clinical care of patients with ruptured abdominal aortic aneurysm. Br J Surg. 2014 Feb;101(3):216-24.
https://bjssjournals.onlinelibrary.wiley.com/doi/full/10.1002/bjs.9410
http://www.ncbi.nlm.nih.gov/pubmed/24469620?tool=bestpractice.com
Si la anatomía es adecuada, el ACC/AHA recomienda la reparación endovascular frente a la reparación abierta para reducir el riesgo de morbilidad y mortalidad.[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
En pacientes con rotura de AAA confirmada, la mortalidad a 3 años fue menor entre aquellos asignados al azar a reparación endovascular de aneurisma (EVAR) que a una estrategia de reparación abierta (48% frente a 56%; cociente de riesgo [HR] 0.57, IC 95%: 0.36 a 0.90).[113]IMPROVE Trial Investigators. Comparative clinical effectiveness and cost effectiveness of endovascular strategy v open repair for ruptured abdominal aortic aneurysm: three year results of the IMPROVE randomised trial. BMJ. 2017 Nov 14;359:j4859.
https://www.bmj.com/content/359/bmj.j4859.long
http://www.ncbi.nlm.nih.gov/pubmed/29138135?tool=bestpractice.com
La diferencia entre grupos de tratamiento no fue evidente después de 7 años de seguimiento (HR 0.92, IC 95%: 0.75 a 1.13). Las tasas de reintervención no fueron significativamente diferentes entre los grupos aleatorizados a los 3 años (HR 1.02, IC 95%: 0.79 a 1.32).[113]IMPROVE Trial Investigators. Comparative clinical effectiveness and cost effectiveness of endovascular strategy v open repair for ruptured abdominal aortic aneurysm: three year results of the IMPROVE randomised trial. BMJ. 2017 Nov 14;359:j4859.
https://www.bmj.com/content/359/bmj.j4859.long
http://www.ncbi.nlm.nih.gov/pubmed/29138135?tool=bestpractice.com
Hay algunas pruebas que sugieren que una estrategia endovascular para la reparación de la ruptura de AAA puede reducir la mortalidad con mayor efectividad en mujeres que en hombres.[113]IMPROVE Trial Investigators. Comparative clinical effectiveness and cost effectiveness of endovascular strategy v open repair for ruptured abdominal aortic aneurysm: three year results of the IMPROVE randomised trial. BMJ. 2017 Nov 14;359:j4859.
https://www.bmj.com/content/359/bmj.j4859.long
http://www.ncbi.nlm.nih.gov/pubmed/29138135?tool=bestpractice.com
[114]Sweeting MJ, Balm R, Desgranges P, et al; Ruptured Aneurysm Trialists. Individual-patient meta-analysis of three randomized trials comparing endovascular versus open repair for ruptured abdominal aortic aneurysm. Br J Surg. 2015 Sep;102(10):1229-39.
https://bjssjournals.onlinelibrary.wiley.com/doi/full/10.1002/bjs.9852
http://www.ncbi.nlm.nih.gov/pubmed/26104471?tool=bestpractice.com
Hay algunas evidencias que sugieren que el modo de anestesia para la reparación quirúrgica del AAA afecta a los resultados.[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
[115]Armstrong RA, Squire YG, Rogers CA, et al. Type of anesthesia for endovascular abdominal aortic aneurysm repair. J Cardiothorac Vasc Anesth. 2019 Feb;33(2):462-71.
http://www.ncbi.nlm.nih.gov/pubmed/30342821?tool=bestpractice.com
En 2024, la Sociedad Europea de Cirugía Vascular (ESVS) emitió una recomendación débil que favorecía la anestesia local sobre la anestesia general en entornos electivos, basándose en la posible reducción del tiempo del procedimiento, los ingresos en la UCI y la estancia hospitalaria postoperatoria.[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
[116]Liu Y, Wang T, Zhao J, et al. Influence of anesthetic techniques on perioperative outcomes after endovascular aneurysm repair. Ann Vasc Surg. 2021 May;73:375-84.
http://www.ncbi.nlm.nih.gov/pubmed/33383135?tool=bestpractice.com
[117]Zottola ZR, Kruger JL, Kong DS, et al. Locoregional anesthesia is associated with reduced hospital stay and need for intensive care unit care of elective endovascular aneurysm repair patients in the Vascular Quality Initiative. J Vasc Surg. 2023 Apr;77(4):1061-9.
https://www.jvascsurg.org/article/S0741-5214(22)02534-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/36400363?tool=bestpractice.com
[118]Kothandan H, Haw Chieh GL, Khan SA, et al. Anesthetic considerations for endovascular abdominal aortic aneurysm repair. Ann Card Anaesth. 2016 Jan-Mar;19(1):132-41.
https://pmc.ncbi.nlm.nih.gov/articles/PMC4900395
http://www.ncbi.nlm.nih.gov/pubmed/26750684?tool=bestpractice.com
El ensayo controlado aleatorizado multicéntrico IMPROVE (Immediate Management of Patients with Rupture: Open Versus Endovascular Repair) detectó una reducción significativa de la mortalidad a los 30 días en los pacientes sometidos a RVA bajo anestesia local en solitario, en comparación con anestesia general (OR ajustada 0.27, 0.1 a 0.7).[112]Powell JT, Hinchcliffe RJ, Thompson MM, et al; IMPROVE Trial Investigators. Observations from the IMPROVE trial concerning the clinical care of patients with ruptured abdominal aortic aneurysm. Br J Surg. 2014 Feb;101(3):216-24.
https://bjssjournals.onlinelibrary.wiley.com/doi/full/10.1002/bjs.9410
http://www.ncbi.nlm.nih.gov/pubmed/24469620?tool=bestpractice.com
Un metanálisis independiente en el que se comparó el modo de anestesia para la reparación endovascular de la rotura del AAA replicó estos hallazgos o mejoró los resultados con la EVAR bajo anestesia local.[119]Harky A, Ahmad MU, Santoro G, et al. Local versus general anesthesia in nonemergency endovascular abdominal aortic aneurysm repair: a systematic review and meta-analysis. J Cardiothorac Vasc Anesth. 2020 Apr;34(4):1051-9.
http://www.ncbi.nlm.nih.gov/pubmed/31473112?tool=bestpractice.com
Sin embargo, otra revisión sistemática no mostró ningún beneficio en cuanto a mortalidad con la anestesia local, pero sí demostró estancias hospitalarias más cortas.[120]Deng J, Liu J, Rong D, et al. A meta-analysis of locoregional anesthesia versus general anesthesia in endovascular repair of ruptured abdominal aortic aneurysm. J Vasc Surg. 2021 Feb;73(2):700-10.
https://www.doi.org/10.1016/j.jvs.2020.08.112
http://www.ncbi.nlm.nih.gov/pubmed/32882348?tool=bestpractice.com
Los datos del Registro Vascular Nacional del Reino Unido (9783 pacientes que recibieron un EVAR infrarrenal estándar electivo; anestesia general, n = 7069; anestesia regional, n = 2347; anestesia local, n = 367) mostraron una tasa de mortalidad más baja a los 30 días después de la anestesia regional en comparación con la general.[121]Dovell G, Rogers CA, Armstrong R, et al. The effect of mode of anaesthesia on outcomes after elective endovascular repair of abdominal aortic aneurysm. Eur J Vasc Endovasc Surg. 2020 May;59(5):729-38.
https://www.ejves.com/article/S1078-5884(20)30118-0/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/32291124?tool=bestpractice.com
El estudio multicéntrico internacional Endurant Stent Graft Natural Selection Global Post-Market Registry (ENGAGE) examinó los resultados de 1231 pacientes sometidos a EVAR bajo anestesia general (62% de los pacientes), regional (27%) y local (11%).[122]Broos PP, Stokmans RA, Cuypers PW, et al. Effects of anesthesia type on perioperative outcome after endovascular aneurysm repair. J Endovasc Ther. 2015 Oct;22(5):770-7.
http://www.ncbi.nlm.nih.gov/pubmed/26276553?tool=bestpractice.com
El tipo de anestesia no influyó en la mortalidad o morbilidad perioperatoria, pero el uso de anestesia local o regional durante la EVAR pareció ser beneficioso en la disminución del tiempo del procedimiento, la necesidad de ingreso en la UCI y la duración de la estancia hospitalaria postoperatoria.[122]Broos PP, Stokmans RA, Cuypers PW, et al. Effects of anesthesia type on perioperative outcome after endovascular aneurysm repair. J Endovasc Ther. 2015 Oct;22(5):770-7.
http://www.ncbi.nlm.nih.gov/pubmed/26276553?tool=bestpractice.com
Tratamiento complementario de la rotura de AAA
Deben iniciarse inmediatamente las medidas de reanimación estándar. Entre estas se incluyen:
Manejo de las vías respiratorias (oxigenoterapia o intubación endotraqueal y ventilación asistida si el paciente está inconsciente).
Acceso intravenoso (catéter venoso central).
Sonda arterial; sonda urinaria.
Fluidoterapia hipotensa: la rehidratación agresiva puede causar coagulopatía por dilución y por hipotermia y puede provocar la destrucción de coágulos secundaria debido al aumento del flujo sanguíneo, el aumento de la presión de perfusión y la reducción de la viscosidad de la sangre que produce la exacerbación del sangrado.[123]Roberts K, Revell M, Youssef H, et al. Hypotensive resuscitation in patients with ruptured abdominal aortic aneurysm. Eur J Vasc Endovasc Surg. 2006 Apr;31(4):339-44.
http://www.ncbi.nlm.nih.gov/pubmed/16388972?tool=bestpractice.com
[124]Ohki T, Veith FJ. Endovascular grafts and other image-guided catheter-based adjuncts to improve the treatment of ruptured aortoiliac aneurysms. Ann Surg. 2000 Oct;232(4):466-79.
http://www.ncbi.nlm.nih.gov/pubmed/10998645?tool=bestpractice.com
En el preoperatorio se recomienda una presión arterial sistólica (PAS) de 50-70 mmHg y la retención de líquidos.[123]Roberts K, Revell M, Youssef H, et al. Hypotensive resuscitation in patients with ruptured abdominal aortic aneurysm. Eur J Vasc Endovasc Surg. 2006 Apr;31(4):339-44.
http://www.ncbi.nlm.nih.gov/pubmed/16388972?tool=bestpractice.com
[124]Ohki T, Veith FJ. Endovascular grafts and other image-guided catheter-based adjuncts to improve the treatment of ruptured aortoiliac aneurysms. Ann Surg. 2000 Oct;232(4):466-79.
http://www.ncbi.nlm.nih.gov/pubmed/10998645?tool=bestpractice.com
Las guías de práctica clínica del ACC/AHA recomiendan la hipotensión permisiva para reducir el sangrado.[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
Sin embargo, los objetivos recomendados varían y no existe consenso entre los grupos de guías de práctica clínica mundiales.
El ensayo controlado aleatorizado multicéntrico IMPROVE descubrió que la PAS más baja se asociaba de forma significativa e independiente con la mortalidad a 30 días en pacientes con rotura de AAA, y que un objetivo de PAS inferior a 70 mmHg en pacientes de edad avanzada puede haber contribuido a peores resultados.[112]Powell JT, Hinchcliffe RJ, Thompson MM, et al; IMPROVE Trial Investigators. Observations from the IMPROVE trial concerning the clinical care of patients with ruptured abdominal aortic aneurysm. Br J Surg. 2014 Feb;101(3):216-24.
https://bjssjournals.onlinelibrary.wiley.com/doi/full/10.1002/bjs.9410
http://www.ncbi.nlm.nih.gov/pubmed/24469620?tool=bestpractice.com
En las personas con rotura de AAA con una PAS preoperatoria registrada inferior a 70 mmHg, la mortalidad a los 30 días fue mayor (51.0%) en comparación con las que presentaban una PAS superior a 70 mmHg (34.1%).[112]Powell JT, Hinchcliffe RJ, Thompson MM, et al; IMPROVE Trial Investigators. Observations from the IMPROVE trial concerning the clinical care of patients with ruptured abdominal aortic aneurysm. Br J Surg. 2014 Feb;101(3):216-24.
https://bjssjournals.onlinelibrary.wiley.com/doi/full/10.1002/bjs.9410
http://www.ncbi.nlm.nih.gov/pubmed/24469620?tool=bestpractice.com
Una revisión de la Cochrane de hipotensión controlada (permisiva) versus estrategia de reanimación normotensiva para personas con rotura de AAA, que incluyó el ensayo IMPROVE, observó que las personas con rotura de AAA suelen ser de edad avanzada y tienen más probabilidades de presentar enfermedad aterosclerótica coronaria y renal. Estos pacientes también presentan un mayor riesgo de infarto de miocardio e insuficiencia renal si se someten a niveles bajos de PAS en comparación con las personas más jóvenes con traumatismos.[125]Moreno DH, Cacione DG, Baptista-Silva JC. Controlled hypotension versus normotensive resuscitation strategy for people with ruptured abdominal aortic aneurysm. Cochrane Database Syst Rev. 2018 Jun 13;6(6):CD011664.
https://www.doi.org/10.1002/14651858.CD011664.pub3
http://www.ncbi.nlm.nih.gov/pubmed/29897100?tool=bestpractice.com
Disponibilidad y transfusión de hemoderivados (eritrocitos concentrados, plaquetas y plasma fresco congelado) para la reanimación, la anemia grave y la coagulopatía.
Notificar a los equipos de anestesia, unidad de cuidados intensivos (UCI) y de cirugía.
Aneurisma de aorta abdominal sintomático pero sin rotura
En pacientes con aneurisma aórtico sintomático, la reparación urgente está indicada independientemente del diámetro.[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
[79]National Institute for Health and Care Excellence. Abdominal aortic aneurysm: diagnosis and management. Mar 2020 [internet publication].
https://www.nice.org.uk/guidance/ng156
[106]Authors/Task Force Members, Czerny M, Grabenwöger M, et al. EACTS/STS guidelines for diagnosing and treating acute and chronic syndromes of the Aortic Organ. Ann Thorac Surg. 2024 Jul;118(1):5-115.
https://www.annalsthoracicsurgery.org/article/S0003-4975(24)00077-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38416090?tool=bestpractice.com
[129]Mazzolai L, Teixido-Tura G, Lanzi S, et al; ESC Committee for Practice Guidelines. 2024 ESC guidelines for the management of peripheral arterial and aortic diseases. Eur Heart J. 2024 Sep 29;45(36):3538-700.
https://academic.oup.com/eurheartj/article/45/36/3538/7738955
La aparición de un dolor nuevo o que empeora puede anunciar la expansión del aneurisma y su rotura inminente. Por lo tanto, es más conveniente tratar el aneurisma sintomático sin rotura con urgencia.[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
En algunas circunstancias, la intervención puede retrasarse varias horas para optimizar las condiciones y garantizar el éxito de la reparación; se debe monitorizar a estos pacientes estrictamente en la UCI.[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
La reparación endovascular (EVAR) se utiliza cada vez más en el manejo de pacientes con AAA sintomático.[130]De Martino RR, Nolan BW, Goodney PP, Chang CK, et al; Vascular Study Group of Northern New England. Outcomes of symptomatic abdominal aortic aneurysm repair. J Vasc Surg. 2010 Jul;52(1):5-12.e1.
https://www.jvascsurg.org/article/S0741-5214(10)00259-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/20471771?tool=bestpractice.com
[131]Chandra V, Trang K, Virgin-Downey W, et al. Management and outcomes of symptomatic abdominal aortic aneurysms during the past 20 years. J Vasc Surg. 2017 Dec;66(6):1679-85.
http://www.ncbi.nlm.nih.gov/pubmed/28619644?tool=bestpractice.com
En los estudios observacionales, las tasas de mortalidad por todas las causas a corto plazo no difirieron entre la reparación endovascular y la reparación abierta del AAA sintomático.[130]De Martino RR, Nolan BW, Goodney PP, Chang CK, et al; Vascular Study Group of Northern New England. Outcomes of symptomatic abdominal aortic aneurysm repair. J Vasc Surg. 2010 Jul;52(1):5-12.e1.
https://www.jvascsurg.org/article/S0741-5214(10)00259-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/20471771?tool=bestpractice.com
[131]Chandra V, Trang K, Virgin-Downey W, et al. Management and outcomes of symptomatic abdominal aortic aneurysms during the past 20 years. J Vasc Surg. 2017 Dec;66(6):1679-85.
http://www.ncbi.nlm.nih.gov/pubmed/28619644?tool=bestpractice.com
[132]Ten Bosch JA, Willigendael EM, Kruidenier LM, et al. Early and mid-term results of a prospective observational study comparing emergency endovascular aneurysm repair with open surgery in both ruptured and unruptured acute abdominal aortic aneurysms. Vascular. 2012 Apr;20(2):72-80.
http://www.ncbi.nlm.nih.gov/pubmed/22454547?tool=bestpractice.com
Los datos del American College of Surgeons National Surgical Quality Improvement Program entre 2011 y 2013 sugieren que el riesgo de mortalidad a los 30 días después de la reparación del AAA sintomático fue aproximadamente el doble que después de la reparación del AAA asintomático, independientemente del enfoque quirúrgico (EVAR: sintomático 3.8% frente a asintomático 1.4%; P=0.001; cirugía abierta: sintomática 7.7% frente a asintomática 4.3%; P=0.08).[133]Soden PA, Zettervall SL, Ultee KH, et al. Outcomes for symptomatic abdominal aortic aneurysms in the American College of Surgeons National Surgical Quality Improvement Program. J Vasc Surg. 2016 Aug;64(2):297-305.
https://www.jvascsurg.org/article/S0741-5214(16)00320-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/27146791?tool=bestpractice.com
El menor número de pacientes probablemente contribuya al hallazgo no estadísticamente significativo informado para la reparación abierta.
Hallazgo incidental de AAA de pequeño tamaño
Para los aneurismas de aorta abdominal (AAA) detectados de manera incidental, se prefiere la vigilancia para reparar hasta que el riesgo teórico de rotura supere el riesgo estimado de mortalidad quirúrgica.[4]Owens DK, Davidson KW, Krist AH, et al; US Preventive Services Task Force. Screening for abdominal aortic aneurysm: US Preventive Services Task Force recommendation statement. JAMA. 2019 Dec 10;322(22):2211-8.
https://jamanetwork.com/journals/jama/fullarticle/2757234
http://www.ncbi.nlm.nih.gov/pubmed/31821437?tool=bestpractice.com
La cirugía temprana para el tratamiento de los AAA más pequeños no reduce la mortalidad por todas las causas o específica de los AAA.[4]Owens DK, Davidson KW, Krist AH, et al; US Preventive Services Task Force. Screening for abdominal aortic aneurysm: US Preventive Services Task Force recommendation statement. JAMA. 2019 Dec 10;322(22):2211-8.
https://jamanetwork.com/journals/jama/fullarticle/2757234
http://www.ncbi.nlm.nih.gov/pubmed/31821437?tool=bestpractice.com
[134]Ulug P, Powell JT, Martinez MA, et al. Surgery for small asymptomatic abdominal aortic aneurysms. Cochrane Database Syst Rev. 2020 Jul 1;7(7):CD001835.
https://www.doi.org/10.1002/14651858.CD001835.pub5
http://www.ncbi.nlm.nih.gov/pubmed/32609382?tool=bestpractice.com
[  ]
How does immediate surgery compare with surveillance in people with asymptomatic abdominal aortic aneurysms (AAAs)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.3227/fullMostrarme la respuesta Una revisión sistemática (4 ensayos, 3314 participantes) encontró evidencia de alta calidad que demuestra que la reparación inmediata del AAA pequeño (de 4 cm a 5.5 cm) no mejoró la supervivencia a largo plazo, en comparación con la vigilancia (CRI ajustado 0.88, IC del 95%: 0.75 a 1.02; seguimiento medio de 10 años).[134]Ulug P, Powell JT, Martinez MA, et al. Surgery for small asymptomatic abdominal aortic aneurysms. Cochrane Database Syst Rev. 2020 Jul 1;7(7):CD001835.
https://www.doi.org/10.1002/14651858.CD001835.pub5
http://www.ncbi.nlm.nih.gov/pubmed/32609382?tool=bestpractice.com
La falta de beneficio atribuible a la cirugía inmediata fue consistente, independientemente de la edad del paciente, el diámetro del aneurisma pequeño y si la reparación fue endovascular o abierta.[134]Ulug P, Powell JT, Martinez MA, et al. Surgery for small asymptomatic abdominal aortic aneurysms. Cochrane Database Syst Rev. 2020 Jul 1;7(7):CD001835.
https://www.doi.org/10.1002/14651858.CD001835.pub5
http://www.ncbi.nlm.nih.gov/pubmed/32609382?tool=bestpractice.com
]
How does immediate surgery compare with surveillance in people with asymptomatic abdominal aortic aneurysms (AAAs)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.3227/fullMostrarme la respuesta Una revisión sistemática (4 ensayos, 3314 participantes) encontró evidencia de alta calidad que demuestra que la reparación inmediata del AAA pequeño (de 4 cm a 5.5 cm) no mejoró la supervivencia a largo plazo, en comparación con la vigilancia (CRI ajustado 0.88, IC del 95%: 0.75 a 1.02; seguimiento medio de 10 años).[134]Ulug P, Powell JT, Martinez MA, et al. Surgery for small asymptomatic abdominal aortic aneurysms. Cochrane Database Syst Rev. 2020 Jul 1;7(7):CD001835.
https://www.doi.org/10.1002/14651858.CD001835.pub5
http://www.ncbi.nlm.nih.gov/pubmed/32609382?tool=bestpractice.com
La falta de beneficio atribuible a la cirugía inmediata fue consistente, independientemente de la edad del paciente, el diámetro del aneurisma pequeño y si la reparación fue endovascular o abierta.[134]Ulug P, Powell JT, Martinez MA, et al. Surgery for small asymptomatic abdominal aortic aneurysms. Cochrane Database Syst Rev. 2020 Jul 1;7(7):CD001835.
https://www.doi.org/10.1002/14651858.CD001835.pub5
http://www.ncbi.nlm.nih.gov/pubmed/32609382?tool=bestpractice.com
La derivación quirúrgica de los AAA más pequeños generalmente se reserva para el crecimiento rápido, o una vez que se alcanza el diámetro umbral para la reparación del aneurisma en una ecografía repetida.[4]Owens DK, Davidson KW, Krist AH, et al; US Preventive Services Task Force. Screening for abdominal aortic aneurysm: US Preventive Services Task Force recommendation statement. JAMA. 2019 Dec 10;322(22):2211-8.
https://jamanetwork.com/journals/jama/fullarticle/2757234
http://www.ncbi.nlm.nih.gov/pubmed/31821437?tool=bestpractice.com
Sin embargo, en pacientes con una causa genética subyacente o un trastorno del tejido conectivo, deberá individualizarse el diámetro umbral para considerar la reparación, en función de:[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
Características anatómicas
Genética subyacente: el riesgo de ruptura es mayor en diámetros aórticos más pequeños en algunas afecciones, y la reparación quirúrgica es más difícil en determinados trastornos debido al aumento de la fragilidad de la pared arterial y la anatomía[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
Los objetivos médicos para los aneurismas asintomáticos pequeños incluyen los siguientes:
1. Vigilancia:
Las guías de práctica clínica del American College of Cardiology Foundation y de la American Heart Association recomiendan que los AAA infra/yuxtarrenales que miden de 4.0 a 4.9 cm de diámetro obtenidos por ecografía/TC se monitoricen cada 6 a 12 meses.[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
Una vez superados los 4.5 cm en las mujeres y los 5 cm en los hombres, estas guías de práctica clínica recomiendan la vigilancia cada 6 meses.[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
AAA <3.9 cm puede monitorizarse con ecografía cada 2-3 años.[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
El Servicio Nacional de Salud del Reino Unido recomienda que se utilicen intervalos anuales de detección para los AAA de 3.0 a 4.4 cm e intervalos de 3 meses para los AAA de 4.5 a 5.4 cm.[135]Public Health England. NHS public health functions agreement 2019-20. Service specification no.23. NHS Abdominal Aortic Aneurysm Screening Programme. July 2019 [internet publication].
https://www.england.nhs.uk/wp-content/uploads/2017/04/Service-Specification-No.23-Abdominal_Aortic_Aneurysm.pdf
Una revisión sistemática y un metanálisis de los datos de pacientes individuales concluyeron que los intervalos de vigilancia de 2 años para los AAA de 3.0 a 4.4 cm y de 6 meses para los AAA de 4.5 a 5.4 cm son seguros y coste-eficientes.[105]Thompson S, Brown L, Sweeting M, et al; RESCAN Collaborators. Systematic review and meta-analysis of the growth and rupture rates of small abdominal aortic aneurysms: implications for surveillance intervals and their cost-effectiveness. Health Technol Assess. 2013 Sep;17(41):1-118.
https://www.journalslibrary.nihr.ac.uk/hta/hta17410/#/full-report
http://www.ncbi.nlm.nih.gov/pubmed/24067626?tool=bestpractice.com
El análisis de las tasas de crecimiento y rotura de los AAA indicó que, para mantener un riesgo de rotura del AAA <1%, se requiere un intervalo de vigilancia de 8.5 años para los hombres con un diámetro inicial de AAA de 3.0 cm.[105]Thompson S, Brown L, Sweeting M, et al; RESCAN Collaborators. Systematic review and meta-analysis of the growth and rupture rates of small abdominal aortic aneurysms: implications for surveillance intervals and their cost-effectiveness. Health Technol Assess. 2013 Sep;17(41):1-118.
https://www.journalslibrary.nihr.ac.uk/hta/hta17410/#/full-report
http://www.ncbi.nlm.nih.gov/pubmed/24067626?tool=bestpractice.com
El intervalo de vigilancia estimado correspondiente para los hombres con un diámetro inicial de aneurisma de 5.0 cm fue de 17 meses. A pesar de tener tasas similares de crecimiento de los aneurismas de pequeño tamaño, las tasas de rotura fueron 4 veces más altas en las mujeres que en los hombres.[105]Thompson S, Brown L, Sweeting M, et al; RESCAN Collaborators. Systematic review and meta-analysis of the growth and rupture rates of small abdominal aortic aneurysms: implications for surveillance intervals and their cost-effectiveness. Health Technol Assess. 2013 Sep;17(41):1-118.
https://www.journalslibrary.nihr.ac.uk/hta/hta17410/#/full-report
http://www.ncbi.nlm.nih.gov/pubmed/24067626?tool=bestpractice.com
Es necesario adaptar los programas de vigilancia y los criterios para considerar la cirugía para las mujeres con los AAA que se detectan oportunamente.
La mayoría de los AAA muestran un crecimiento lineal; la modelización basada en esto sugiere que los AAA más pequeños (<4,25 cm) podrían ser objeto de seguimiento cada 2 años, con una probabilidad mínima de superar los umbrales de intervención en ese plazo.[136]Kim GY, Corriere MA. Balancing watching vs waiting during imaging surveillance of small abdominal aortic aneurysms. JAMA Surg. 2021 Apr 1;156(4):370-1.
http://www.ncbi.nlm.nih.gov/pubmed/33595617?tool=bestpractice.com
[137]Olson SL, Wijesinha MA, Panthofer AM, et al. Evaluating growth patterns of abdominal aortic aneurysm diameter with serial computed tomography surveillance. JAMA Surg. 2021 Apr 1;156(4):363-70.
https://www.doi.org/10.1001/jamasurg.2020.7190
http://www.ncbi.nlm.nih.gov/pubmed/33595625?tool=bestpractice.com
Un crecimiento aneurismático de ≥0.5 cm en 6 meses puede ser una indicación de reparación, para reducir el riesgo de ruptura.[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
El ESVS recomienda la incorporación de las aortas subaneurismáticas (2.5 a 2.9 cm) en las recomendaciones de vigilancia del AAA, ya que los estudios de cohortes a largo plazo muestran que la mayoría de las aortas subaneurismáticas acaban avanzando a un AAA, de los cuales una proporción sustancial alcanzará el umbral de diámetro para considerar la reparación.[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
Las decisiones de vigilancia deben tener en cuenta la esperanza de vida, la idoneidad para futuras reparaciones y las preferencias del paciente.[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
2. Control de los factores de riesgo modificables de expansión y rotura:
Abandono del hábito de fumar: tratamiento sustitutivo con nicotina, nortriptilina y bupropión o asesoramiento.[1]Dehlin JM, Upchurch GR. Management of abdominal aortic aneurysms. Curr Treat Options Cardiovasc Med. 2005 Jun;7(2):119-30.
http://www.ncbi.nlm.nih.gov/pubmed/15935120?tool=bestpractice.com
[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
[13]Zankl AR, Schumacher H, Krumsdorf U, et al. Pathology, natural history and treatment of abdominal aortic aneurysms. Clin Res Cardiol. 2007 Mar;96(3):140-51.
http://www.ncbi.nlm.nih.gov/pubmed/17180573?tool=bestpractice.com
[15]Singh K, Bønaa H, Jacobsen BK, et al. Prevalence of and risk factors for abdominal aortic aneurysms in a population-based study: the Tromsø Study. Am J Epidemiol. 2001 Aug 1;154(3):236-44.
https://academic.oup.com/aje/article/154/3/236/125840
http://www.ncbi.nlm.nih.gov/pubmed/11479188?tool=bestpractice.com
[22]Lederle FA, Johnson GR, Wilson SE, et al; Aneurysm Detection and Management (ADAM) Veterans Affairs Cooperative Study Group. Prevalence and associations of abdominal aortic aneurysm detected through screening. Ann Intern Med. 1997 Mar 15;126(6):441-9.
http://www.ncbi.nlm.nih.gov/pubmed/9072929?tool=bestpractice.com
[23]Wilmink TB, Quick CR, Day NE. The association between cigarette smoking and abdominal aortic aneurysms. J Vasc Surg. 1999 Dec;30(6):1099-105.
http://www.ncbi.nlm.nih.gov/pubmed/10587395?tool=bestpractice.com
[138]Hartmann-Boyce J, Chepkin SC, Ye W, et al. Nicotine replacement therapy versus control for smoking cessation. Cochrane Database Syst Rev. 2018 May 31;5:CD000146.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD000146.pub5/full
http://www.ncbi.nlm.nih.gov/pubmed/29852054?tool=bestpractice.com
[139]Rigotti NA, Clair C, Munafò MR, et al. Interventions for smoking cessation in hospitalised patients. Cochrane Database Syst Rev. 2012 May 16;(5):CD001837.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001837.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/22592676?tool=bestpractice.com
[140]Howes S, Hartmann-Boyce J, Livingstone-Banks J, et al. Antidepressants for smoking cessation. Cochrane Database Syst Rev. 2020 Apr 22;(4):CD000031.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD000031.pub5/full
http://www.ncbi.nlm.nih.gov/pubmed/32319681?tool=bestpractice.com
[  ]
What are the effects of adding bupropion or fluoxetine to other treatments compared with using other treatments alone for people trying to quit smoking?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4337/fullMostrarme la respuesta
]
What are the effects of adding bupropion or fluoxetine to other treatments compared with using other treatments alone for people trying to quit smoking?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4337/fullMostrarme la respuesta
El tratamiento a corto plazo con betabloqueantes no parece reducir la tasa de expansión de los AAA.[4]Owens DK, Davidson KW, Krist AH, et al; US Preventive Services Task Force. Screening for abdominal aortic aneurysm: US Preventive Services Task Force recommendation statement. JAMA. 2019 Dec 10;322(22):2211-8.
https://jamanetwork.com/journals/jama/fullarticle/2757234
http://www.ncbi.nlm.nih.gov/pubmed/31821437?tool=bestpractice.com
[141]Siordia JA. Beta-blockers and abdominal aortic aneurysm growth: a systematic review and meta-analysis. Curr Cardiol Rev. 2021;17(4):e230421187502.
http://www.ncbi.nlm.nih.gov/pubmed/33143615?tool=bestpractice.com
Los ensayos en los que pacientes con pequeños AAA fueron asignados aleatoriamente a propranolol, y a otros betabloqueantes, con la intención de reducir la tasa de expansión del aneurisma no lograron demostrar efectos protectores significativos.[141]Siordia JA. Beta-blockers and abdominal aortic aneurysm growth: a systematic review and meta-analysis. Curr Cardiol Rev. 2021;17(4):e230421187502.
http://www.ncbi.nlm.nih.gov/pubmed/33143615?tool=bestpractice.com
[142]Rughani G, Robertson L, Clarke M. Medical treatment for small abdominal aortic aneurysms. Cochrane Database Syst Rev. 2012 Sep 12;(9):CD009536.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD009536.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/22972146?tool=bestpractice.com
En estos estudios el propranolol fue mal tolerado.[142]Rughani G, Robertson L, Clarke M. Medical treatment for small abdominal aortic aneurysms. Cochrane Database Syst Rev. 2012 Sep 12;(9):CD009536.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD009536.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/22972146?tool=bestpractice.com
3. Manejo agresivo de otra enfermedad cardiovascular:
Los factores de riesgo cardiovascular modificables como la hipertensión y la hiperlipidemia deben ser tratados.[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
[79]National Institute for Health and Care Excellence. Abdominal aortic aneurysm: diagnosis and management. Mar 2020 [internet publication].
https://www.nice.org.uk/guidance/ng156
Las estatinas deben iniciarse al menos 1 mes antes de la cirugía para reducir la morbilidad y mortalidad cardiovascular, y continuarse indefinidamente.[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
[143]Risum Ø, Sandven I, Sundhagen JO, et al. Editor's choice - effect of statins on total mortality in abdominal aortic aneurysm repair: a systematic review and meta-analysis. Eur J Vasc Endovasc Surg. 2021 Jan;61(1):114-20.
https://www.doi.org/10.1016/j.ejvs.2020.08.007
http://www.ncbi.nlm.nih.gov/pubmed/32928667?tool=bestpractice.com
La evidencia es limitada, pero en ausencia de contraindicaciones, los pacientes con AAA deben recibir un tratamiento antiplaquetario único (ácido acetilsalicílico o clopidogrel).[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
[144]Aboyans V, Bauersachs R, Mazzolai L, et al. Antithrombotic therapies in aortic and peripheral arterial diseases in 2021: a consensus document from the ESC working group on aorta and peripheral vascular diseases, the ESC working group on thrombosis, and the ESC working group on cardiovascular pharmacotherapy. Eur Heart J. 2021 Oct 14;42(39):4013-24.
https://www.doi.org/10.1093/eurheartj/ehab390
http://www.ncbi.nlm.nih.gov/pubmed/34279602?tool=bestpractice.com
Hallazgo incidental de un AAA asintomático de gran tamaño
En general, está indicada la reparación en pacientes con aneurisma de aorta abdominal (AAA) asintomático de gran tamaño (p. ej., con un diámetro que excede los 5.5 cm en hombres, o 5.0 cm en mujeres, en los EE. UU., aunque las decisiones de tratamiento basadas en un tamaño mayor pueden diferir en otros países (como p. ej. en el Reino Unido).[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
La reparación de aneurismas ≥5.5 cm ofrece una ventaja de supervivencia.[1]Dehlin JM, Upchurch GR. Management of abdominal aortic aneurysms. Curr Treat Options Cardiovasc Med. 2005 Jun;7(2):119-30.
http://www.ncbi.nlm.nih.gov/pubmed/15935120?tool=bestpractice.com
[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
[79]National Institute for Health and Care Excellence. Abdominal aortic aneurysm: diagnosis and management. Mar 2020 [internet publication].
https://www.nice.org.uk/guidance/ng156
[106]Authors/Task Force Members, Czerny M, Grabenwöger M, et al. EACTS/STS guidelines for diagnosing and treating acute and chronic syndromes of the Aortic Organ. Ann Thorac Surg. 2024 Jul;118(1):5-115.
https://www.annalsthoracicsurgery.org/article/S0003-4975(24)00077-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38416090?tool=bestpractice.com
[108]UK Small Aneurysm Trial Participants. Mortality results for randomized controlled trial of early elective surgery or ultrasonographic surveillance for small abdominal aortic aneurysms. Lancet. 1998 Nov 21;352(9141):1649-55.
http://www.ncbi.nlm.nih.gov/pubmed/9853436?tool=bestpractice.com
[109]Powell JT, Brady AR, Brown LC, et al; United Kingdom Small Aneurysm Trial Participants. Long-term outcomes of immediate repair compared with surveillance of small abdominal aortic aneurysms. N Engl J Med. 2002 May 9;346(19):1445-52.
https://www.nejm.org/doi/full/10.1056/NEJMoa013527
http://www.ncbi.nlm.nih.gov/pubmed/12000814?tool=bestpractice.com
[110]Powell JT, Brown LC, Forbes JF, et al. Final 12-year follow-up of surgery versus surveillance in the UK Small Aneurysm Trial. Br J Surg. 2007 Jun;94(6):702-8.
http://www.ncbi.nlm.nih.gov/pubmed/17514693?tool=bestpractice.com
Las decisiones relativas a la reparación deben ser individualizadas, teniendo en cuenta la preferencia del paciente, su edad, sexo, factores de riesgo perioperatorio y factores de riesgo anatómicos. Se debe tener cuidado de evaluar la calidad de vida del paciente y de realizar un asesoramiento cuidadoso con respecto a los riesgos de la cirugía (p. ej., informar a los pacientes sobre su puntuación de riesgo de mortalidad perioperatoria de la Vascular Quality Initiative) y la calidad de vida posterior. Se recomienda un enfoque de toma de decisiones compartida que tenga en cuenta los riesgos y beneficios de los procedimientos.[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
La EVAR se debe considerar en pacientes que no son aptos para la cirugía abierta.[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
[79]National Institute for Health and Care Excellence. Abdominal aortic aneurysm: diagnosis and management. Mar 2020 [internet publication].
https://www.nice.org.uk/guidance/ng156
[134]Ulug P, Powell JT, Martinez MA, et al. Surgery for small asymptomatic abdominal aortic aneurysms. Cochrane Database Syst Rev. 2020 Jul 1;7(7):CD001835.
https://www.doi.org/10.1002/14651858.CD001835.pub5
http://www.ncbi.nlm.nih.gov/pubmed/32609382?tool=bestpractice.com
Los datos sugieren que en pacientes con AAA de gran tamaño (un rango entre 5.0 y 5.5 cm) sometidos a reparación electiva, la EVAR equivale a la reparación abierta en términos de supervivencia global, aunque la tasa de intervenciones secundarias es más elevada en la EVAR.[145]Greenhalgh RM, Brown LC, Powell JT, et al; United Kingdom EVAR Trial Investigators. Endovascular versus open repair of abdominal aortic aneurysm. N Engl J Med. 2010 May 20;362(20):1863-71.
http://www.ncbi.nlm.nih.gov/pubmed/20382983?tool=bestpractice.com
[146]Amato B, Fugetto F, Compagna R, et al. Endovascular repair versus open repair in the treatment of ruptured aortic aneurysms: a systematic review. Minerva Chir. 2019 Dec;74(6):472-80.
http://www.ncbi.nlm.nih.gov/pubmed/29806754?tool=bestpractice.com
La EVAR también reduce la mortalidad relacionada con el AAA (pero no presenta supervivencia global a un plazo más amplio) en pacientes con AAA de gran tamaño (≥5.5 cm) y no aptos para la reparación abierta.[147]Greenhalgh RM, Brown LC, Powell JT, et al; United Kingdom EVAR Trial Investigators. Endovascular repair of aortic aneurysm in patients physically ineligible for open repair. N Engl J Med. 2010 May 20;362(20):1872-80.
http://www.ncbi.nlm.nih.gov/pubmed/20382982?tool=bestpractice.com
Los AAA posreparación de mayor tamaño parecen estar asociados a una menor tasa de supervivencia tardía que los aneurismas de menor tamaño (CRI agrupado de 1.14 por 1 cm de aumento en el diámetro del AAA, IC del 95%: 1.09 a 1.18; seguimiento de 12.0 a 91.2 meses).[148]Khashram M, Hider PN, Williman JA, et al. Does the diameter of abdominal aortic aneurysm influence late survival following abdominal aortic aneurysm repair? A systematic review and meta-analysis. Vascular. 2016 Dec;24(6):658-67.
http://www.ncbi.nlm.nih.gov/pubmed/27189809?tool=bestpractice.com
La asociación es más pronunciada para la EVAR que para la reparación abierta.
La reparación electiva en pacientes asintomáticos permite la evaluación preoperatoria, la estratificación del riesgo cardíaco y la optimización médica de otras comorbilidades. La arteriopatía coronaria sigue siendo la causa principal de mortalidad temprana y tardía tras la reparación del AAA.
Reparación de aneurisma endovascular (EVAR)
La EVAR implica la colocación transfemoral endoluminal de una endoprótesis cubierta dentro de la aorta, sellando, de este modo, la pared del aneurisma de las presiones sistémicas e impidiendo la rotura. Esto permite la disminución del saco del aneurisma. El endoinjerto se puede desplegar percutáneamente a través de dispositivos de bajo perfil, o después de exponer quirúrgicamente las arterias femorales. Una revisión de la Cochrane no encontró diferencias entre las técnicas después de un seguimiento corto (6 meses), exceptuando que el enfoque percutáneo puede ser más rápido.[149]Gimzewska M, Jackson AI, Yeoh SE, et al. Totally percutaneous versus surgical cut-down femoral artery access for elective bifurcated abdominal endovascular aneurysm repair. Cochrane Database Syst Rev. 2017 Feb 21;(2):CD010185.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD010185.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/28221665?tool=bestpractice.com
[  ]
How does totally percutaneous femoral artery access compare with surgical cut‐down femoral artery access for adults undergoing elective bifurcated abdominal endovascular aneurysm repair?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4261/fullMostrarme la respuesta No se dispone de datos a largo plazo sobre la durabilidad de los dispositivos de bajo perfil.[Figure caption and citation for the preceding image starts]: Varias endoprótesis endovasculares utilizadas en la reparación endovascular (EVAR) del aneurismaUniversity of Michigan, específicamente los casos del Dr. Upchurch que reflejan los Departamentos de Cirugía Vascular y Radiología [Citation ends].
]
How does totally percutaneous femoral artery access compare with surgical cut‐down femoral artery access for adults undergoing elective bifurcated abdominal endovascular aneurysm repair?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4261/fullMostrarme la respuesta No se dispone de datos a largo plazo sobre la durabilidad de los dispositivos de bajo perfil.[Figure caption and citation for the preceding image starts]: Varias endoprótesis endovasculares utilizadas en la reparación endovascular (EVAR) del aneurismaUniversity of Michigan, específicamente los casos del Dr. Upchurch que reflejan los Departamentos de Cirugía Vascular y Radiología [Citation ends].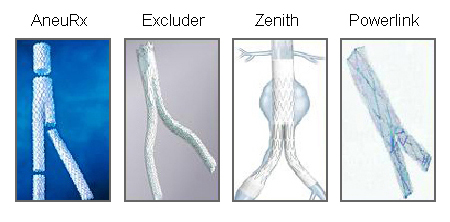 [Figure caption and citation for the preceding image starts]: Reparación de aneurisma endovascular (EVAR)University of Michigan, específicamente los casos del Dr. Upchurch que reflejan los Departamentos de Cirugía Vascular y Radiología [Citation ends].
[Figure caption and citation for the preceding image starts]: Reparación de aneurisma endovascular (EVAR)University of Michigan, específicamente los casos del Dr. Upchurch que reflejan los Departamentos de Cirugía Vascular y Radiología [Citation ends].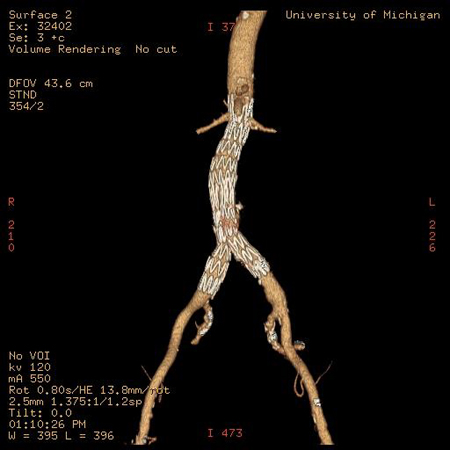
La evaluación de la idoneidad para la EVAR se debe realizar mediante el uso de una angiografía TC de 0.5 mm de corte.[80]American College of Radiology. ACR Appropriateness Criteria: pulsatile abdominal mass, suspected abdominal aortic aneurysm. 2023 [internet publication].
https://acsearch.acr.org/docs/69414/Narrative
Es esencial que el operador esté familiarizado con las instrucciones específicas para el uso del endoinjerto que se va a utilizar.
Se recomienda la vigilancia anual de por vida con ecografía o TC después de la reparación endovascular de los AAA para detectar complicaciones tardías e identificar el fracaso tardío del dispositivo y el avance de la enfermedad.[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
Reparación abierta
La reparación abierta puede ser transperitoneal o retroperitoneal. Una vez que se obtiene el control aórtico distal y proximal, el aneurisma se abre, se ligan las ramas de la arteria que vuelven a sangrar y se sutura un injerto protésico desde la aorta proximal normal hasta la aorta distal normal (o los segmentos ilíacos). Una vez que el flujo se reestablece en las arterias ilíacas bilaterales, el saco del aneurisma se cierra sobre el injerto.[150]Eliason JL, Upchurch GR. Endovascular abdominal aortic aneurysms repair. Circulation. 2008 Apr 1;117(13):1738-44.
https://www.ahajournals.org/doi/full/10.1161/circulationaha.107.747923
http://www.ncbi.nlm.nih.gov/pubmed/18378627?tool=bestpractice.com
Se debería considerar un abordaje retroperitoneal para los pacientes cuya enfermedad de aneurisma se extiende hacia el segmento aórtico yuxtarrenal y/o visceral, o en presencia de un aneurisma inflamatorio, riñón en herradura o abdomen hostil.[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
[151]Sicard GA, Reilly JM, Rubin BG, et al. Transabdominal versus retroperitoneal incision for abdominal aortic surgery: report of a prospective randomized trial. J Vasc Surg. 1995 Feb;21(2):174-81.
http://www.ncbi.nlm.nih.gov/pubmed/7853592?tool=bestpractice.com
Se recomiendan los injertos rectos para la reparación en ausencia de enfermedad significativa de las arterias ilíacas.[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
La anastomosis de la aorta proximal se debe practicar lo más cerca posible de las arterias renales.[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
Se recomienda que ninguna porción del injerto de aorta entre en contacto directo con los contenidos intestinales de la cavidad peritoneal.[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
Se debe considerar la reimplantación de una arteria mesentérica inferior permeable en circunstancias que sugieran un mayor riesgo de isquemia colónica (es decir, enfermedad oclusiva asociada del tronco celíaco o de la arteria mesentérica superior, una arteria mesentérica serpenteante y agrandada, antecedentes de resección de colon previa, incapacidad de preservar la perfusión hipogástrica, pérdida sustancial de sangre o hipotensión intraoperatoria, mal reflujo sanguíneo de la arteria mesentérica inferior al abrirse el injerto, mal flujo en Doppler de los vasos del colon, o si el colon parece isquémico).[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
[152]Senekowitsch C, Assadian A, Assadian O, et al. Replanting the inferior mesentery artery during infrarenal aortic aneurysm repair: influence on postoperative colon ischemia. J Vasc Surg. 2006 Apr;43(4):689-94.
http://www.ncbi.nlm.nih.gov/pubmed/16616221?tool=bestpractice.com
EVAR fenestrado (FEVAR) y endoinjertos ramificados (bEVAR)
Para los pacientes con un AAA complejo y riesgo quirúrgico estándar, se debe considerar la apertura o EVAR en función de la aptitud, la anatomía y las preferencias del paciente. Para los pacientes con un AAA complejo y alto riesgo quirúrgico, se debe considerar la EVAR con tecnologías fenestradas y ramificadas como tratamiento de primera línea. Los endoinjertos fenestrados y ramificados se han convertido en el tratamiento de elección de los AAA complejos en la mayoría de los centros de alto volumen.[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
Estos procedimientos son alternativas viables a la reparación abierta para los AAA yuxtarrenales y suprarrenales, o para aquellos con AAA en los que un cuello corto o enfermo impide la reparación convencional.[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
[153]Mohamed N, Galyfos G, Anastasiadou C, et al. Fenestrated endovascular repair for pararenal or juxtarenal abdominal aortic aneurysms: a systematic review. Ann Vasc Surg. 2020 Feb;63:399-408.
http://www.ncbi.nlm.nih.gov/pubmed/31629840?tool=bestpractice.com
Los endoinjertos de FEVAR tienen orificios que corresponden a la posición de las arterias ramificadas dentro de la aorta y permiten la reparación endovascular de aneurismas complejos. Un análisis conjunto de 7 estudios retrospectivos (que incluían a 772 pacientes) sugirió unas tasas favorables de mortalidad y permeabilidad del vaso visceral diana del 8.0% y el 95.4% a 1 año, respectivamente.[154]Spanos K, Antoniou GΑ, Giannoukas AD, et al. Durability of fenestrated endovascular aortic repair for juxta-renal abdominal aortic aneurysm repair. J Cardiovasc Surg (Torino). 2018 Apr;59(2):213-24.
http://www.ncbi.nlm.nih.gov/pubmed/29327565?tool=bestpractice.com
Sin embargo, otros metanálisis que analizan la FEVAR para aneurismas complejos y aneurismas yuxtarrenales de aorta abdominal (que incluyen a 7061 y 2974 pacientes, respectivamente) no sugieren diferencias de mortalidad con la FEVAR, pero sí un posible aumento del riesgo de reintervención.[155]Antoniou GA, Juszczak MT, Antoniou SA, et al. Editor's choice - fenestrated or branched endovascular versus open repair for complex aortic aneurysms: meta-analysis of time to event propensity score matched data. Eur J Vasc Endovasc Surg. 2021 Feb;61(2):228-37.
https://www.doi.org/10.1016/j.ejvs.2020.10.010
http://www.ncbi.nlm.nih.gov/pubmed/33288434?tool=bestpractice.com
[156]Jones AD, Waduud MA, Walker P, et al. Meta-analysis of fenestrated endovascular aneurysm repair versus open surgical repair of juxtarenal abdominal aortic aneurysms over the last 10 years. BJS Open. 2019 Oct;3(5):572-84.
https://www.doi.org/10.1002/bjs5.50178
http://www.ncbi.nlm.nih.gov/pubmed/31592091?tool=bestpractice.com
El procedimiento se realiza de forma rutinaria en algunos centros.[154]Spanos K, Antoniou GΑ, Giannoukas AD, et al. Durability of fenestrated endovascular aortic repair for juxta-renal abdominal aortic aneurysm repair. J Cardiovasc Surg (Torino). 2018 Apr;59(2):213-24.
http://www.ncbi.nlm.nih.gov/pubmed/29327565?tool=bestpractice.com
[155]Antoniou GA, Juszczak MT, Antoniou SA, et al. Editor's choice - fenestrated or branched endovascular versus open repair for complex aortic aneurysms: meta-analysis of time to event propensity score matched data. Eur J Vasc Endovasc Surg. 2021 Feb;61(2):228-37.
https://www.doi.org/10.1016/j.ejvs.2020.10.010
http://www.ncbi.nlm.nih.gov/pubmed/33288434?tool=bestpractice.com
[157]Cross J, Gurusamy K, Gadhvi V, et al. Fenestrated endovascular aneurysm repair. Br J Surg. 2012 Feb;99(2):152-9.
http://www.ncbi.nlm.nih.gov/pubmed/22183704?tool=bestpractice.com
Los dispositivos ramificados, ya sea con ramas internas o externas, implican una cobertura aórtica más extendida en comparación con los dispositivos fenestrados.[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
El ESVS establece que estos deben reservarse para los aneurismas de aorta toracoabdominal tipo 4 (estos implican toda la aorta abdominal desde el nivel del diafragma hasta la bifurcación aórtica).[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
Elección de la reparación electiva
La EVAR representa más del 70% de todas las reparaciones de AAA en los EE. UU.[158]Beck AW, Sedrakyan A, Mao J, et al; International Consortium of Vascular Registries. Variations in abdominal aortic aneurysm care: a report from the International Consortium of Vascular Registries. Circulation. 2016 Dec 13;134(24):1948-58.
https://www.ahajournals.org/doi/full/10.1161/circulationaha.116.024870
http://www.ncbi.nlm.nih.gov/pubmed/27784712?tool=bestpractice.com
En el Reino Unido, el 61% de los AAA infrarrenales electivos y el 89% de los AAA complejos se trataron con EVAR durante el período 2018-2020.[159]Vascular Services Quality Improvement Programme. National Vascular Registry 2021 annual report. November 2021 [internet publication].
https://www.vsqip.org.uk/reports/2021-annual-report
Sin embargo, no todos los pacientes son candidatos adecuados para la EVAR. Por lo tanto, las guías de práctica clínica recomiendan un enfoque individualizado para la elección quirúrgica.[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
[79]National Institute for Health and Care Excellence. Abdominal aortic aneurysm: diagnosis and management. Mar 2020 [internet publication].
https://www.nice.org.uk/guidance/ng156
[160]European Society of Cardiology. 2022 ESC guidelines on cardiovascular assessment and management of patients undergoing non cardiac surgery. Aug 2022 [internet publication].
https://www.escardio.org/Guidelines/Clinical-Practice-Guidelines/ESC-Guidelines-on-non-cardiac-surgery-cardiovascular-assessment-and-managem
Los factores que influirán en la decisión incluyen: factores determinantes anatómicos (p. ej., diámetro del aneurisma, longitud del cuello, diámetro del cuello), esperanza de vida, sexo, comorbilidades y riesgo perioperatorio.[161]Laczynski DJ, Caputo FJ. Systematic review and meta-analysis of endovascular abdominal aortic repair in large diameter infrarenal necks. J Vasc Surg. 2021 Jul;74(1):309-315.e2.
https://www.doi.org/10.1016/j.jvs.2021.02.043
http://www.ncbi.nlm.nih.gov/pubmed/33722632?tool=bestpractice.com
[162]Posso M, Quintana MJ, Bellmunt S, et al. GRADE-based recommendations for surgical repair of nonruptured abdominal aortic aneurysm. Angiology. 2019 Sep;70(8):701-10.
http://www.ncbi.nlm.nih.gov/pubmed/30961349?tool=bestpractice.com
Se recomienda un enfoque de toma de decisiones compartida que tenga en cuenta los riesgos y beneficios de los procedimientos.[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
La EVAR puede ser la opción preferible en pacientes que:
Presentan un alto riesgo perioperatorio, y
Poseen una anatomía que sea congruente con los criterios de elegibilidad del fabricante de la endoprótesis, según se determina en las instrucciones de uso, y
Son capaces de satisfacer el régimen de vigilancia obligatorio después de la cirugía.
No obstante, los pacientes con menor riesgo perioperatorio y anatomía favorable también pueden ser candidatos a la EVAR, pero debe tenerse en cuenta la seguridad y la durabilidad de la reparación (necesidad de reintervención), y la reparación abierta puede ser preferible en pacientes relativamente jóvenes.[163]Siracuse JJ, Gill HL, Graham AR, et al. Comparative safety of endovascular and open surgical repair of abdominal aortic aneurysms in low-risk male patients. J Vasc Surg. 2014 Nov;60(5):1154-8.
https://www.jvascsurg.org/article/S0741-5214(14)00999-9/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/24957410?tool=bestpractice.com
[164]Kontopodis N, Antoniou SA, Georgakarakos E, et al. Endovascular vs open aneurysm repair in the young: systematic review and meta-analysis. J Endovasc Ther. 2015 Dec;22(6):897-904.
http://www.ncbi.nlm.nih.gov/pubmed/26403831?tool=bestpractice.com
Resultados de la reparación electiva
Los datos con respecto a la seguridad y eficacia comparativa de la EVAR y la reparación abierta difieren según el objetivo de interés. La evidencia hasta la fecha sugiere que:
La mortalidad postoperatoria a corto plazo (≤30 días) es menor para la reparación endovascular que para la abierta
La supervivencia a largo plazo (5-10 años) es similar entre los pacientes sometidos a EVAR frente a reparación abierta[146]Amato B, Fugetto F, Compagna R, et al. Endovascular repair versus open repair in the treatment of ruptured aortic aneurysms: a systematic review. Minerva Chir. 2019 Dec;74(6):472-80.
http://www.ncbi.nlm.nih.gov/pubmed/29806754?tool=bestpractice.com
[165]Lederle FA, Kyriakides TC, Stroupe KT, et al. Open versus endovascular repair of abdominal aortic aneurysm. N Engl J Med. 2019 May 30;380(22):2126-35.
https://www.doi.org/10.1056/NEJMoa1715955
http://www.ncbi.nlm.nih.gov/pubmed/31141634?tool=bestpractice.com
[166]Bulder RMA, Bastiaannet E, Hamming JF, et al. Meta-analysis of long-term survival after elective endovascular or open repair of abdominal aortic aneurysm. Br J Surg. 2019 Apr;106(5):523-33.
https://academic.oup.com/bjs/article/106/5/523/6092897
http://www.ncbi.nlm.nih.gov/pubmed/30883709?tool=bestpractice.com
La mortalidad quirúrgica, perioperatoria y postoperatoria (≤30 días) es mayor entre las mujeres que entre los hombres, tanto para la reparación abierta, como para la EVAR.[167]Liu Y, Yang Y, Zhao J, et al. Systematic review and meta-analysis of sex differences in outcomes after endovascular aneurysm repair for infrarenal abdominal aortic aneurysm. J Vasc Surg. 2020 Jan;71(1):283-296.e4.
https://www.doi.org/10.1016/j.jvs.2019.06.105
http://www.ncbi.nlm.nih.gov/pubmed/31466739?tool=bestpractice.com
[168]Pouncey AL, David M, Morris RI, et al. Editor's choice - systematic review and meta-analysis of sex specific differences in adverse events after open and endovascular intact abdominal aortic aneurysm repair: consistently worse outcomes for women. Eur J Vasc Endovasc Surg. 2021 Sep;62(3):367-78.
https://www.doi.org/10.1016/j.ejvs.2021.05.029
http://www.ncbi.nlm.nih.gov/pubmed/34332836?tool=bestpractice.com
Las tasas globales de reintervención son más altas después de la EVAR que después de la reparación abierta.[169]Galanakis N, Kontopodis N, Tavlas E, et al. Does a previous aortic endograft confer any protective effect during abdominal aortic aneurysm rupture? Systematic review and meta-analysis of comparative studies. Vascular. 2020 Jun;28(3):241-50.
https://www.doi.org/10.1177/1708538119896464
http://www.ncbi.nlm.nih.gov/pubmed/31937207?tool=bestpractice.com
[170]Wanken ZJ, Barnes JA, Trooboff SW, et al. A systematic review and meta-analysis of long-term reintervention after endovascular abdominal aortic aneurysm repair. J Vasc Surg. 2020 Sep;72(3):1122-31.
https://www.doi.org/10.1016/j.jvs.2020.02.030
http://www.ncbi.nlm.nih.gov/pubmed/32273226?tool=bestpractice.com
[171]Calderón M, Brito V, Alcaraz A, et al. Reparación Endovascular para Aneurisma de Aorta: Revisión Panorámica Sobre su Evidencia en el Mundo y su Aplicación en Latinoamérica. Value Health Reg Issues. 2018 Dec;17:94-101.
https://www.doi.org/10.1016/j.vhri.2018.01.011
http://www.ncbi.nlm.nih.gov/pubmed/29754017?tool=bestpractice.com
La mortalidad postoperatoria a seis meses parece ser menor entre los pacientes con AAA que se someten a una EVAR que entre los que se someten a una cirugía abierta, pero esto se atribuye principalmente a una menor mortalidad quirúrgica a 30 días.[172]Powell JT, Sweeting MJ, Ulug P, et al; EVAR, DREAM, OVER and ACE Trialists. Meta-analysis of individual-patient data from EVAR-1, DREAM, OVER and ACE trials comparing outcomes of endovascular or open repair for abdominal aortic aneurysm over 5 years. Br J Surg. 2017 Feb;104(3):166-78.
https://bjssjournals.onlinelibrary.wiley.com/doi/full/10.1002/bjs.10430
http://www.ncbi.nlm.nih.gov/pubmed/28160528?tool=bestpractice.com
En un análisis agrupado de los datos a partir de 4 ensayos aleatorizados de alta calidad (que incluyeron a pacientes con un diámetro de AAA >5 cm) se observó que la mortalidad a corto plazo (30 días o mortalidad intrahospitalaria) fue significativamente menor entre los asignados al azar a la EVAR, que entre los que se sometieron a reparación abierta (1.4% frente a 4.2%; odds-ratio [OR] de 0.33; IC del 95%: 0.20 a 0.55; P <0.0001).[173]Paravastu SC, Jayarajasingam R, Cottam R, et al. Endovascular repair of abdominal aortic aneurysm. Cochrane Database Syst Rev. 2014 Jan 23;(1):CD004178.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD004178.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/24453068?tool=bestpractice.com
Sin embargo, el beneficio inicial de la EVAR disminuye con el seguimiento.[172]Powell JT, Sweeting MJ, Ulug P, et al; EVAR, DREAM, OVER and ACE Trialists. Meta-analysis of individual-patient data from EVAR-1, DREAM, OVER and ACE trials comparing outcomes of endovascular or open repair for abdominal aortic aneurysm over 5 years. Br J Surg. 2017 Feb;104(3):166-78.
https://bjssjournals.onlinelibrary.wiley.com/doi/full/10.1002/bjs.10430
http://www.ncbi.nlm.nih.gov/pubmed/28160528?tool=bestpractice.com
[173]Paravastu SC, Jayarajasingam R, Cottam R, et al. Endovascular repair of abdominal aortic aneurysm. Cochrane Database Syst Rev. 2014 Jan 23;(1):CD004178.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD004178.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/24453068?tool=bestpractice.com
[174]Yokoyama Y, Kuno T, Takagi H. Meta-analysis of phase-specific survival after elective endovascular versus surgical repair of abdominal aortic aneurysm from randomized controlled trials and propensity score-matched studies. J Vasc Surg. 2020 Oct;72(4):1464-1472.e6.
https://www.doi.org/10.1016/j.jvs.2020.03.041
http://www.ncbi.nlm.nih.gov/pubmed/32330598?tool=bestpractice.com
La reparación abierta se asoció significativamente con una mortalidad por cualquier causa inferior a la EVAR, tras más de 8 años de seguimiento, en los datos del ensayo de reparación endovascular de aneurismas 1 del Reino Unido (46% frente a 53%, p=0.048) y en otro metanálisis.[175]Patel R, Sweeting MJ, Powell JT, et al; EVAR Trial Investigators. Endovascular versus open repair of abdominal aortic aneurysm in 15-years' follow-up of the UK endovascular aneurysm repair trial 1 (EVAR trial 1): a randomised controlled trial. Lancet. 2016 Nov 12;388(10058):2366-74.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(16)31135-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/27743617?tool=bestpractice.com
[176]Antoniou GA, Antoniou SA, Torella F. Editor's choice - endovascular vs. open repair for abdominal aortic aneurysm: systematic review and meta-analysis of updated peri-operative and long term data of randomised controlled trials. Eur J Vasc Endovasc Surg. 2020 Mar;59(3):385-97.
https://www.doi.org/10.1016/j.ejvs.2019.11.030
http://www.ncbi.nlm.nih.gov/pubmed/31899100?tool=bestpractice.com
Un metanálisis identificó un punto de cruce de la curva de supervivencia a 1.8 años después de la reparación, con lo cual, posteriormente, los pacientes que se sometieron a la EVAR presentaron una supervivencia inferior en comparación con los que se sometieron a la reparación abierta.[177]Takagi H, Ando T, Umemoto T, et al. Worse late-phase survival after elective endovascular than open surgical repair for intact abdominal aortic aneurysm. Int J Cardiol. 2017 Jun 1;236:427-31.
http://www.ncbi.nlm.nih.gov/pubmed/28096046?tool=bestpractice.com
La misma tendencia se observa en la mortalidad por aneurisma. Un metanálisis encontró que la mortalidad asociada a aneurisma a los tres años fue significativamente mayor después de la reparación con EVAR que después de la reparación abierta (cociente de riesgos instantáneos [CRI] agrupado 5.16; IC del 95%: 1.49 a 17.89; P=0.010).[172]Powell JT, Sweeting MJ, Ulug P, et al; EVAR, DREAM, OVER and ACE Trialists. Meta-analysis of individual-patient data from EVAR-1, DREAM, OVER and ACE trials comparing outcomes of endovascular or open repair for abdominal aortic aneurysm over 5 years. Br J Surg. 2017 Feb;104(3):166-78.
https://bjssjournals.onlinelibrary.wiley.com/doi/full/10.1002/bjs.10430
http://www.ncbi.nlm.nih.gov/pubmed/28160528?tool=bestpractice.com
Los datos del ensayo 'UK endovascular aneurysm repair trial 1' indican que, después de más de 8 años de seguimiento, la mortalidad asociada a aneurisma es mayor entre los pacientes con EVAR que entre los pacientes sometidos a reparación abierta (5% frente a 1%, P=0.0064).[175]Patel R, Sweeting MJ, Powell JT, et al; EVAR Trial Investigators. Endovascular versus open repair of abdominal aortic aneurysm in 15-years' follow-up of the UK endovascular aneurysm repair trial 1 (EVAR trial 1): a randomised controlled trial. Lancet. 2016 Nov 12;388(10058):2366-74.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(16)31135-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/27743617?tool=bestpractice.com
La rotura del aneurisma fue más frecuente en los pacientes después de la EVAR que después de la reparación abierta (5.4% frente a 1.4%, P <0.001) en un estudio de cohorte de gran tamaño muestral durante 8 años de seguimiento.[178]Schermerhorn ML, Buck DB, O'Malley AJ, et al. Long-term outcomes of abdominal aortic aneurysm in the Medicare population. N Engl J Med. 2015 Jul 23;373(4):328-38.
https://www.nejm.org/doi/full/10.1056/NEJMoa1405778
http://www.ncbi.nlm.nih.gov/pubmed/26200979?tool=bestpractice.com
Otra revisión sistemática que incluyó a más de 30,000 pacientes en 22 estudios observacionales no halló diferencias significativas en la mortalidad relacionada con el aneurisma con la EVAR en comparación con la reparación abierta.[179]Kontopodis N, Galanakis N, Ioannou CV, et al. Time-to-event data meta-analysis of late outcomes of endovascular versus open repair for ruptured abdominal aortic aneurysms. J Vasc Surg. 2021 Aug;74(2):628-638.e4.
https://www.doi.org/10.1016/j.jvs.2021.03.019
http://www.ncbi.nlm.nih.gov/pubmed/33819523?tool=bestpractice.com
Se han propuesto factores atenuantes para explicar la peor mortalidad en fase tardía reportada en los pacientes con EVAR en comparación con los que se someten a reparación abierta. Una revisión sistemática llegó a la conclusión de que la supervivencia postoperatoria a largo plazo en pacientes sometidos a una EVAR había mejorado en los ensayos publicados después de 2005, y atribuyó esto a una posible mejoría en las técnicas de EVAR y los cuidados perioperatorios.[180]Tzani A, Doulamis IP, Katsaros I, et al. Mortality after endovascular treatment of infrarenal abdominal aortic aneurysms - the newer the better? Vasa. 2018 Apr;47(3):187-96.
https://econtent.hogrefe.com/doi/10.1024/0301-1526/a000685
http://www.ncbi.nlm.nih.gov/pubmed/29334334?tool=bestpractice.com
La mortalidad perioperatoria y a corto plazo es mayor entre las mujeres que entre los hombres.[167]Liu Y, Yang Y, Zhao J, et al. Systematic review and meta-analysis of sex differences in outcomes after endovascular aneurysm repair for infrarenal abdominal aortic aneurysm. J Vasc Surg. 2020 Jan;71(1):283-296.e4.
https://www.doi.org/10.1016/j.jvs.2019.06.105
http://www.ncbi.nlm.nih.gov/pubmed/31466739?tool=bestpractice.com
[168]Pouncey AL, David M, Morris RI, et al. Editor's choice - systematic review and meta-analysis of sex specific differences in adverse events after open and endovascular intact abdominal aortic aneurysm repair: consistently worse outcomes for women. Eur J Vasc Endovasc Surg. 2021 Sep;62(3):367-78.
https://www.doi.org/10.1016/j.ejvs.2021.05.029
http://www.ncbi.nlm.nih.gov/pubmed/34332836?tool=bestpractice.com
Durante la reparación electiva del AAA, la mortalidad quirúrgica entre las mujeres supera la de los hombres, tanto para los métodos abiertos (7.0% frente a 5.2%) como endovasculares (2.1% frente a 1.3%).[181]Schermerhorn ML, Bensley RP, Giles KA, et al. Changes in abdominal aortic aneurysm rupture and short-term mortality, 1995-2008: a retrospective observational study. Ann Surg. 2012 Oct;256(4):651-8.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3507435
http://www.ncbi.nlm.nih.gov/pubmed/22964737?tool=bestpractice.com
En el Reino Unido, se encontró que en las mujeres que se sometieron a una reparación electiva de los AAA aumentó la mortalidad a corto plazo, en comparación con los hombres para la reparación abierta (mortalidad a 30 días: odds ratio de 1.39; IC del 95%: 1.25 a 1.56) y EVAR (mortalidad a 30 días: odds ratio de 1.57; IC del 95%: 1.23 a 2.00), a pesar de presentar menos factores de riesgo cardiovascular preoperatorios.[182]Desai M, Choke E, Sayers RD, et al. Sex-related trends in mortality after elective abdominal aortic aneurysm surgery between 2002 and 2013 at National Health Service hospitals in England: less benefit for women compared with men. Eur Heart J. 2016 Dec 7;37(46):3452-60.
https://academic.oup.com/eurheartj/article/37/46/3452/2661739
http://www.ncbi.nlm.nih.gov/pubmed/27520304?tool=bestpractice.com
El sexo femenino fue un factor de riesgo independiente para la mortalidad a 1 año por todas las causas entre las mujeres que se sometieron a una reparación abierta (mortalidad acumulada bruta por todas las causas 15.9% frente a 12.1%, P <0.001) y a los 5 años (22.2% frente a 19.6%, P <0.001).[182]Desai M, Choke E, Sayers RD, et al. Sex-related trends in mortality after elective abdominal aortic aneurysm surgery between 2002 and 2013 at National Health Service hospitals in England: less benefit for women compared with men. Eur Heart J. 2016 Dec 7;37(46):3452-60.
https://academic.oup.com/eurheartj/article/37/46/3452/2661739
http://www.ncbi.nlm.nih.gov/pubmed/27520304?tool=bestpractice.com
La supervivencia por todas las causas a largo plazo no difirió significativamente entre las mujeres y los hombres en el grupo de EVAR (p = 0.356). Una revisión concluyó que los criterios morfológicos para diagnosticar los aneurismas y ofrecer la EVAR no tuvieron en cuenta las variaciones relacionadas con el sexo en el tamaño aórtico: las mujeres presentan menos probabilidades de que se les ofrezca la intervención porque su aorta es más pequeña.[183]Ulug P, Sweeting MJ, von Allmen RS, et al. Morphological suitability for endovascular repair, non-intervention rates, and operative mortality in women and men assessed for intact abdominal aortic aneurysm repair: systematic reviews with meta-analysis. Lancet. 2017 Jun 24;389(10088):2482-91.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)30639-6/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/28455148?tool=bestpractice.com
Las tasas globales de reintervención fueron más altas con la EVAR que con la cirugía abierta; sin embargo, en los ensayos clínicos se han informado las tasas de forma heterogénea.[169]Galanakis N, Kontopodis N, Tavlas E, et al. Does a previous aortic endograft confer any protective effect during abdominal aortic aneurysm rupture? Systematic review and meta-analysis of comparative studies. Vascular. 2020 Jun;28(3):241-50.
https://www.doi.org/10.1177/1708538119896464
http://www.ncbi.nlm.nih.gov/pubmed/31937207?tool=bestpractice.com
[170]Wanken ZJ, Barnes JA, Trooboff SW, et al. A systematic review and meta-analysis of long-term reintervention after endovascular abdominal aortic aneurysm repair. J Vasc Surg. 2020 Sep;72(3):1122-31.
https://www.doi.org/10.1016/j.jvs.2020.02.030
http://www.ncbi.nlm.nih.gov/pubmed/32273226?tool=bestpractice.com
[172]Powell JT, Sweeting MJ, Ulug P, et al; EVAR, DREAM, OVER and ACE Trialists. Meta-analysis of individual-patient data from EVAR-1, DREAM, OVER and ACE trials comparing outcomes of endovascular or open repair for abdominal aortic aneurysm over 5 years. Br J Surg. 2017 Feb;104(3):166-78.
https://bjssjournals.onlinelibrary.wiley.com/doi/full/10.1002/bjs.10430
http://www.ncbi.nlm.nih.gov/pubmed/28160528?tool=bestpractice.com
[173]Paravastu SC, Jayarajasingam R, Cottam R, et al. Endovascular repair of abdominal aortic aneurysm. Cochrane Database Syst Rev. 2014 Jan 23;(1):CD004178.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD004178.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/24453068?tool=bestpractice.com
En el análisis combinado de los datos de pacientes individuales, se reportó la reintervención en el 65.8% de los pacientes con endofuga de tipo I (79 de 120) y en el 22.8% de los pacientes con endofuga de tipo II (99 de 435) durante 5 años de seguimiento.[172]Powell JT, Sweeting MJ, Ulug P, et al; EVAR, DREAM, OVER and ACE Trialists. Meta-analysis of individual-patient data from EVAR-1, DREAM, OVER and ACE trials comparing outcomes of endovascular or open repair for abdominal aortic aneurysm over 5 years. Br J Surg. 2017 Feb;104(3):166-78.
https://bjssjournals.onlinelibrary.wiley.com/doi/full/10.1002/bjs.10430
http://www.ncbi.nlm.nih.gov/pubmed/28160528?tool=bestpractice.com
Los datos observacionales sugieren que las intervenciones relacionadas con el tratamiento del aneurisma, o sus complicaciones, son más frecuentes después de la EVAR que después de la cirugía abierta (18.8% frente a 3.7%, P <0.001) durante 8 años de seguimiento.[178]Schermerhorn ML, Buck DB, O'Malley AJ, et al. Long-term outcomes of abdominal aortic aneurysm in the Medicare population. N Engl J Med. 2015 Jul 23;373(4):328-38.
https://www.nejm.org/doi/full/10.1056/NEJMoa1405778
http://www.ncbi.nlm.nih.gov/pubmed/26200979?tool=bestpractice.com
El metanálisis no encontró diferencias significativas entre la EVAR y la cirugía abierta en la incidencia de muerte miocárdica (odds ratio de 1.14; IC del 95%: 0.86 a 1.52; P= 0.36), accidente cerebrovascular mortal (odds ratio de 0.81; IC del 95%: 0.42 a 1.55; P= 0.52) o accidente cerebrovascular no mortal (odds ratio de 0.81; IC del 95%: 0.50 a 1.31; P=0.39).[173]Paravastu SC, Jayarajasingam R, Cottam R, et al. Endovascular repair of abdominal aortic aneurysm. Cochrane Database Syst Rev. 2014 Jan 23;(1):CD004178.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD004178.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/24453068?tool=bestpractice.com
Los pacientes con disfunción renal moderada o enfermedad cardiovascular no parecen obtener un beneficio de supervivencia temprana (hasta 6 meses) de la EVAR, mientras que los pacientes con enfermedad arterial periférica se pueden beneficiar de la reparación abierta.[172]Powell JT, Sweeting MJ, Ulug P, et al; EVAR, DREAM, OVER and ACE Trialists. Meta-analysis of individual-patient data from EVAR-1, DREAM, OVER and ACE trials comparing outcomes of endovascular or open repair for abdominal aortic aneurysm over 5 years. Br J Surg. 2017 Feb;104(3):166-78.
https://bjssjournals.onlinelibrary.wiley.com/doi/full/10.1002/bjs.10430
http://www.ncbi.nlm.nih.gov/pubmed/28160528?tool=bestpractice.com
En otro metanálisis, la supervivencia a largo plazo después de la reparación electiva con AAA (EVAR o abierta) fue peor entre los pacientes con enfermedad renal terminal (CRI 3.15; IC del 95%: 2.45 a 4.04) y la EPOC que requirieron oxígeno suplementario (CRI 3.05; IC del 95%: 1.93 a 4.80).[184]Khashram M, Williman JA, Hider PN, et al. Systematic review and meta-analysis of factors influencing survival following abdominal aortic aneurysm repair. Eur J Vasc Endovasc Surg. 2016 Feb;51(2):203-15.
https://www.ejves.com/article/S1078-5884(15)00682-6/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/26602162?tool=bestpractice.com
Evidencia de baja calidad obtenida de 4 ensayos aleatorizados controlados de pequeño tamaño muestral indican que la reparación abierta electiva realizada retroperitonealmente puede reducir la pérdida de sangre y la estancia hospitalaria en comparación con un abordaje transperitoneal.[185]Mei F, Hu K, Zhao B, et al. Retroperitoneal versus transperitoneal approach for elective open abdominal aortic aneurysm repair. Cochrane Database Syst Rev. 2021 Jun 21;6(6):CD010373.
https://www.doi.org/10.1002/14651858.CD010373.pub3
http://www.ncbi.nlm.nih.gov/pubmed/34152003?tool=bestpractice.com
Sin embargo, no se observaron diferencias en la mortalidad entre la reparación abierta electiva retroperitoneal y transperitoneal del AAA (evidencia de muy baja calidad). Además, el enfoque retroperitoneal puede aumentar el riesgo de hematoma, el dolor crónico de la herida y la hernia de la pared abdominal en comparación con el transperitoneal.[185]Mei F, Hu K, Zhao B, et al. Retroperitoneal versus transperitoneal approach for elective open abdominal aortic aneurysm repair. Cochrane Database Syst Rev. 2021 Jun 21;6(6):CD010373.
https://www.doi.org/10.1002/14651858.CD010373.pub3
http://www.ncbi.nlm.nih.gov/pubmed/34152003?tool=bestpractice.com
Efectos adversos
Las complicaciones de la EVAR pueden incluir endofuga, oclusión del injerto y migración del injerto con expansión aórtica del cuello. Una revisión sistemática informó la dilatación aórtica del cuello en el 24.6% de las EVAR (9439 hombres incluidos), lo que llevó a tasas más altas de endofuga de tipo I, migración del injerto y reintervención.[186]Kouvelos GN, Oikonomou K, Antoniou GA, et al. A systematic review of proximal neck dilatation after endovascular repair for abdominal aortic aneurysm. J Endovasc Ther. 2017 Feb;24(1):59-67.
http://www.ncbi.nlm.nih.gov/pubmed/27974495?tool=bestpractice.com
Estas complicaciones suelen detectarse en la angiografía de finalización o en las imágenes postoperatorias, aunque los estudios sugieren que la angiografía intraoperatoria por TC puede ser un método más sensible para detectar las complicaciones de la EVAR.[187]Hansrani V, Halim UA, Goel RR, et al. Intra-operative computed tomography in endovascular aneurysm repair. Vasa. 2020 Apr;49(3):167-74.
https://www.doi.org/10.1024/0301-1526/a000840
http://www.ncbi.nlm.nih.gov/pubmed/31904305?tool=bestpractice.com
Como complemento de la EVAR, la oclusión de la arteria ilíaca interna (AII) unilateral o bilateral puede ser aceptable en ciertas situaciones anatómicas para los pacientes con alto riesgo de una reparación quirúrgica abierta. La claudicación de glúteos se producirá en el 27.9% de los pacientes después de la oclusión de la AII, aunque esto se resuelve en el 48% de los casos tras un promedio de 21.8 meses. Es menos probable que se produzca después de una oclusión unilateral (OR 0.57; IC del 95%: 0.36 a 0.91). La disfunción eréctil se produjo en el 10% al 14% de los hombres tras la oclusión de la AII.[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
[188]Bosanquet DC, Wilcox C, Whitehurst L, et al. Systematic review and meta-analysis of the effect of internal iliac artery exclusion for patients undergoing EVAR. Eur J Vasc Endovasc Surg. 2017 Apr;53(4):534-48.
https://www.ejves.com/article/S1078-5884(17)30056-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/28242154?tool=bestpractice.com
Las técnicas de revascularización IIA, que implican dispositivos especializados de rama ilíaca, presentan tasas de éxito técnico elevadas (hasta el 97,5%) y se asocian a una morbilidad baja (p. ej., una tasa de claudicación glútea del 2.15% al 4.1%).[189]Giosdekos A, Antonopoulos CN, Sfyroeras GS, et al. The use of iliac branch devices for preservation of flow in internal iliac artery during endovascular aortic aneurysm repair. J Vasc Surg. 2020 Jun;71(6):2133-44.
https://www.doi.org/10.1016/j.jvs.2019.10.087
http://www.ncbi.nlm.nih.gov/pubmed/31901362?tool=bestpractice.com
Los efectos de la oclusión de la AII frente a la revascularización de la AII no se han comparado bien.[190]Sousa LHD, Baptista-Silva JC, Vasconcelos V, et al. Internal iliac artery revascularisation versus internal iliac artery occlusion for endovascular treatment of aorto-iliac aneurysms. Cochrane Database Syst Rev. 2020 Jul 21;7(7):CD013168.
https://www.doi.org/10.1002/14651858.CD013168.pub2
http://www.ncbi.nlm.nih.gov/pubmed/32691854?tool=bestpractice.com
En pacientes con neoplasia maligna intrabdominal sincrónica, las endoprótesis endovasculares utilizadas en la reparación endovascular (EVAR) reducen la mortalidad y el retraso en el tratamiento de las 2 patologías a pesar de un riesgo significativo de eventos trombóticos.[191]Kumar R, Dattani N, Asaad O, et al. Meta-analysis of outcomes following aneurysm repair in patients with synchronous intra-abdominal malignancy. Eur J Vasc Endovasc Surg. 2016 Dec;52(6):747-56.
http://www.ncbi.nlm.nih.gov/pubmed/27592036?tool=bestpractice.com
[192]Kouvelos GN, Patelis N, Antoniou GA, et al. Management of concomitant abdominal aortic aneurysm and colorectal cancer. J Vasc Surg. 2016 May;63(5):1384-93.
http://www.ncbi.nlm.nih.gov/pubmed/27005754?tool=bestpractice.com
Entre las complicaciones del tratamiento se incluyen eventos cardíacos y pulmonares, isquemia mesentérica, insuficiencia renal, sangrado, infección de la herida o del injerto, isquemia de la médula espinal/paraplejia, embolización/isquemia de las extremidades y complicaciones tardías del injerto (es decir, fístula aortoentérica y seudoaneurisma aórtico).[1]Dehlin JM, Upchurch GR. Management of abdominal aortic aneurysms. Curr Treat Options Cardiovasc Med. 2005 Jun;7(2):119-30.
http://www.ncbi.nlm.nih.gov/pubmed/15935120?tool=bestpractice.com
[193]Johnston KW. Multicenter prospective study of nonruptured abdominal aortic aneurysm. Part II. Variables predicting morbidity and mortality. J Vasc Surg. 1989 Mar;9(3):437-47.
http://www.ncbi.nlm.nih.gov/pubmed/2646460?tool=bestpractice.com
Manejo perioperatorio
Tratamiento de la enfermedad cardíaca coexistente:
La prevención de riesgos cardiovasculares debe ser prioritaria en los pacientes sometidos a los programas de cribado de AAA.[79]National Institute for Health and Care Excellence. Abdominal aortic aneurysm: diagnosis and management. Mar 2020 [internet publication].
https://www.nice.org.uk/guidance/ng156
[194]Saratzis A, Sidloff D, Bown MJ. Cardiovascular risk in patients with small abdominal aortic aneurysms. Poster abstract. Paper presented at: Spring meeting for clinician scientists in training. 2017. Royal College of Physicians, London. Lancet. 2017 Feb 23;389(S89).
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(17)30485-3/fulltext
Las pruebas de esfuerzo no invasivas se deben considerar para pacientes con antecedentes de ≥3 factores de riesgo clínicos (es decir, enfermedad de las arterias coronarias, insuficiencia cardíaca congestiva, accidente cerebrovascular, diabetes mellitus, insuficiencia renal crónica) y una capacidad funcional desconocida o deficiente (MET <4) si tal cambiara el manejo.[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
La revascularización coronaria está indicada para aquellos pacientes que presentan infarto agudo de miocardio con elevación ST, angina inestable o angina estable con enfermedad de la arteria coronaria principal izquierda, o enfermedad de 3 vasos, así como para aquellos pacientes con enfermedad de 2 vasos que incluye la arteria descendente anterior izquierda proximal e isquemia en pruebas no invasivas, o bien una fracción de eyección inferior a 0.5.[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
Sobre la transfusión de sangre:[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
La donación preoperatoria de sangre autóloga puede ser beneficiosa para pacientes que se someten a la reparación abierta de aneurisma.
Se recomienda la utilización de un dispositivo de ultrafiltración o el rescate celular si se prevé una gran pérdida de sangre o si el riesgo de transmisión de enfermedades a través de un banco de sangre se considera elevado.
Se recomienda la transfusión de sangre si el nivel de hemoglobina intraoperatoria es <10 g/dL en presencia de pérdida continua de sangre. Considere el uso de plasma fresco congelado y plaquetas en una proporción de 1:1:1 con concentrados de hematíes.[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
[195]Phillips AR, Tran L, Foust JE, et al. Systematic review of plasma/packed red blood cell ratio on survival in ruptured abdominal aortic aneurysms. J Vasc Surg. 2021 Apr;73(4):1438-44.
https://www.doi.org/10.1016/j.jvs.2020.10.027
http://www.ncbi.nlm.nih.gov/pubmed/33189763?tool=bestpractice.com
No se deben utilizar catéteres en la arteria pulmonar de manera rutinaria en la cirugía de aorta, a menos que haya un riesgo alto de alteración hemodinámica importante.[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
Se recomienda el acceso venoso central para los pacientes sometidos a reparación abierta de aneurisma.[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
Se recomienda la profilaxis para la trombosis venosa profunda consistente en compresión neumática intermitente y deambulación temprana para todos los pacientes que se someten a una reparación abierta o a una EVAR.[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
[196]Bani-Hani MG, AL Khaffaf H, Titi MA, et al. Interventions for preventing venous thromboembolism following abdominal aortic surgery. Cochrane Database Syst Rev. 2008 Jan 23;(1):CD005509.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD005509.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/18254082?tool=bestpractice.com
Evitar la hipotermia durante la reparación abierta y la EVAR puede reducir la duración de la estancia hospitalaria, la duración de la estancia en la UCI y las tasas de disfunción orgánica.[197]Samoila G, Ford RT, Glasbey JC, et al. The significance of hypothermia in abdominal aortic aneurysm repair. Ann Vasc Surg. 2017 Jan;38:323-31.
http://www.ncbi.nlm.nih.gov/pubmed/27531090?tool=bestpractice.com
Reducción del riesgo cardiovascular preoperatorio:
El tratamiento preoperatorio de los factores de riesgo cardiovascular modificables mejora la supervivencia a largo plazo después de la reparación del AAA.[198]Khashram M, Williman JA, Hider PN, et al. Management of modifiable vascular risk factors improves late survival following abdominal aortic aneurysm repair: a systematic review and meta-analysis. Ann Vasc Surg. 2017 Feb;39:301-11.
http://www.ncbi.nlm.nih.gov/pubmed/27666804?tool=bestpractice.com
El entrenamiento preoperatorio con ejercicios redujo las complicaciones cardíacas posquirúrgicas en un pequeño ensayo controlado aleatorio de pacientes sometidos a reparación abierta o endovascular de AAA, aunque una revisión de la Cochrane y una revisión sistemática independiente de la prehabilitación (entrenamiento con ejercicios) antes de la cirugía de AAA no mostraron ningún beneficio en los resultados.[199]Barakat HM, Shahin Y, Khan JA, et al. Preoperative supervised exercise improves outcomes after elective abdominal aortic aneurysm repair: a randomized controlled trial. Ann Surg. 2016 Jul;264(1):47-53.
http://www.ncbi.nlm.nih.gov/pubmed/26756766?tool=bestpractice.com
[200]Fenton C, Tan AR, Abaraogu UO, et al. Prehabilitation exercise therapy before elective abdominal aortic aneurysm repair. Cochrane Database Syst Rev. 2021 Jul 8;7(7):CD013662.
https://www.doi.org/10.1002/14651858.CD013662.pub2
http://www.ncbi.nlm.nih.gov/pubmed/34236703?tool=bestpractice.com
[201]Bonner RJ, Wallace T, Jones AD, et al. The content of pre-habilitative interventions for patients undergoing repair of abdominal aortic aneurysms and their effect on post-operative outcomes: a systematic review. Eur J Vasc Endovasc Surg. 2021 May;61(5):756-65.
https://www.doi.org/10.1016/j.ejvs.2021.01.043
http://www.ncbi.nlm.nih.gov/pubmed/33678532?tool=bestpractice.com
Aunque el entrenamiento preoperatorio con ejercicios puede ser beneficioso para los pacientes sometidos a reparación de AAA, es necesario realizar más estudios con EAC antes de recomendarlo de forma más generalizada.[202]Wee IJY, Choong AMTL. A systematic review of the impact of preoperative exercise for patients with abdominal aortic aneurysm. J Vasc Surg. 2020 Jun;71(6):2123-31.e1.
https://www.doi.org/10.1016/j.jvs.2018.09.039
http://www.ncbi.nlm.nih.gov/pubmed/30606665?tool=bestpractice.com
El uso perioperatorio de estatinas ralentiza el crecimiento del aneurisma, reduce el riesgo de rotura y disminuye la mortalidad por reparación o rotura del AAA.[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
El tratamiento de estatinas debe iniciarse al menos 1 mes antes de la cirugía para reducir la morbilidad y la mortalidad cardiovascular, y continuarse indefinidamente.[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
[143]Risum Ø, Sandven I, Sundhagen JO, et al. Editor's choice - effect of statins on total mortality in abdominal aortic aneurysm repair: a systematic review and meta-analysis. Eur J Vasc Endovasc Surg. 2021 Jan;61(1):114-20.
https://www.doi.org/10.1016/j.ejvs.2020.08.007
http://www.ncbi.nlm.nih.gov/pubmed/32928667?tool=bestpractice.com
Los pacientes con AAA presentan un mayor riesgo de sufrir eventos cardiovasculares adversos graves. La evidencia es limitada, pero en ausencia de contraindicaciones, los pacientes con AAA deben recibir un tratamiento antiplaquetario único (ácido acetilsalicílico o clopidogrel).[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
[144]Aboyans V, Bauersachs R, Mazzolai L, et al. Antithrombotic therapies in aortic and peripheral arterial diseases in 2021: a consensus document from the ESC working group on aorta and peripheral vascular diseases, the ESC working group on thrombosis, and the ESC working group on cardiovascular pharmacotherapy. Eur Heart J. 2021 Oct 14;42(39):4013-24.
https://www.doi.org/10.1093/eurheartj/ehab390
http://www.ncbi.nlm.nih.gov/pubmed/34279602?tool=bestpractice.com
Esto debe continuar durante el periodo perioperatorio.[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
La hipertensión debe controlarse para reducir la morbilidad y la mortalidad cardiovascular.[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
No se recomienda el inicio de betabloqueantes antes de la reparación del AAA.[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
Sin embargo, se puede continuar con un betabloqueante si un paciente ya lo está tomando en una dosis adecuada.[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
Ensayos de gran tamaño muestral en los que el beta-bloqueo se inició unos días antes de la cirugía no han indicado ningún beneficio, o incluso daño, del beta-bloqueo perioperatorio.[203]Brady AR, Gibbs JS, Greenhalgh RM, et al; POBBLE Trial Investigators. Perioperative beta-blockade (Pobble) for patients undergoing infrarenal vascular surgery: results of a randomized double-blind controlled trial. J Vasc Surg. 2005 Apr;41(4):602-9.
https://www.jvascsurg.org/article/S0741-5214(05)00189-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/15874923?tool=bestpractice.com
[204]Devereaux PJ, Yang H, Yusuf S, et al; POISE Study Group. Effects of extended-release metoprolol succinate in patients undergoing non-cardiac surgery (POISE trial): a randomised controlled trial. Lancet. 2008 May 31;371(9627):1839-47.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(08)60601-7/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/18479744?tool=bestpractice.com
[205]Yang H, Raymer K, Butler R, et al. The effects of perioperative beta-blockade: results of the Metoprolol after Vascular Surgery (MaVS) study, a randomized controlled trial. Am Heart J. 2006 Nov;152(5):983-90.
http://www.ncbi.nlm.nih.gov/pubmed/17070177?tool=bestpractice.com
Cobertura antibiótica:
Se indica la antibioticoterapia para los pacientes que se someten a reparación electiva y urgente de rotura de aneurisma de aorta abdominal (AAA) para cubrir microorganismos gramnegativos y grampositivos (es decir, Staphylococcus aureus, Staphylococcus epidermidis y bacilos gramnegativos entéricos) y prevenir la infección del injerto.
Tratamiento de causa infecciosa/inflamatoria
Una vez que el paciente está estable y se ha priorizado la reparación quirúrgica urgente, si está indicada, debe abordarse la etiología infecciosa o inflamatoria.
AAA infeccioso
Si se sospecha que el paciente tiene un aneurisma infeccioso, el diagnóstico temprano y el tratamiento rápido con antibióticos y reparación quirúrgica urgente son esenciales para mejorar los resultados.[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
La reparación quirúrgica abierta se ha considerado tradicionalmente el tratamiento de referencia para los aneurismas infecciosos, aunque datos más recientes sugieren que la EVAR puede asociarse a resultados iguales o superiores.[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
[206]Sörelius K, Budtz-Lilly J, Mani K, et al. Systematic review of the management of mycotic aortic aneurysms. Eur J Vasc Endovasc Surg. 2019 Sep;58(3):426-35.
https://www.doi.org/10.1016/j.ejvs.2019.05.004
http://www.ncbi.nlm.nih.gov/pubmed/31320247?tool=bestpractice.com
A menudo es necesario un desbridamiento extenso. Existe un alto riesgo de complicaciones infecciosas secundarias y puede que sea necesaria una nueva intervención quirúrgica para nuevas lesiones infecciosas.
Deben realizarse cultivos intraoperatorios para orientar con precisión el tratamiento antibiótico posterior; sin embargo, a menudo se administran antibióticos empíricos, ya que los cultivos de sangre periférica y de muestras quirúrgicas son negativos en una gran proporción de pacientes.[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
Puede estar indicado un tratamiento antibiótico prolongado (de 4 a 6 semanas de duración a toda la vida) en función del patógeno específico, el tipo de reparación quirúrgica y el estado inmunológico del paciente.[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
AAA inflamatorio
La aortitis inflamatoria (causada, por ejemplo, por la arteritis de Takayasu o la arteritis de células gigantes) se trata con corticosteroides en dosis altas y cirugía.[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
[207]Ben Jmaà H, Karray R, Jmal H, et al. Surgical and endoluminal management of the inflammatory aortitis: a Tunisian center experience [in French]. J Med Vasc. 2017 Jul;42(4):213-20.
http://www.ncbi.nlm.nih.gov/pubmed/28705339?tool=bestpractice.com
Dado que el tratamiento óptimo de los pacientes con aortitis inflamatoria sigue siendo incierto, los pacientes con aortitis inflamatoria deben ser tratados y seguidos de cerca por un equipo multidisciplinario.[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
El tamoxifeno se ha utilizado solo o en combinación con corticosteroides en la aortitis inflamatoria.[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
[208]Caradu C, Ammollo RP, Dari L, et al. Management of inflammatory aortic aneurysms - a scoping review. Eur J Vasc Endovasc Surg. 2023 Apr;65(4):493-502.
https://www.ejves.com/article/S1078-5884(23)00005-9/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/36623764?tool=bestpractice.com
[209]Vaglio A, Palmisano A, Alberici F, et al. Prednisone versus tamoxifen in patients with idiopathic retroperitoneal fibrosis: an open-label randomised controlled trial. Lancet. 2011 Jul 23;378(9788):338-46.
http://www.ncbi.nlm.nih.gov/pubmed/21733570?tool=bestpractice.com
Sin embargo, la superioridad de la terapia combinada sobre los corticosteroides solos sigue sin estar probada.[210]Scheel PJ Jr, Feeley N, Sozio SM. Combined prednisone and mycophenolate mofetil treatment for retroperitoneal fibrosis: a case series. Ann Intern Med. 2011 Jan 4;154(1):31-6.
http://www.ncbi.nlm.nih.gov/pubmed/21200036?tool=bestpractice.com
El tratamiento quirúrgico de los AAA inflamatorios plantea un desafío diferente para los cirujanos en comparación con los AAA degenerativos estándar debido al mayor riesgo de lesiones iatrogénicas intestinales, cavales, de la vena ilíaca y ureterales durante la reparación quirúrgica abierta y el aumento de la respuesta inflamatoria a la implantación de endoprótesis.[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
Es posible que se requiera la colocación de un stent ureteral preoperatorio para liberar la hidronefrosis y ayudar a la identificación del uréter durante la cirugía.[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
[208]Caradu C, Ammollo RP, Dari L, et al. Management of inflammatory aortic aneurysms - a scoping review. Eur J Vasc Endovasc Surg. 2023 Apr;65(4):493-502.
https://www.ejves.com/article/S1078-5884(23)00005-9/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/36623764?tool=bestpractice.com
No se dispone de pruebas de alto nivel que comparen la reparación abierta y la REVA.[208]Caradu C, Ammollo RP, Dari L, et al. Management of inflammatory aortic aneurysms - a scoping review. Eur J Vasc Endovasc Surg. 2023 Apr;65(4):493-502.
https://www.ejves.com/article/S1078-5884(23)00005-9/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/36623764?tool=bestpractice.com
[211]Capoccia L, Riambau V. Endovascular repair versus open repair for inflammatory abdominal aortic aneurysms. Cochrane Database Syst Rev. 2015 Apr 16;2015(4):CD010313.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD010313.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/25879695?tool=bestpractice.com
Todavía no está claro si la REVA sola tiene algún efecto beneficioso sobre la hidronefrosis, y la fibrosis retroperitoneal parece resolverse a un ritmo más lento en comparación con la reparación abierta.[208]Caradu C, Ammollo RP, Dari L, et al. Management of inflammatory aortic aneurysms - a scoping review. Eur J Vasc Endovasc Surg. 2023 Apr;65(4):493-502.
https://www.ejves.com/article/S1078-5884(23)00005-9/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/36623764?tool=bestpractice.com
Reparación de fuga de aneurisma endovascular (EVAR)
Una endofuga es un flujo sanguíneo persistente fuera del injerto y dentro del saco del aneurisma.[212]Schurink GW, Aarts NJ, vanBockel JH. Endoleak after stent-graft treatment of abdominal aortic aneurysm: a meta-analysis of clinical studies. Br J Surg. 1999 May;86(5):581-7.
http://www.ncbi.nlm.nih.gov/pubmed/10361173?tool=bestpractice.com
[213]Veith FJ, Baum RA, Ohki T, et al. Nature and significance of endoleaks and endotension: summary of opinions expressed at an international conference. J Vasc Surg. 2002 May;35(5):1029-35.
http://www.ncbi.nlm.nih.gov/pubmed/12021724?tool=bestpractice.com
No es una complicación posterior a la reparación abierta; es específica de la reparación endovascular del aneurisma (EVAR).
La vigilancia posoperatoria puede detectar endofugas importantes y una expansión de la bolsa de aneurisma.
El riesgo de endofuga luego de una EVAR es del 24%.[212]Schurink GW, Aarts NJ, vanBockel JH. Endoleak after stent-graft treatment of abdominal aortic aneurysm: a meta-analysis of clinical studies. Br J Surg. 1999 May;86(5):581-7.
http://www.ncbi.nlm.nih.gov/pubmed/10361173?tool=bestpractice.com
Existen cinco tipos de fugas internas.[5]Isselbacher EM, Preventza O, Hamilton Black J 3rd, et al. 2022 ACC/AHA guideline for the diagnosis and management of aortic disease: a report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec 13;146(24):e334-e482.
https://www.doi.org/10.1161/CIR.0000000000001106
http://www.ncbi.nlm.nih.gov/pubmed/36322642?tool=bestpractice.com
Tipo I:
Fuga en el sitio de inserción (tipo IA en el extremo proximal del endoinjerto u oclusor ilíaco; tipo IB en el extremo distal); por lo general, pueden producirse fugas inmediatas, pero tardías.[Figure caption and citation for the preceding image starts]: Endofuga tipo I en anastomosis distal de la ilíaca izquierda (fuga marcada con un círculo)University of Michigan, específicamente los casos del Dr. Upchurch que reflejan los Departamentos de Cirugía Vascular y Radiología [Citation ends].
Debe hacerse todo lo posible para reparar la fuga interna de tipo I antes de completar el procedimiento (p. ej., moldeado con balón de la zona de sellado proximal, colocación de un manguito proximal, endostaples, embolización líquida).[214]van Schaik TG, Meekel JP, Hoksbergen AWJ, et al. Systematic review of embolization of type I endoleaks using liquid embolic agents. J Vasc Surg. 2021 Sep;74(3):1024-32.
https://www.doi.org/10.1016/j.jvs.2021.03.061
http://www.ncbi.nlm.nih.gov/pubmed/33940072?tool=bestpractice.com
La endofuga persistente de tipo IA puede requerir la conversión a reparación abierta, siempre que el riesgo quirúrgico sea aceptable.[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
[215]Perini P, Bianchini Massoni C, Mariani E, et al. Systematic review and meta-analysis of the outcome of different treatments for type 1a endoleak after EVAR. Ann Vasc Surg. 2019 Oct;60:435-46.e1.
http://www.ncbi.nlm.nih.gov/pubmed/31200054?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: Extensión de endoprótesis expandida para la misma endofuga tipo I (marcada con un círculo)University of Michigan, específicamente los casos del Dr. Upchurch que reflejan los Departamentos de Cirugía Vascular y Radiología [Citation ends]. [Figure caption and citation for the preceding image starts]: Resolución de la endofuga tipo I, resuelta con la expansión de la extensiónUniversity of Michigan, específicamente los casos del Dr. Upchurch que reflejan los Departamentos de Cirugía Vascular y Radiología [Citation ends].
[Figure caption and citation for the preceding image starts]: Resolución de la endofuga tipo I, resuelta con la expansión de la extensiónUniversity of Michigan, específicamente los casos del Dr. Upchurch que reflejan los Departamentos de Cirugía Vascular y Radiología [Citation ends].
Tipo II:
Fuga persistente de rama.[Figure caption and citation for the preceding image starts]: Fuga interna de tipo II (rodeada) descubierta en tomografía computarizada de seguimientoUniversity of Michigan, específicamente los casos del Dr. Upchurch que reflejan los Departamentos de Cirugía Vascular y Radiología [Citation ends].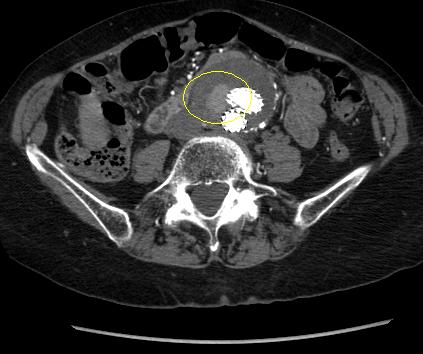
Puede ocurrir una resolución espontánea, aunque la persistencia puede provocar un crecimiento del saco.[216]Higashiura W, Greenberg RK, Katz E, et al. Predictive factors, morphologic effects, and proposed treatment paradigm for type II endoleaks after repair of infrarenal abdominal aortic aneurysms. J Vasc Interv Radiol. 2007 Aug;18(8):975-81.
http://www.ncbi.nlm.nih.gov/pubmed/17675614?tool=bestpractice.com
Si se observa una endofuga de tipo II u otra alteración preocupante en la imagen por TC con contraste 1 mes después de haber realizado la EVAR, se recomienda realizar un estudio por imágenes postoperatorio a los 6 meses.[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
Alrededor del 50% de las fugas internas de tipo II se diagnostican antes de los 30 días de seguimiento; el 40% después de 30 días, y el 8% se diagnostican después de 12 meses de seguimiento.[217]Charisis N, Bouris V, Conway AM, et al. A systematic review and pooled meta-analysis on the incidence and temporal occurrence of type II endoleak following an abdominal aortic aneurysm repair. Ann Vasc Surg. 2021 Aug;75:406-19.
http://www.ncbi.nlm.nih.gov/pubmed/33549794?tool=bestpractice.com
El tratamiento es tema de controversia y se recomienda si persiste a los 6 a 12 meses o si el tamaño de la bolsa de aneurisma aumenta de tal modo que pueden poner en riesgo las zonas de sello proximal y/o distal.[218]Mansueto G, Cenzi D, Scuro A, et al. Treatment of type II endoleak with a transcatheter transcaval approach: results at 1-year follow-up. J Vasc Surg. 2007 Jun;45(6):1120-7.
http://www.ncbi.nlm.nih.gov/pubmed/17543674?tool=bestpractice.com
[219]Baum RA, Stavropoulos SW, Fairman RM, et al. Endoleaks after endovascular repair of abdominal aortic aneurysms. J Vasc Interv Radiol. 2003 Sep;14(9 Pt 1):1111-7.
http://www.ncbi.nlm.nih.gov/pubmed/14514802?tool=bestpractice.com
[220]Van Marrewijk CJ, Fransen G, Laheij RJ, et al. Is a type II endoleak after EVAR a harbinger of risk? Causes and outcome of open conversion and aneurysm rupture during follow-up. Eur J Vasc Endovasc Surg. 2004 Feb;27(2):128-37.
http://www.ncbi.nlm.nih.gov/pubmed/14718893?tool=bestpractice.com
[221]Harris PL, Vallabhaneni SR, Desgranges P, et al. Incidence and risk factors of late rupture, conversion, and death after endovascular repair of infrarenal aortic aneurysms: the EUROSTAR experience. J Vasc Surg. 2000 Oct;32(4):739-49.
http://www.ncbi.nlm.nih.gov/pubmed/11013038?tool=bestpractice.com
[222]Ultee KHJ, Büttner S, Huurman R, et al. Editor's choice - systematic review and meta-analysis of the outcome of treatment for type II endoleak following endovascular aneurysm repair. Eur J Vasc Endovasc Surg. 2018 Dec;56(6):794-807.
https://www.doi.org/10.1016/j.ejvs.2018.06.009
http://www.ncbi.nlm.nih.gov/pubmed/30104089?tool=bestpractice.com
[223]Smith T, Quencer KB. Best practice guidelines: imaging surveillance after endovascular aneurysm repair. AJR Am J Roentgenol. 2020 May;214(5):1165-74.
https://www.doi.org/10.2214/AJR.19.22197
http://www.ncbi.nlm.nih.gov/pubmed/32130043?tool=bestpractice.com
El tratamiento de elección es la embolización transarterial con espiral, aunque también se han reportado la ligadura laparoscópica de ramas colaterales, la punción translumbar directa del saco, la embolización translumbar y la embolización transcaval transcatéter.[213]Veith FJ, Baum RA, Ohki T, et al. Nature and significance of endoleaks and endotension: summary of opinions expressed at an international conference. J Vasc Surg. 2002 May;35(5):1029-35.
http://www.ncbi.nlm.nih.gov/pubmed/12021724?tool=bestpractice.com
[218]Mansueto G, Cenzi D, Scuro A, et al. Treatment of type II endoleak with a transcatheter transcaval approach: results at 1-year follow-up. J Vasc Surg. 2007 Jun;45(6):1120-7.
http://www.ncbi.nlm.nih.gov/pubmed/17543674?tool=bestpractice.com
[219]Baum RA, Stavropoulos SW, Fairman RM, et al. Endoleaks after endovascular repair of abdominal aortic aneurysms. J Vasc Interv Radiol. 2003 Sep;14(9 Pt 1):1111-7.
http://www.ncbi.nlm.nih.gov/pubmed/14514802?tool=bestpractice.com
[220]Van Marrewijk CJ, Fransen G, Laheij RJ, et al. Is a type II endoleak after EVAR a harbinger of risk? Causes and outcome of open conversion and aneurysm rupture during follow-up. Eur J Vasc Endovasc Surg. 2004 Feb;27(2):128-37.
http://www.ncbi.nlm.nih.gov/pubmed/14718893?tool=bestpractice.com
[224]Steinmetz E, Rubin BG, Sanchez LA, et al. Type II endoleak after endovascular abdominal aortic aneurysm repair: a conservative approach with selective intervention is safe and cost-effective. J Vasc Surg. 2004 Feb;39(2):306-13.
http://www.ncbi.nlm.nih.gov/pubmed/14743129?tool=bestpractice.com
[225]Baum RA, Cope C, Fairman, et al. Translumbar embolization of type 2 endoleaks after endovascular repair of abdominal aortic aneurysms. J Vasc Interv Radiol. 2001 Jan;12(1):111-6.
http://www.ncbi.nlm.nih.gov/pubmed/11200344?tool=bestpractice.com
[226]Baum RA, Carpenter JP, Golden MA, et al. Treatment of type 2 endoleaks after endovascular repair of abdominal aortic aneurysms: comparison of transarterial and translumbar techniques. J Vasc Surg. 2002 Jan;35(1):23-9.
http://www.ncbi.nlm.nih.gov/pubmed/11802129?tool=bestpractice.com
[227]Schmid R, Gurke L, Aschwanden M, et al. CT-guided percutaneous embolization of a lumbar artery maintaining a type II endoleak. J Endovasc Ther. 2002 Apr;9(2):198-202.
http://www.ncbi.nlm.nih.gov/pubmed/12010100?tool=bestpractice.com
[228]Chin KM, Lee SQW, Lee HJ, et al. Preservation of stent graft after iatrogenic type III endoleak during open transperitoneal surgical intervention for complicated type II endoleak. Ann Vasc Surg. 2020 Jan;62:496.e1-496.e7.
http://www.ncbi.nlm.nih.gov/pubmed/31394250?tool=bestpractice.com
[229]Li Q, Hou P. Sac embolization and side branch embolization for preventing type II endoleaks after endovascular aneurysm repair: a meta-analysis. J Endovasc Ther. 2020 Feb;27(1):109-16.
https://www.doi.org/10.1177/1526602819878411
http://www.ncbi.nlm.nih.gov/pubmed/31566053?tool=bestpractice.com
[230]Akmal MM, Pabittei DR, Prapassaro T, et al. A systematic review of the current status of interventions for type II endoleak after EVAR for abdominal aortic aneurysms. Int J Surg. 2021 Nov;95:106138.
https://www.doi.org/10.1016/j.ijsu.2021.106138
http://www.ncbi.nlm.nih.gov/pubmed/34637951?tool=bestpractice.com
[231]Yu HYH, Lindström D, Wanhainen A, et al. Systematic review and meta-analysis of prophylactic aortic side branch embolization to prevent type II endoleaks. J Vasc Surg. 2020 Nov;72(5):1783-1792.e1.
https://www.doi.org/10.1016/j.jvs.2020.05.020
http://www.ncbi.nlm.nih.gov/pubmed/32442608?tool=bestpractice.com
[232]Zhang X, Ji L, Chen MY, et al. Transarterial embolization versus translumber embolization for type Ⅱ endoleak after endovascular abdominal aortic aneurysm repair: a meta-analysis. Chin Med Sci J. 2020 Jun 30;35(2):135-41.
https://www.doi.org/10.24920/003618
http://www.ncbi.nlm.nih.gov/pubmed/32684233?tool=bestpractice.com
Tipo III:
Defecto en el injerto y fuga a través de roturas en el material, desconexión del injerto o desintegración del material.[212]Schurink GW, Aarts NJ, vanBockel JH. Endoleak after stent-graft treatment of abdominal aortic aneurysm: a meta-analysis of clinical studies. Br J Surg. 1999 May;86(5):581-7.
http://www.ncbi.nlm.nih.gov/pubmed/10361173?tool=bestpractice.com
[213]Veith FJ, Baum RA, Ohki T, et al. Nature and significance of endoleaks and endotension: summary of opinions expressed at an international conference. J Vasc Surg. 2002 May;35(5):1029-35.
http://www.ncbi.nlm.nih.gov/pubmed/12021724?tool=bestpractice.com
[233]Kwon J, Dimuzio P, Salvatore D, et al. Incidence of stent graft failure from type IIIB endoleak in contemporary endovascular abdominal aortic aneurysm repair. J Vasc Surg. 2020 Feb;71(2):645-53.
https://www.doi.org/10.1016/j.jvs.2019.06.183
http://www.ncbi.nlm.nih.gov/pubmed/31466740?tool=bestpractice.com
Se indica la reparación en el momento de su descubrimiento (extensión de la endoprótesis endovascular).[3]Wanhainen A, Van Herzeele I, Bastos Goncalves F, et al. Editor's choice -- European Society for Vascular Surgery (ESVS) 2024 clinical practice guidelines on the management of abdominal aorto-iliac artery aneurysms. Eur J Vasc Endovasc Surg. 2024 Feb;67(2):192-331.
https://www.ejves.com/article/S1078-5884(23)00889-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/38307694?tool=bestpractice.com
[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
[219]Baum RA, Stavropoulos SW, Fairman RM, et al. Endoleaks after endovascular repair of abdominal aortic aneurysms. J Vasc Interv Radiol. 2003 Sep;14(9 Pt 1):1111-7.
http://www.ncbi.nlm.nih.gov/pubmed/14514802?tool=bestpractice.com
[223]Smith T, Quencer KB. Best practice guidelines: imaging surveillance after endovascular aneurysm repair. AJR Am J Roentgenol. 2020 May;214(5):1165-74.
https://www.doi.org/10.2214/AJR.19.22197
http://www.ncbi.nlm.nih.gov/pubmed/32130043?tool=bestpractice.com
[234]Lowe C, Hansrani V, Madan M, et al. Type IIIb endoleak after elective endovascular aneurysm repair: a systematic review. J Cardiovasc Surg (Torino). 2020 Jun;61(3):308-16.
http://www.ncbi.nlm.nih.gov/pubmed/29616524?tool=bestpractice.com
Tipo IV:
Fuga debido a la porosidad de la pared del injerto.[212]Schurink GW, Aarts NJ, vanBockel JH. Endoleak after stent-graft treatment of abdominal aortic aneurysm: a meta-analysis of clinical studies. Br J Surg. 1999 May;86(5):581-7.
http://www.ncbi.nlm.nih.gov/pubmed/10361173?tool=bestpractice.com
[213]Veith FJ, Baum RA, Ohki T, et al. Nature and significance of endoleaks and endotension: summary of opinions expressed at an international conference. J Vasc Surg. 2002 May;35(5):1029-35.
http://www.ncbi.nlm.nih.gov/pubmed/12021724?tool=bestpractice.com
Estas fugas son infrecuentes y autolimitantes con endoprótesis más nuevas.[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
[219]Baum RA, Stavropoulos SW, Fairman RM, et al. Endoleaks after endovascular repair of abdominal aortic aneurysms. J Vasc Interv Radiol. 2003 Sep;14(9 Pt 1):1111-7.
http://www.ncbi.nlm.nih.gov/pubmed/14514802?tool=bestpractice.com
Tipo V (endotensión):
La endotensión es el aumento de presión intrasaco luego de la EVAR. La endofuga no se visualiza en exploraciones tardías por TC con contraste.
La endotensión es menos frecuente con los injertos de nueva generación.[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
No hay método estandarizado para medir la endotensión ni consenso sobre la terapia indicada en ausencia de agrandamiento de aneurisma; sin embargo, se sugiere realizar un tratamiento de la endotensión para evitar la rotura del aneurisma en pacientes seleccionados con expansión continua de aneurisma.[77]Chaikof EL, Dalman RL, Eskandari MK, et al. The Society for Vascular Surgery practice guidelines on the care of patients with an abdominal aortic aneurysm. J Vasc Surg. 2018 Jan;67(1):2-77.e2.
https://www.jvascsurg.org/article/S0741-5214(17)32369-8/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/29268916?tool=bestpractice.com
[213]Veith FJ, Baum RA, Ohki T, et al. Nature and significance of endoleaks and endotension: summary of opinions expressed at an international conference. J Vasc Surg. 2002 May;35(5):1029-35.
http://www.ncbi.nlm.nih.gov/pubmed/12021724?tool=bestpractice.com
[223]Smith T, Quencer KB. Best practice guidelines: imaging surveillance after endovascular aneurysm repair. AJR Am J Roentgenol. 2020 May;214(5):1165-74.
https://www.doi.org/10.2214/AJR.19.22197
http://www.ncbi.nlm.nih.gov/pubmed/32130043?tool=bestpractice.com

 ]
Una revisión sistemática (4 ensayos, 3314 participantes) encontró evidencia de alta calidad que demuestra que la reparación inmediata del AAA pequeño (de 4 cm a 5.5 cm) no mejoró la supervivencia a largo plazo, en comparación con la vigilancia (CRI ajustado 0.88, IC del 95%: 0.75 a 1.02; seguimiento medio de 10 años).[134] La falta de beneficio atribuible a la cirugía inmediata fue consistente, independientemente de la edad del paciente, el diámetro del aneurisma pequeño y si la reparación fue endovascular o abierta.[134]
]
Una revisión sistemática (4 ensayos, 3314 participantes) encontró evidencia de alta calidad que demuestra que la reparación inmediata del AAA pequeño (de 4 cm a 5.5 cm) no mejoró la supervivencia a largo plazo, en comparación con la vigilancia (CRI ajustado 0.88, IC del 95%: 0.75 a 1.02; seguimiento medio de 10 años).[134] La falta de beneficio atribuible a la cirugía inmediata fue consistente, independientemente de la edad del paciente, el diámetro del aneurisma pequeño y si la reparación fue endovascular o abierta.[134] ]
]
 ]
No se dispone de datos a largo plazo sobre la durabilidad de los dispositivos de bajo perfil.[Figure caption and citation for the preceding image starts]: Varias endoprótesis endovasculares utilizadas en la reparación endovascular (EVAR) del aneurismaUniversity of Michigan, específicamente los casos del Dr. Upchurch que reflejan los Departamentos de Cirugía Vascular y Radiología [Citation ends].
]
No se dispone de datos a largo plazo sobre la durabilidad de los dispositivos de bajo perfil.[Figure caption and citation for the preceding image starts]: Varias endoprótesis endovasculares utilizadas en la reparación endovascular (EVAR) del aneurismaUniversity of Michigan, específicamente los casos del Dr. Upchurch que reflejan los Departamentos de Cirugía Vascular y Radiología [Citation ends]. [Figure caption and citation for the preceding image starts]: Reparación de aneurisma endovascular (EVAR)University of Michigan, específicamente los casos del Dr. Upchurch que reflejan los Departamentos de Cirugía Vascular y Radiología [Citation ends].
[Figure caption and citation for the preceding image starts]: Reparación de aneurisma endovascular (EVAR)University of Michigan, específicamente los casos del Dr. Upchurch que reflejan los Departamentos de Cirugía Vascular y Radiología [Citation ends].

 [Figure caption and citation for the preceding image starts]: Resolución de la endofuga tipo I, resuelta con la expansión de la extensiónUniversity of Michigan, específicamente los casos del Dr. Upchurch que reflejan los Departamentos de Cirugía Vascular y Radiología [Citation ends].
[Figure caption and citation for the preceding image starts]: Resolución de la endofuga tipo I, resuelta con la expansión de la extensiónUniversity of Michigan, específicamente los casos del Dr. Upchurch que reflejan los Departamentos de Cirugía Vascular y Radiología [Citation ends].