Mulheres menopausadas
Antes de iniciar a farmacoterapia para osteoporose, as causas secundárias de perda óssea devem ser descartadas; a farmacoterapia para osteoporose em mulheres menopausadas é recomendada para pacientes com alto risco de fratura que atendem a qualquer um dos seguintes critérios:[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
[108]Eastell R, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society* clinical practice guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1595-622.
https://www.endocrine.org/clinical-practice-guidelines/osteoporosis-in-postmenopausal-women
http://www.ncbi.nlm.nih.gov/pubmed/30907953?tool=bestpractice.com
T-score -2.5 ou menos por absorciometria por dupla emissão de raios X (DEXA) do colo do fêmur, quadril total, coluna lombar ou 33% do raio
História de fratura por fragilidade, inclusive fratura vertebral assintomática
T entre -1.0 e -2.5 e aumento do risco de fratura, conforme determinado por uma ferramenta formal de avaliação de risco clínico
Se os pacientes atenderem aos critérios, a consideração do uso de farmacoterapia para osteoporose em mulheres menopausadas deve incluir o seguinte:[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
Tipo de tratamento
Momento de início
Duração do tratamento
Interrupção temporária do medicamento para reduzir os efeitos adversos
Manejo da perda óssea quando a terapia é descontinuada
Momento de reinício da terapia
Indicação para encaminhamento a um endocrinologista ou outro especialista em osteoporose
[Figure caption and citation for the preceding image starts]: Tratamento de mulheres menopausadas sem osteoporose não induzida por glicocorticoideCriado pelo BMJ Knowledge Centre [Citation ends].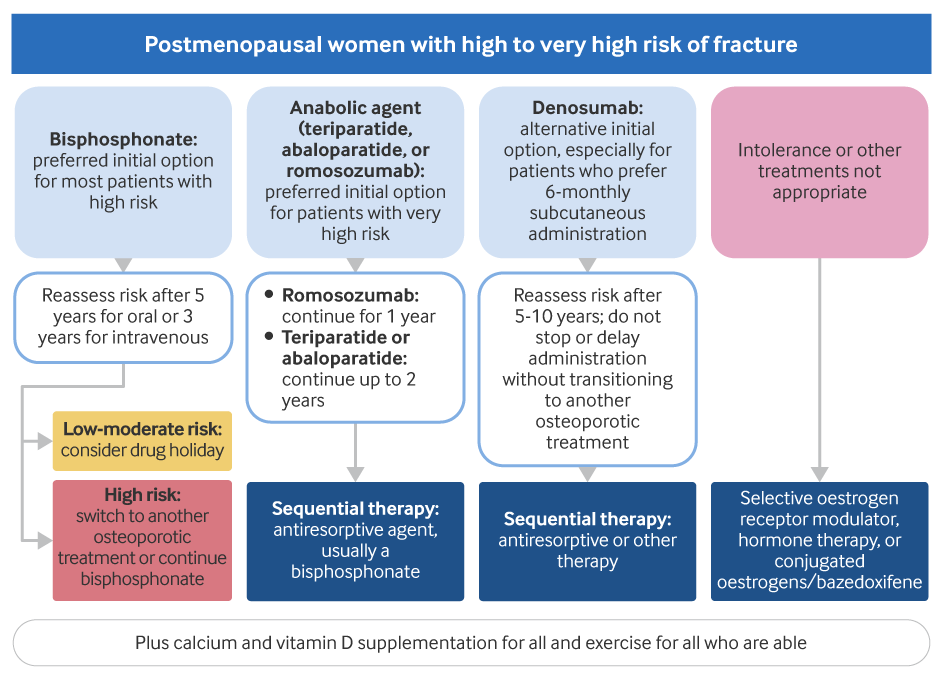
Bifosfonatos
Os bifosfonatos (por exemplo, ácido alendrônico, ácido ibandrônico, risedronato e ácido zoledrônico) são indicados para o tratamento da osteoporose em mulheres menopausadas.[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
[109]Rosenberg K. Bisphosphonates likely beneficial for most older women with osteoporosis. Am J Nurs. 2022 Apr 1;122(4):57.
http://www.ncbi.nlm.nih.gov/pubmed/35348523?tool=bestpractice.com
Eles aumentam efetivamente a DMO e reduzem o risco de fraturas vertebrais e não vertebrais.[110]Bilezikian JP. Efficacy of bisphosphonates in reducing fracture risk in postmenopausal osteoporosis. Am J Med. 2009 Feb;122(2 Suppl):S14-21.
http://www.ncbi.nlm.nih.gov/pubmed/19187808?tool=bestpractice.com
[111]Zhao S, Zhao W, Du D, et al. Effect of bisphosphonate on hip fracture in patients with osteoporosis or osteopenia according to age: a meta-analysis and systematic review. J Investig Med. 2022 Mar;70(3):837-43.
https://journals.sagepub.com/doi/10.1136/jim-2021-001961
http://www.ncbi.nlm.nih.gov/pubmed/34893517?tool=bestpractice.com
Isto com exceção do ibandronato, que apenas demonstrou diminuir o risco de fratura femoral em populações de alto risco com T-score de DMO do colo do fêmur de -3 ou menos por análise post-hoc.[112]Chesnut CH 3rd, Skag A, Christiansen C, et al. Effects of oral ibandronate administered daily or intermittently on fracture risk in postmenopausal osteoporosis. J Bone Miner Res. 2004 Aug;19(8):1241-9.
https://onlinelibrary.wiley.com/doi/full/10.1359/JBMR.040325
http://www.ncbi.nlm.nih.gov/pubmed/15231010?tool=bestpractice.com
Os bifosfonatos são o tratamento de primeira linha para mulheres menopausadas com alto risco de fraturas e com fraturas de quadril ou vertebrais prévias e/ou T-score de DEXA ≤-2.5. Recomenda-se que o tratamento seja iniciado no momento do diagnóstico.[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
[67]Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, et al. Pharmacologic treatment of primary osteoporosis or low bone mass to prevent fractures in adults: a living clinical guideline from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://www.acpjournals.org/doi/full/10.7326/M22-1034
http://www.ncbi.nlm.nih.gov/pubmed/36592456?tool=bestpractice.com
[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
[108]Eastell R, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society* clinical practice guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1595-622.
https://www.endocrine.org/clinical-practice-guidelines/osteoporosis-in-postmenopausal-women
http://www.ncbi.nlm.nih.gov/pubmed/30907953?tool=bestpractice.com
Bifosfonatos também podem ser usados em mulheres com risco muito alto de fratura (por exemplo, T-score muito baixo e história de fraturas vertebrais graves ou múltiplas, fratura recente ou vários fatores de risco para fratura), mas as diretrizes recomendam o tratamento inicial com um agente anabólico como opção preferida para esses pacientes.[67]Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, et al. Pharmacologic treatment of primary osteoporosis or low bone mass to prevent fractures in adults: a living clinical guideline from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://www.acpjournals.org/doi/full/10.7326/M22-1034
http://www.ncbi.nlm.nih.gov/pubmed/36592456?tool=bestpractice.com
[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
[81]Royal Australian College of General Practitioners. Osteoporosis management and fracture prevention in post-menopausal women and men >50 years of age. Mar 2024 [internet publication].
https://www.racgp.org.au/clinical-resources/clinical-guidelines/key-racgp-guidelines/view-all-racgp-guidelines/osteoporosis/executive-summary
[113]Shoback D, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society guideline update. J Clin Endocrinol Metab. 2020 Mar 1;105(3):dgaa048.
https://academic.oup.com/jcem/article/105/3/587/5739968
http://www.ncbi.nlm.nih.gov/pubmed/32068863?tool=bestpractice.com
[114]Tai TW, Chen HY, Shih CA, et al. Asia-Pacific consensus on long-term and sequential therapy for osteoporosis. Osteoporos Sarcopenia. 2024 Mar;10(1):3-10.
https://pmc.ncbi.nlm.nih.gov/articles/PMC11056428
http://www.ncbi.nlm.nih.gov/pubmed/38690538?tool=bestpractice.com
Os bifosfonatos orais reduzem o risco de fratura em mulheres com fraturas por fragilidade prévias.[115]Saito T, Sterbenz JM, Malay S, et al. Effectiveness of anti-osteoporotic drugs to prevent secondary fragility fractures: systematic review and meta-analysis. Osteoporos Int. 2017 Dec;28(12):3289-300.
http://www.ncbi.nlm.nih.gov/pubmed/28770272?tool=bestpractice.com
[116]Lee SY, Jung SH, Lee SU, et al. Can bisphosphonates prevent recurrent fragility fractures? A systematic review and meta-analysis of randomized controlled trials. J Am Med Dir Assoc. 2018 May;19(5):384-90.
http://www.ncbi.nlm.nih.gov/pubmed/29704927?tool=bestpractice.com
A interrupção temporária do medicamento para pacientes com risco baixo a moderado de fratura deve ser considerada para pacientes:[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
Estáveis após 5 anos de tratamento com bifosfonatos orais, ou
Após 3 anos de tratamento com ácido zoledrônico.
Para pacientes com alto risco de fratura, sugere-se o tratamento prolongado por até 10 anos com bifosfonatos orais ou até 6 anos com ácido zoledrônico.[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
Os efeitos adversos dos bifosfonatos orais referem-se principalmente ao trato gastrointestinal superior e incluem dificuldade de deglutição, esofagite e úlceras gástricas. Dor articular e muscular, osteonecrose da mandíbula e fraturas atípicas do fêmur também foram relatadas.[117]Shane E, Burr D, Abrahamsen B, et al. Atypical subtrochanteric and diaphyseal femoral fractures: second report of a task force of the American Society for Bone and Mineral Research. J Bone Miner Res. 2014 Jan;29(1):1-23.
https://onlinelibrary.wiley.com/doi/full/10.1002/jbmr.1998
http://www.ncbi.nlm.nih.gov/pubmed/23712442?tool=bestpractice.com
[118]Abrahamsen B. Adverse effects of bisphosphonates. Calcif Tissue Int. 2010 Jun;86(6):421-35.
http://www.ncbi.nlm.nih.gov/pubmed/20407762?tool=bestpractice.com
[119]Lee S, Yin RV, Hirpara H, et al. Increased risk for atypical fractures associated with bisphosphonate use. Fam Pract. 2015 Jun;32(3):276-81.
http://fampra.oxfordjournals.org/content/32/3/276.long
http://www.ncbi.nlm.nih.gov/pubmed/25846215?tool=bestpractice.com
[120]Wysowski DK, Chang JT. Alendronate and risedronate: reports of severe bone, joint and muscle pain. Arch Intern Med. 2005 Feb 14;165(3):346-7.
http://www.ncbi.nlm.nih.gov/pubmed/15710802?tool=bestpractice.com
[121]Khan AA, Sándor GK, Dore E, et al. Bisphosphonate associated osteonecrosis of the jaw. J Rheumatol. 2009 Mar;36(3):478-90.
http://www.ncbi.nlm.nih.gov/pubmed/19286860?tool=bestpractice.com
[122]Woo SB, Hellstein JW, Kalmar JR. Narrative [corrected] review: bisphosphonates and osteonecrosis of the jaws. Ann Intern Med. 2006 May 16;144(10):753-61.
http://www.ncbi.nlm.nih.gov/pubmed/16702591?tool=bestpractice.com
Uma grande revisão sistemática e metanálise de mais de 650,000 pacientes mostrou um aumento do risco de fraturas atípicas com bifosfonatos.[119]Lee S, Yin RV, Hirpara H, et al. Increased risk for atypical fractures associated with bisphosphonate use. Fam Pract. 2015 Jun;32(3):276-81.
http://fampra.oxfordjournals.org/content/32/3/276.long
http://www.ncbi.nlm.nih.gov/pubmed/25846215?tool=bestpractice.com
Uma pesquisa adicional concluiu que os benefícios do tratamento com bifosfonato superam o risco de fratura de fêmur atípica, principalmente em pacientes tratados por 3-5 anos.[123]Black DM, Abrahamsen B, Bouxsein ML, et al. Atypical femur fractures: review of epidemiology, relationship to bisphosphonates, prevention, and clinical management. Endocr Rev. 2019 Apr 1;40(2):333-68.
https://academic.oup.com/edrv/article/40/2/333/5082430
http://www.ncbi.nlm.nih.gov/pubmed/30169557?tool=bestpractice.com
Está surgindo um consenso sobre estratégias para prevenir a fratura de fêmur atípica em pacientes tratados com bifosfonatos, inclusive a interrupção temporária do medicamento após o uso por 5 anos em alguns pacientes.[123]Black DM, Abrahamsen B, Bouxsein ML, et al. Atypical femur fractures: review of epidemiology, relationship to bisphosphonates, prevention, and clinical management. Endocr Rev. 2019 Apr 1;40(2):333-68.
https://academic.oup.com/edrv/article/40/2/333/5082430
http://www.ncbi.nlm.nih.gov/pubmed/30169557?tool=bestpractice.com
Ácido alendrônico e risedronato:[124]Barrionuevo P, Kapoor E, Asi N, et al. Efficacy of pharmacological therapies for the prevention of fractures in postmenopausal women: a network meta-analysis. J Clin Endocrinol Metab. 2019 May 1;104(5):1623-30.
https://academic.oup.com/jcem/article/104/5/1623/5418882
http://www.ncbi.nlm.nih.gov/pubmed/30907957?tool=bestpractice.com
[125]Black DM, Schwartz AV, Ensrud KE, et al. Effects of continuing or stopping alendronate after 5 years of treatment: the Fracture Intervention Trial Long-term Extension (FLEX): a randomized trial. JAMA. 2006 Dec 27;296(24):2927-38.
http://jama.jamanetwork.com/article.aspx?articleid=204789
http://www.ncbi.nlm.nih.gov/pubmed/17190893?tool=bestpractice.com
[126]Schwartz AV, Bauer DC, Cummings SR, et al. Efficacy of continued alendronate for fractures in women with and without prevalent vertebral fracture: the FLEX trial. J Bone Miner Res. 2010 May;25(5):976-82.
https://onlinelibrary.wiley.com/doi/10.1002/jbmr.11
http://www.ncbi.nlm.nih.gov/pubmed/20200926?tool=bestpractice.com
[127]Roux C, Seeman E, Eastell R, et al. Efficacy of risedronate on clinical vertebral fractures within six months. Curr Med Res Opin. 2004 Apr;20(4):433-9.
http://www.ncbi.nlm.nih.gov/pubmed/15119979?tool=bestpractice.com
[128]Watts NB, Chines A, Olszynski WP, et al. Fracture risk remains reduced one year after discontinuation of risedronate. Osteoporos Int. 2008 Mar;19(3):365-72.
http://www.ncbi.nlm.nih.gov/pubmed/17938986?tool=bestpractice.com
[129]Watts NB, Diab DL. Long-term use of bisphosphonates in osteoporosis. J Clin Endocrinol Metab. 2010 Apr;95(4):1555-65.
http://www.ncbi.nlm.nih.gov/pubmed/20173017?tool=bestpractice.com
Ácido alendrônico e risedronato foram os primeiros bifosfonatos aprovados para o tratamento da osteoporose em mulheres menopausadas e continuam entre os tratamentos para osteoporose mais prescritos. Ambos demonstraram reduzir o risco de fratura do quadril, vertebral e não vertebral.
Em um ensaio clínico de extensão controlado por placebo, as mulheres que continuaram o tratamento com ácido alendrônico por 10 anos apresentaram um risco significativamente menor de fraturas vertebrais clinicamente reconhecidas, em comparação com aquelas que descontinuaram o ácido alendrônico após 5 anos. O risco de fraturas não vertebrais não foi significativamente diferente entre os dois grupos em geral, mas uma análise post-hoc constatou que a continuação do tratamento com ácido alendrônico por 10 anos reduziu o risco de fraturas não vertebrais em um subgrupo de mulheres com T-score de ≤-2.5 e ausência de fratura vertebral após 5 anos de tratamento. Não houve benefício na continuação do tratamento com ácido alendrônico por mais de 5 anos em pessoas com T-score >-2.0.
A análise dos ensaios clínicos Vertebral Efficacy with Risedronate Therapy (VERT) sugere que risedronato reduz o risco de fraturas vertebrais em 6 meses de tratamento. Ensaios clínicos dão suporte à eficácia sustentada de risedronato por 5-7 anos de tratamento, e um benefício antifratura continuado por 1 ano após interromper o tratamento.
Ibandronato:[108]Eastell R, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society* clinical practice guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1595-622.
https://www.endocrine.org/clinical-practice-guidelines/osteoporosis-in-postmenopausal-women
http://www.ncbi.nlm.nih.gov/pubmed/30907953?tool=bestpractice.com
[130]Adami S, Felsenberg D, Christiansen C, et al. Efficacy and safety of ibandronate given by intravenous injection once every 3 months. Bone. 2004 May;34(5):881-9.
http://www.ncbi.nlm.nih.gov/pubmed/15121020?tool=bestpractice.com
[131]Stakkestad JA, Benevolenskaya LI, Stepan JJ, et al; Ibandronate Intravenous Study Group. Intravenous ibandronate injections given every three months: a new treatment option to prevent bone loss in postmenopausal women. Ann Rheum Dis. 2003 Oct;62(10):969-75.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1754320
http://www.ncbi.nlm.nih.gov/pubmed/12972476?tool=bestpractice.com
Pode reduzir a fratura vertebral, mas seus efeitos na redução da fratura do quadril e fratura não vertebral são incertos e, portanto, não é recomendado para essas indicações em mulheres menopausadas.
Demonstrou-se que injeções intravenosas de ibandronato são eficazes no aumento da densidade mineral óssea (DMO) no tratamento e na prevenção da osteoporose pós-menopausa.
Ácido zoledrônico:[132]Black DM, Reid IR, Boonen S, et al. The effect of 3 versus 6 years of zoledronic acid treatment of osteoporosis: a randomized extension to the HORIZON-Pivotal Fracture Trial (PFT). J Bone Miner Res. 2012 Feb;27(2):243-54.
https://asbmr.onlinelibrary.wiley.com/doi/full/10.1002/jbmr.1494
http://www.ncbi.nlm.nih.gov/pubmed/22161728?tool=bestpractice.com
[133]Black DM, Reid IR, Cauley JA, et al. The effect of 6 versus 9 years of zoledronic acid treatment in osteoporosis: a randomized second extension to the HORIZON-Pivotal Fracture Trial (PFT). J Bone Miner Res. 2015 May;30(5):934-44.
https://onlinelibrary.wiley.com/doi/full/10.1002/jbmr.2442
http://www.ncbi.nlm.nih.gov/pubmed/25545380?tool=bestpractice.com
[134]Black DM, Delmas PD, Eastell R, et al. Once-yearly zoledronic acid for treatment of postmenopausal osteoporosis. N Engl J Med. 2007 May 3;356(18):1809-22.
https://www.nejm.org/doi/10.1056/NEJMoa067312
http://www.ncbi.nlm.nih.gov/pubmed/17476007?tool=bestpractice.com
[135]Nancollas GH, Tang R, Phipps RJ, et al. Novel insights into actions of bisphosphonates on bone: differences in interactions with hydroxyapatite. Bone. 2006 May;38(5):617-27.
http://www.ncbi.nlm.nih.gov/pubmed/16046206?tool=bestpractice.com
[136]MacLean C, Newberry S, Maglione M, et al. Systematic review: comparative effectiveness of treatments to prevent fractures in men and women with low bone density or osteoporosis. Ann Intern Med. 2008 Feb 5;148(3):197-213.
http://annals.org/article.aspx?articleid=739219
http://www.ncbi.nlm.nih.gov/pubmed/18087050?tool=bestpractice.com
[137]Sharma A, Einstein AJ, Vallakati A, et al. Risk of atrial fibrillation with use of oral and intravenous bisphosphonates. Am J Cardiol. 2014 Jun 1;113(11):1815-21.
http://www.ncbi.nlm.nih.gov/pubmed/24837258?tool=bestpractice.com
[138]Pazianas M, Compston J, Huang CL. Atrial fibrillation and bisphosphonate therapy. J Bone Miner Res. 2010 Jan;25(1):2-10.
https://onlinelibrary.wiley.com/doi/full/10.1359/jbmr.091201
http://www.ncbi.nlm.nih.gov/pubmed/20091928?tool=bestpractice.com
[139]Reid IR, Horne AM, Mihov B, et al. Duration of fracture prevention after zoledronate treatment in women with osteopenia: observational follow-up of a 6-year randomised controlled trial to 10 years. Lancet Diabetes Endocrinol. 2024 Apr;12(4):247-56.
http://www.ncbi.nlm.nih.gov/pubmed/38452783?tool=bestpractice.com
[140]Liu S, Tan Y, Huang W, et al. Cardiovascular safety of zoledronic acid in the treatment of primary osteoporosis: a meta-analysis and systematic review. Semin Arthritis Rheum. 2024 Feb;64:152304.
http://www.ncbi.nlm.nih.gov/pubmed/37984227?tool=bestpractice.com
Um estudo demonstrou que 6 anos de tratamento com ácido zoledrônico manteve a DMO, reduziu a fratura vertebral e os marcadores de renovação óssea, em comparação com 3 anos de tratamento em pacientes com osteoporose. Em um estudo de extensão, aqueles que foram tratados com ácido zoledrônico por 6 anos foram randomizados para continuar com o ácido zoledrônico por mais 3 anos ou trocar para placebo. O estudo de extensão não encontrou redução significativa no número de fraturas entre os dois grupos. Em um acompanhamento observacional de mulheres idosas com osteopenia randomizadas para receber ácido zoledrônico ou placebo em intervalos de 18 meses por 6 anos, a redução das taxas de fraturas se manteve por 1.5 a 3.5 anos após a última infusão de ácido zoledrônico, mas, depois disso, as taxas foram semelhantes às do grupo placebo.
O ácido zoledrônico exerce um efeito mais rápido na prevenção de fraturas vertebrais e um efeito de início lento na prevenção de fraturas do quadril.
Resultados controversos foram relatados sobre o risco de fibrilação atrial grave em mulheres tratadas com ácido zoledrônico. Revisões sistemáticas de ECRCs e estudos observacionais demonstraram aumento significativo do risco de novo episódio de fibrilação atrial com bifosfonatos tanto intravenosos quanto orais. No entanto, os estudos não mostram evidências de aumento de comorbidades, como acidente vascular cerebral (AVC) ou morte. Em geral, a relação risco-benefício compensa tais complicações nessa população.
Denosumabe
O denosumabe é um anticorpo monoclonal totalmente humano contra o receptor ativador de fator nuclear kappa-B-ligante (RANKL), uma citocina que está envolvida na mediação da atividade osteoclástica.
É aprovado para o tratamento de:
Mulheres menopausadas com osteoporose e com alto risco de fratura
Profilaxia da osteoporose em mulheres com alto risco de fratura após receber terapia adjuvante com inibidor da aromatase para câncer de mama.
O denosumabe pode também ser usado em mulheres com risco muito alto de fratura (por exemplo, T-score muito baixo e história de fraturas vertebrais graves ou múltiplas, fratura recente ou vários fatores de risco para fratura), mas as diretrizes recomendam o tratamento inicial com um agente anabólico como opção preferida para esses pacientes.[67]Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, et al. Pharmacologic treatment of primary osteoporosis or low bone mass to prevent fractures in adults: a living clinical guideline from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://www.acpjournals.org/doi/full/10.7326/M22-1034
http://www.ncbi.nlm.nih.gov/pubmed/36592456?tool=bestpractice.com
[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
[81]Royal Australian College of General Practitioners. Osteoporosis management and fracture prevention in post-menopausal women and men >50 years of age. Mar 2024 [internet publication].
https://www.racgp.org.au/clinical-resources/clinical-guidelines/key-racgp-guidelines/view-all-racgp-guidelines/osteoporosis/executive-summary
[113]Shoback D, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society guideline update. J Clin Endocrinol Metab. 2020 Mar 1;105(3):dgaa048.
https://academic.oup.com/jcem/article/105/3/587/5739968
http://www.ncbi.nlm.nih.gov/pubmed/32068863?tool=bestpractice.com
[114]Tai TW, Chen HY, Shih CA, et al. Asia-Pacific consensus on long-term and sequential therapy for osteoporosis. Osteoporos Sarcopenia. 2024 Mar;10(1):3-10.
https://pmc.ncbi.nlm.nih.gov/articles/PMC11056428
http://www.ncbi.nlm.nih.gov/pubmed/38690538?tool=bestpractice.com
O denosumabe deve ser utilizado com precaução em pacientes com hipocalcemia preexistente ou com alto risco de hipocalcemia (deficientes em vitamina D) e em pacientes com doença renal grave, incluindo a doença renal em estágio terminal.[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
[108]Eastell R, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society* clinical practice guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1595-622.
https://www.endocrine.org/clinical-practice-guidelines/osteoporosis-in-postmenopausal-women
http://www.ncbi.nlm.nih.gov/pubmed/30907953?tool=bestpractice.com
A Food and Drug Administration (FDA) dos EUA advertiu quanto ao aumento do risco de hipocalcemia grave em pacientes com doença renal crônica avançada que recebem denosumabe.[141]Food and Drug Administration. FDA adds boxed warning for increased risk of severe hypocalcemia in patients with advanced chronic kidney disease taking osteoporosis medicine Prolia (denosumab). Jan 2025 [internet publication].
https://www.fda.gov/drugs/drug-safety-and-availability/fda-adds-boxed-warning-increased-risk-severe-hypocalcemia-patients-advanced-chronic-kidney-disease
Dois estudos de segurança demonstraram um aumento significativo no risco de hipocalcemia grave em pacientes tratados com denosumabe em comparação com aqueles tratados com bifosfonatos, com o risco mais elevado relatado em pacientes com doença renal avançada, particularmente aqueles em diálise.[141]Food and Drug Administration. FDA adds boxed warning for increased risk of severe hypocalcemia in patients with advanced chronic kidney disease taking osteoporosis medicine Prolia (denosumab). Jan 2025 [internet publication].
https://www.fda.gov/drugs/drug-safety-and-availability/fda-adds-boxed-warning-increased-risk-severe-hypocalcemia-patients-advanced-chronic-kidney-disease
[142]Bird ST, Smith ER, Gelperin K, et al. Severe hypocalcemia with denosumab among older female dialysis-dependent patients. JAMA. 2024 Feb 13;331(6):491-9.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10799290
http://www.ncbi.nlm.nih.gov/pubmed/38241060?tool=bestpractice.com
A hipocalcemia grave foi mais comum naqueles com distúrbios minerais e ósseos. Os pacientes com doença renal crônica avançada que tomam denosumabe correm o risco de desfechos graves devidos a hipocalcemia grave, incluindo hospitalização e morte. Antes de prescrever denosumabe, os profissionais da saúde devem avaliar a função renal e os níveis de cálcio, e considerar outras opções de tratamento para pacientes em risco. Durante o tratamento, o monitoramento frequente e o tratamento imediato da hipocalcemia são essenciais.
O American College of Obstetrics and Gynecology recomenda:[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
Denosumabe como terapia inicial para pacientes menopausadas com aumento do risco de fratura que preferem a administração subcutânea a cada 6 meses
Pacientes que descontinuam a terapia com denosumabe devem passar para o tratamento com outro agente antirreabsorção.
The Endocrine Society recomenda:[108]Eastell R, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society* clinical practice guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1595-622.
https://www.endocrine.org/clinical-practice-guidelines/osteoporosis-in-postmenopausal-women
http://www.ncbi.nlm.nih.gov/pubmed/30907953?tool=bestpractice.com
O denosumabe como tratamento inicial alternativo em mulheres menopausadas com osteoporose que apresentam alto risco de fraturas osteoporóticas.
Os efeitos do denosumabe na remodelação óssea, refletidos nos marcadores de renovação óssea, revertem após 6 meses se o medicamento não for tomado como recomendado. Portanto, uma paragem temporária do medicamento ou interrupção do tratamento não é recomendada com este agente.
Em mulheres menopausadas com osteoporose em uso de denosumabe, a administração não deve ser protelada ou interrompida sem terapia antirreabsorção subsequente (por exemplo, bifosfonato, terapia hormonal ou MSRE) ou outra terapia administrada para evitar um efeito rebote na renovação óssea e diminuir o risco de perda rápida de DMO e um aumento do risco de fratura.
O risco de fratura deve ser reavaliado após 5 a 10 anos de tratamento e as mulheres com alto risco de fratura devem continuar o tratamento com denosumabe ou ser tratadas com outro tratamento osteoporótico.
O American College of Physicians recomenda denosumabe como tratamento de segunda linha para reduzir o risco de fratura em mulheres menopausadas com osteoporose primária que apresentam contraindicações ou efeitos adversos com bifosfonatos.[67]Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, et al. Pharmacologic treatment of primary osteoporosis or low bone mass to prevent fractures in adults: a living clinical guideline from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://www.acpjournals.org/doi/full/10.7326/M22-1034
http://www.ncbi.nlm.nih.gov/pubmed/36592456?tool=bestpractice.com
O ensaio clínico FREEDOM demonstrou que denosumabe administrado por 36 meses está associado a redução no risco de fraturas vertebrais, não vertebrais e do quadril em mulheres com osteoporose que apresentaram um T-score de DMO de -2.5 mas não inferior a -4.0 na coluna lombar ou em todo o quadril, em comparação com o placebo.[143]Cummings SR, San Martin J, McClung MR, et al; FREEDOM Trial. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med. 2009 Aug 20;361(8):756-65.
http://www.nejm.org/doi/full/10.1056/NEJMoa0809493#t=article
http://www.ncbi.nlm.nih.gov/pubmed/19671655?tool=bestpractice.com
Estudos de extensão do ensaio clínico FREEDOM relataram que:[144]Papapoulos S, Lippuner K, Roux C, et al. The effect of 8 or 5 years of denosumab treatment in postmenopausal women with osteoporosis: results from the FREEDOM Extension study. Osteoporos Int. 2015 Dec;26(12):2773-83.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4656716
http://www.ncbi.nlm.nih.gov/pubmed/26202488?tool=bestpractice.com
[145]Bone HG, Wagman RB, Brandi ML, et al. 10 years of denosumab treatment in postmenopausal women with osteoporosis: results from the phase 3 randomised FREEDOM trial and open-label extension. Lancet Diabetes Endocrinol. 2017 Jul;5(7):513-23.
http://www.ncbi.nlm.nih.gov/pubmed/28546097?tool=bestpractice.com
[146]Cummings SR, Ferrari S, Eastell R, et al. Vertebral fractures after discontinuation of denosumab: a post hoc analysis of the randomized placebo-controlled FREEDOM trial and its extension. J Bone Miner Res. 2018 Feb;33(2):190-8.
https://asbmr.onlinelibrary.wiley.com/doi/10.1002/jbmr.3337
http://www.ncbi.nlm.nih.gov/pubmed/29105841?tool=bestpractice.com
O tratamento de osteoporose pós-menopausa com denosumabe por até 8 anos está associado a redução persistente de renovação óssea, aumento contínuo da DMO, baixa incidência de fraturas e alto perfil de risco-benefício
O tratamento com denosumabe por até 10 anos foi associado a taxas inferiores de eventos adversos, baixa incidência de fratura em comparação com aquela observada durante o ensaio clínico original e aumentos contínuos na DMO sem platô
A descontinuação de denosumabe é seguida por uma elevação rápida dos marcadores de renovação, redução da densidade óssea e aumento do risco de fratura vertebral, o que sugere que os pacientes que descontinuam denosumabe devem fazer uma transição rápida para um tratamento antirreabsorção alternativo.
Há evidências que sugerem que o ácido zoledrônico administrado após denosumabe é mais eficaz 7-8 meses após a descontinuação de denosumabe, e que teriparatida administrada antes ou em conjunto com denosumabe aumenta a DMO.[147]Horne AM, Mihov B, Reid IR. Bone loss after romosozumab/denosumab: effects of bisphosphonates. Calcif Tissue Int. 2018 Jul;103(1):55-61.
http://www.ncbi.nlm.nih.gov/pubmed/29445836?tool=bestpractice.com
[148]Leder BZ, Tsai JN, Uihlein AV, et al. Denosumab and teriparatide transitions in postmenopausal osteoporosis (the DATA-Switch study): extension of a randomised controlled trial. Lancet. 2015 Sep 19;386(9999):1147-55.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4620731
http://www.ncbi.nlm.nih.gov/pubmed/26144908?tool=bestpractice.com
[149]Liu Y, Xu Y, Zhang X, et al. Evaluating the clinical efficacy of teriparatide and denosumab combination therapy in postmenopausal osteoporosis: a systematic review and meta-analysis. Altern Ther Health Med. 2024 Jun;30(6):270-5.
https://alternative-therapies.com/oa/index.html
http://www.ncbi.nlm.nih.gov/pubmed/37944971?tool=bestpractice.com
No entanto, são necessárias pesquisas adicionais.[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
Foi relatado que denosumabe é significativamente mais eficaz para aumentar a DMO em mulheres menopausadas tratadas previamente com bifosfonatos, e demonstrou melhora significativa da DMO na coluna lombar, quadril total e colo do fêmur em 12 e 24 meses em pacientes com baixa DMO ou osteoporose, em comparação com os bifosfonatos.[150]Zhu Y, Huang Z, Wang Y, et al. The efficacy and safety of denosumab in postmenopausal women with osteoporosis previously treated with bisphosphonates: a review. J Orthop Translat. 2020 May;22:7-13.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7231967
http://www.ncbi.nlm.nih.gov/pubmed/32440494?tool=bestpractice.com
[151]Lyu H, Jundi B, Xu C, et al. Comparison of denosumab and bisphosphonates in patients with osteoporosis: a meta-analysis of randomized controlled trials. J Clin Endocrinol Metab. 2019 May 1;104(5):1753-65.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6447951
http://www.ncbi.nlm.nih.gov/pubmed/30535289?tool=bestpractice.com
Em pacientes com 50 anos ou mais com osteoporose, o denosumabe comprovou ser tão eficaz quanto o ácido zoledrônico para reduzir o risco de fraturas.[152]Li W, Ning Z, Yang Z, et al. Safety of denosumab versus zoledronic acid in the older adults with osteoporosis: a meta-analysis of cohort studies. Arch Osteoporos. 2022 Jun 17;17(1):84.
http://www.ncbi.nlm.nih.gov/pubmed/35715524?tool=bestpractice.com
Foi relatado aumento do risco de infecção grave em pacientes tratados com denosumabe, em comparação com placebo.[153]Diker-Cohen T, Rosenberg D, Avni T, et al. Risk for infections during treatment with denosumab for osteoporosis: a systematic review and meta-analysis. J Clin Endocrinol Metab. 2020 May 1;105(5):dgz322.
https://academic.oup.com/jcem/article/105/5/1641/5695688
http://www.ncbi.nlm.nih.gov/pubmed/31899506?tool=bestpractice.com
[154]Catton B, Surangiwala S, Towheed T. Is denosumab associated with an increased risk for infection in patients with low bone mineral density? A systematic review and meta-analysis of randomized controlled trials. Int J Rheum Dis. 2021 Jul;24(7):869-79.
http://www.ncbi.nlm.nih.gov/pubmed/33793076?tool=bestpractice.com
No entanto, o risco geral de infecção é comparável com outros tratamentos para osteoporose, inclusive bifosfonatos.[153]Diker-Cohen T, Rosenberg D, Avni T, et al. Risk for infections during treatment with denosumab for osteoporosis: a systematic review and meta-analysis. J Clin Endocrinol Metab. 2020 May 1;105(5):dgz322.
https://academic.oup.com/jcem/article/105/5/1641/5695688
http://www.ncbi.nlm.nih.gov/pubmed/31899506?tool=bestpractice.com
[154]Catton B, Surangiwala S, Towheed T. Is denosumab associated with an increased risk for infection in patients with low bone mineral density? A systematic review and meta-analysis of randomized controlled trials. Int J Rheum Dis. 2021 Jul;24(7):869-79.
http://www.ncbi.nlm.nih.gov/pubmed/33793076?tool=bestpractice.com
O denosumabe foi associado a osteonecrose da mandíbula, deficit de cicatrização de fraturas e fraturas atípicas de fêmur.[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
[67]Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, et al. Pharmacologic treatment of primary osteoporosis or low bone mass to prevent fractures in adults: a living clinical guideline from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://www.acpjournals.org/doi/full/10.7326/M22-1034
http://www.ncbi.nlm.nih.gov/pubmed/36592456?tool=bestpractice.com
Denosumabe não está associado ao aumento do risco de desfechos cardiovasculares, em comparação com placebo ou comparadores ativos.[152]Li W, Ning Z, Yang Z, et al. Safety of denosumab versus zoledronic acid in the older adults with osteoporosis: a meta-analysis of cohort studies. Arch Osteoporos. 2022 Jun 17;17(1):84.
http://www.ncbi.nlm.nih.gov/pubmed/35715524?tool=bestpractice.com
[155]Lv F, Cai X, Yang W, et al. Denosumab or romosozumab therapy and risk of cardiovascular events in patients with primary osteoporosis: systematic review and meta-analysis. Bone. 2020 Jan;130:115121.
http://www.ncbi.nlm.nih.gov/pubmed/31678488?tool=bestpractice.com
Agentes anabólicos
Os agentes anabólicos incluem teriparatida, abaloparatida e romosozumabe.
A teriparatida e a abaloparatida são análogos do paratormônio aprovados para tratar a osteoporose em mulheres menopausadas. A teriparatida é uma forma recombinante do paratormônio, enquanto a abaloparatida é um análogo do peptídeo relacionado ao paratormônio humano.
Romosozumabe, um anticorpo monoclonal inibidor da esclerostina que reduz a absorção óssea, está aprovado para o tratamento de osteoporose em mulheres menopausadas que apresentam alto risco de fraturas (definido como história de fratura osteoporótica ou múltiplos fatores de risco para fraturas) ou pacientes que não tiveram êxito ou são intolerantes a outros tratamentos disponíveis para osteoporose.
As diretrizes recomendam o tratamento inicial com um agente anabólico para mulheres menopausadas com risco muito alto de fratura, como aquelas com um T-score muito baixo e história de fraturas vertebrais graves ou múltiplas, fratura recente ou vários fatores de risco para fratura.[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
[67]Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, et al. Pharmacologic treatment of primary osteoporosis or low bone mass to prevent fractures in adults: a living clinical guideline from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://www.acpjournals.org/doi/full/10.7326/M22-1034
http://www.ncbi.nlm.nih.gov/pubmed/36592456?tool=bestpractice.com
[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
[81]Royal Australian College of General Practitioners. Osteoporosis management and fracture prevention in post-menopausal women and men >50 years of age. Mar 2024 [internet publication].
https://www.racgp.org.au/clinical-resources/clinical-guidelines/key-racgp-guidelines/view-all-racgp-guidelines/osteoporosis/executive-summary
[108]Eastell R, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society* clinical practice guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1595-622.
https://www.endocrine.org/clinical-practice-guidelines/osteoporosis-in-postmenopausal-women
http://www.ncbi.nlm.nih.gov/pubmed/30907953?tool=bestpractice.com
[113]Shoback D, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society guideline update. J Clin Endocrinol Metab. 2020 Mar 1;105(3):dgaa048.
https://academic.oup.com/jcem/article/105/3/587/5739968
http://www.ncbi.nlm.nih.gov/pubmed/32068863?tool=bestpractice.com
O American College of Obstetrics and Gynecology (ACOG) recomenda que teriparatida, abaloparatida ou romosozumabe também pode ser usado para pacientes que continuam a sofrer fraturas ou têm perda óssea significativa durante a terapia atirreabsorção.[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
Uma metanálise constatou que a teriparatida e o romosozumabe foram mais eficazes que os bifosfonatos orais na redução do risco de fraturas clínicas e vertebrais, independentemente dos indicadores basais de risco de fratura (história de fraturas anteriores, idade, T-score da coluna vertebral, índice de massa corporal [IMC], pontuação da ferramenta de avaliação de risco de fratura [FRAX] para fraturas osteoporóticas graves).[156]Händel MN, Cardoso I, von Bülow C, et al. Fracture risk reduction and safety by osteoporosis treatment compared with placebo or active comparator in postmenopausal women: systematic review, network meta-analysis, and meta-regression analysis of randomised clinical trials. BMJ. 2023 May 2;381:e068033.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10152340
http://www.ncbi.nlm.nih.gov/pubmed/37130601?tool=bestpractice.com
No entanto, as diretrizes sugerem que o tratamento inicial com um agente anabólico pode ser mais benéfico para pacientes com risco muito alto de fraturas na prática, em parte porque os agentes anabólicos requerem administração subcutânea.[81]Royal Australian College of General Practitioners. Osteoporosis management and fracture prevention in post-menopausal women and men >50 years of age. Mar 2024 [internet publication].
https://www.racgp.org.au/clinical-resources/clinical-guidelines/key-racgp-guidelines/view-all-racgp-guidelines/osteoporosis/executive-summary
[157]van den Bergh JP, Geusens P, Appelman-Dijkstra NM, et al. The Dutch multidisciplinary guideline osteoporosis and fracture prevention, taking a local guideline to the international arena. Arch Osteoporos. 2024 Apr 2;19(1):23.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10987374
http://www.ncbi.nlm.nih.gov/pubmed/38564062?tool=bestpractice.com
Agentes anabólicos não são normalmente usados como terapia inicial em pacientes com alto risco de fraturas.
As diretrizes do American College of Physicians (ACP) recomendam teriparatida ou romosozumabe apenas para mulheres com osteoporose primária e risco muito alto de fratura; eles concluíram que as evidências a favor e contra o tratamento com abaloparatida eram inconclusivas.[67]Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, et al. Pharmacologic treatment of primary osteoporosis or low bone mass to prevent fractures in adults: a living clinical guideline from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://www.acpjournals.org/doi/full/10.7326/M22-1034
http://www.ncbi.nlm.nih.gov/pubmed/36592456?tool=bestpractice.com
O ACP sugere que as mulheres menopausadas com fraturas vertebrais prevalentes se beneficiam mais do tratamento com teriparatida do que aquelas sem fraturas prevalentes.[67]Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, et al. Pharmacologic treatment of primary osteoporosis or low bone mass to prevent fractures in adults: a living clinical guideline from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://www.acpjournals.org/doi/full/10.7326/M22-1034
http://www.ncbi.nlm.nih.gov/pubmed/36592456?tool=bestpractice.com
As diretrizes do Royal Australian College of General Practitioners recomendam romosozumabe como opção de primeira linha preferida para pacientes com risco muito alto de fratura, com base em evidências de que pode aumentar a DMO de maneira mais eficaz do que o ácido alendrônico ou teriparatida.[81]Royal Australian College of General Practitioners. Osteoporosis management and fracture prevention in post-menopausal women and men >50 years of age. Mar 2024 [internet publication].
https://www.racgp.org.au/clinical-resources/clinical-guidelines/key-racgp-guidelines/view-all-racgp-guidelines/osteoporosis/executive-summary
Romosozumabe:[67]Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, et al. Pharmacologic treatment of primary osteoporosis or low bone mass to prevent fractures in adults: a living clinical guideline from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://www.acpjournals.org/doi/full/10.7326/M22-1034
http://www.ncbi.nlm.nih.gov/pubmed/36592456?tool=bestpractice.com
[81]Royal Australian College of General Practitioners. Osteoporosis management and fracture prevention in post-menopausal women and men >50 years of age. Mar 2024 [internet publication].
https://www.racgp.org.au/clinical-resources/clinical-guidelines/key-racgp-guidelines/view-all-racgp-guidelines/osteoporosis/executive-summary
[108]Eastell R, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society* clinical practice guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1595-622.
https://www.endocrine.org/clinical-practice-guidelines/osteoporosis-in-postmenopausal-women
http://www.ncbi.nlm.nih.gov/pubmed/30907953?tool=bestpractice.com
[113]Shoback D, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society guideline update. J Clin Endocrinol Metab. 2020 Mar 1;105(3):dgaa048.
https://academic.oup.com/jcem/article/105/3/587/5739968
http://www.ncbi.nlm.nih.gov/pubmed/32068863?tool=bestpractice.com
[158]Cosman F, Crittenden DB, Adachi JD, et al. Romosozumab treatment in postmenopausal women with osteoporosis. N Engl J Med. 2016 Oct 20;375(16):1532-43.
https://www.nejm.org/doi/10.1056/NEJMoa1607948
http://www.ncbi.nlm.nih.gov/pubmed/27641143?tool=bestpractice.com
[159]Saag KG, Petersen J, Brandi ML, et al. Romosozumab or alendronate for fracture prevention in women with osteoporosis. N Engl J Med. 2017 Oct 12;377(15):1417-27.
https://www.nejm.org/doi/10.1056/NEJMoa1708322
http://www.ncbi.nlm.nih.gov/pubmed/28892457?tool=bestpractice.com
[160]Liu Y, Cao Y, Zhang S, et al. Romosozumab treatment in postmenopausal women with osteoporosis: a meta-analysis of randomized controlled trials. Climacteric. 2018 Apr;21(2):189-95.
http://www.ncbi.nlm.nih.gov/pubmed/29424257?tool=bestpractice.com
[161]Prather C, Adams E, Zentgraf W. Romosozumab: a first-in-class sclerostin inhibitor for osteoporosis. Am J Health Syst Pharm. 2020 Nov 16;77(23):1949-56.
http://www.ncbi.nlm.nih.gov/pubmed/32880646?tool=bestpractice.com
[162]Kaveh S, Hosseinifard H, Ghadimi N, et al. Efficacy and safety of romosozumab in treatment for low bone mineral density: a systematic review and meta-analysis. Clin Rheumatol. 2020 Nov;39(11):3261-76.
http://www.ncbi.nlm.nih.gov/pubmed/32385757?tool=bestpractice.com
[163]Lim SY. Romosozumab for the treatment of osteoporosis in women: efficacy, safety, and cardiovascular risk. Womens Health (Lond). 2022 Jan-Dec;18:17455057221125577.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9511529
http://www.ncbi.nlm.nih.gov/pubmed/36154750?tool=bestpractice.com
[164]Bovijn J, Krebs K, Chen CY, et al. Evaluating the cardiovascular safety of sclerostin inhibition using evidence from meta-analysis of clinical trials and human genetics. Sci Transl Med. 2020 Jun 24;12(549):eaay6570.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7116615
http://www.ncbi.nlm.nih.gov/pubmed/32581134?tool=bestpractice.com
[165]Mariscal G, Nuñez JH, Bhatia S, et al. Safety of romosozumab in osteoporotic men and postmenopausal women: a meta-analysis and systematic review. Monoclon Antib Immunodiagn Immunother. 2020 Apr;39(2):29-36.
http://www.ncbi.nlm.nih.gov/pubmed/32195618?tool=bestpractice.com
[166]Nealy KL, Harris KB. Romosozumab: a novel injectable sclerostin inhibitor with anabolic and antiresorptive effects for osteoporosis. Ann Pharmacother. 2021 May;55(5):677-86.
http://www.ncbi.nlm.nih.gov/pubmed/32862655?tool=bestpractice.com
O romosozumabe é recomendado para o tratamento da osteoporose pós-menopausa por até 1 ano. O romosozumabe deve ser evitado em pacientes com alto risco de doença cardiovascular ou AVC.
O tratamento com romosozumabe deve ser seguido por terapia sequencial com um agente antirreabsorção para manter os ganhos de DMO e reduzir o risco de fratura.
Romosozumabe demonstrou reduções significativas em novas fraturas vertebrais, novas fraturas não vertebrais e fratura do quadril, em comparação com outras terapias para osteoporose, e aumento da DMO na coluna lombar, quadril total e colo do fêmur, em comparação com placebo em mulheres menopausadas e outros pacientes com osteoporose e DMO baixa.
Uma revisão sistemática subsequente relatou que romosozumabe aumentou a DMO na coluna lombar e quadril total, em comparação com teriparatida em 12 meses em pacientes com osteoporose. Em mulheres menopausadas com risco elevado de fratura, 1 ano de romosozumabe seguido por 1 ano de ácido alendrônico reduziu o risco de fratura vertebral, não vertebral, clínica e do quadril, em comparação com o ácido alendrônico isolado em 24 meses. Eventos cardiovasculares e cerebrovasculares foram maiores no grupo de romosozumabe, em comparação com ácido alendrônico.
Algumas evidências sugerem que romosozumabe pode ter uma taxa mais baixa de efeitos adversos, em comparação com o ácido alendrônico, e um perfil de segurança similar aos bifosfonatos; no entanto, a maioria dos estudos concorda que são necessárias pesquisas adicionais para estabelecer o risco de doença cardiovascular com o tratamento com romosozumabe.
Teriparatida e abaloparatida:[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
[108]Eastell R, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society* clinical practice guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1595-622.
https://www.endocrine.org/clinical-practice-guidelines/osteoporosis-in-postmenopausal-women
http://www.ncbi.nlm.nih.gov/pubmed/30907953?tool=bestpractice.com
[167]Neer RM, Arnaud CD, Zanchetta JR, et al. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med. 2001 May 10;344(19):1434-41.
http://www.nejm.org/doi/full/10.1056/NEJM200105103441904
http://www.ncbi.nlm.nih.gov/pubmed/11346808?tool=bestpractice.com
[168]Yang C, Le G, Lu C, et al. Effects of teriparatide compared with risedronate in the treatment of osteoporosis: a meta-analysis of randomized controlled trials. Medicine (Baltimore). 2020 Feb;99(7):e19042.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7035098
http://www.ncbi.nlm.nih.gov/pubmed/32049802?tool=bestpractice.com
[169]Shen J, Ke Z, Dong S, et al. Pharmacological therapies for osteoporosis: a Bayesian network meta-analysis. Med Sci Monit. 2022 Apr 17;28:e935491.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9022483
http://www.ncbi.nlm.nih.gov/pubmed/35430576?tool=bestpractice.com
[170]Tian A, Jia H, Zhu S, et al. Romosozumab versus teriparatide for the treatment of postmenopausal osteoporosis: a systematic review and meta-analysis through a grade analysis of evidence. Orthop Surg. 2021 Oct;13(7):1941-50.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8528978
http://www.ncbi.nlm.nih.gov/pubmed/34643048?tool=bestpractice.com
[171]Poutoglidou F, Samoladas E, Raikos N, et al. Efficacy and safety of anti-sclerostin antibodies in the treatment of osteoporosis: a meta-analysis and systematic review. J Clin Densitom. 2022 Jul-Sep;25(3):401-15.
http://www.ncbi.nlm.nih.gov/pubmed/34920938?tool=bestpractice.com
[172]Miller PD, Hattersley G, Riis BJ, et al. Effect of abaloparatide vs placebo on new vertebral fractures in postmenopausal women with osteoporosis: a randomized clinical trial. JAMA. 2016 Aug 16;316(7):722-33.
http://www.ncbi.nlm.nih.gov/pubmed/27533157?tool=bestpractice.com
[173]Cosman F, Miller PD, Williams GC, et al. Eighteen months of treatment with subcutaneous abaloparatide followed by 6 months of treatment with alendronate in postmenopausal women with osteoporosis: results of the ACTIVExtend trial. Mayo Clin Proc. 2017 Feb;92(2):200-10.
https://www.mayoclinicproceedings.org/article/S0025-6196(16)30630-9/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/28160873?tool=bestpractice.com
[174]Bone HG, Cosman F, Miller PD, et al. ACTIVExtend: 24 months of alendronate after 18 months of abaloparatide or placebo for postmenopausal osteoporosis. J Clin Endocrinol Metab. 2018 Aug 1;103(8):2949-57.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6097601
http://www.ncbi.nlm.nih.gov/pubmed/29800372?tool=bestpractice.com
[175]Miller PD, Bilezikian JP, Fitzpatrick LA, et al. Abaloparatide: an anabolic treatment to reduce fracture risk in postmenopausal women with osteoporosis. Curr Med Res Opin. 2020 Nov;36(11):1861-72.
https://www.tandfonline.com/doi/full/10.1080/03007995.2020.1824897
http://www.ncbi.nlm.nih.gov/pubmed/32969719?tool=bestpractice.com
[176]Reginster J-Y, Bianic F, Campbell R, et al. Abaloparatide for risk reduction of nonvertebral and vertebral fractures in postmenopausal women with osteoporosis: a network meta-analysis. Osteoporos Int. 2019 Jul;30(7):1465-73.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6614166
http://www.ncbi.nlm.nih.gov/pubmed/30953114?tool=bestpractice.com
As diretrizes recomendam o tratamento com teriparatida ou abaloparatida por até 2 anos. O tratamento com teriparatida por mais de 2 anos poderá ser considerado se o paciente continuar ou voltar a apresentar alto risco de fratura.
A Bone Health and Osteoporosis Foundation (BHOF) sugere que a teriparatida e a abaloparatida devem ser evitadas em pacientes com aumento do risco de osteossarcoma (doença de Paget dos ossos, radioterapia prévia envolvendo o esqueleto, história de metástases ósseas ou neoplasias malignas, fosfatase alcalina inexplicavelmente elevada e doenças hereditárias que predispõem ao osteossarcoma).
Quando o tratamento é interrompido, a perda óssea pode ser rápida e agentes alternativos devem ser considerados para manter a DMO. A BHOF e a The Endocrine Society recomendam que o tratamento com teriparatida ou abaloparatida seja seguido com um agente antirreabsorção, geralmente um bifosfonato, para manter ou aumentar ainda mais a DMO.
Ensaios clínicos demonstraram que a teriparatida aumenta a DMO, em comparação com placebo. As evidências de eficácia da teriparatida em comparação com outros tratamentos para osteoporose variam. Uma revisão sistemática demonstrou que a teriparatida melhora a DMO da coluna lombar, colo do fêmur e quadril total e reduz a incidência de fratura clínica, novas fraturas vertebrais e fraturas não vertebrais, em comparação com risedronato. Por outro lado, uma metanálise em rede sugere que a teriparatida é menos eficaz, em comparação com outros medicamentos como bifosfonatos, denosumabe ou romosozumabe para reduzir o risco de fraturas em pacientes com osteoporose. Duas revisões sistemáticas adicionais demonstraram que a teriparatida foi menos eficaz que romosozumabe para melhorar a DMO da coluna lombar, quadril total e colo do fêmur para pacientes com osteoporose pós-menopausa em 6 e 12 meses.
O ensaio clínico controlado, duplo cego, de fase 3 ACTIVE e ensaios de extensão subsequentes demonstraram que abaloparatida reduziu o risco de novas fraturas vertebrais e não vertebrais em 18 meses, em comparação com placebo, e que o uso sequencial de ácido alendrônico por 6 ou 24 meses após o tratamento com abaloparatida reduziu o risco de fraturas vertebrais, não vertebrais, clínicas e osteoporóticas maiores e aumentou a DMO, em comparação com placebo em mulheres menopausadas.
Os resultados de uma metanálise em rede indicam que abaloparatida reduz o risco de fratura vertebral, fratura não vertebral e fratura de punho, em comparação com outros tratamentos para osteoporose como teriparatida, romosozumabe ou ibandronato em pacientes com osteoporose, inclusive em mulheres menopausadas.
Os efeitos adversos do teriparatida incluem cãibras nos membros inferiores, náuseas e tontura e, para o abaloparatida, incluem náuseas, hipotensão postural, tontura, cefaleia e palpitações.
MSREs
Os MSREs incluem raloxifeno e bazedoxifeno.
O raloxifeno é aprovado para o tratamento e a prevenção da osteoporose em mulheres menopausadas. Ele aumenta a DMO na coluna vertebral, mas em grau mais baixo que o bifosfonato, e só é eficaz para reduzir a fratura vertebral.[125]Black DM, Schwartz AV, Ensrud KE, et al. Effects of continuing or stopping alendronate after 5 years of treatment: the Fracture Intervention Trial Long-term Extension (FLEX): a randomized trial. JAMA. 2006 Dec 27;296(24):2927-38.
http://jama.jamanetwork.com/article.aspx?articleid=204789
http://www.ncbi.nlm.nih.gov/pubmed/17190893?tool=bestpractice.com
Raloxifeno reduz o risco de fraturas vertebrais em mulheres menopausadas com osteoporose.[177]Ettinger B, Black DM, Mitlak BH, et al. Reduction of vertebral fracture risk in postmenopausal women with osteoporosis treated with raloxifene: results from a 3-year randomized clinical trial. Multiple Outcomes of Raloxifene Evaluation (MORE) Investigators. JAMA. 1999 Aug 18;282(7):637-45.
https://jamanetwork.com/journals/jama/fullarticle/191242
http://www.ncbi.nlm.nih.gov/pubmed/10517716?tool=bestpractice.com
Não há nenhuma evidência para a redução de fraturas não vertebrais.
O uso de raloxifeno está associado ao aumento do risco de trombose venosa e AVC.[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
A possibilidade de efeitos adversos é ponderada contra os benefícios potenciais de redução do risco de fratura vertebral e do câncer da mama positivo para o receptor estrogênico.
O ACOG sugere raloxifeno para pacientes menopausadas com aumento do risco de fratura vertebral e câncer de mama, que apresentam baixo risco de tromboembolismo venoso e não têm sintomas vasomotores significativos.[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
A Endocrine Society recomenda raloxifeno ou bazedoxifeno para reduzir o risco de fratura vertebral em mulheres menopausadas com menos de 60 anos ou <10 anos após a menopausa, com osteoporose e alto risco de fratura e baixo risco de trombose venosa profunda, para quem bifosfonato ou denosumabe não são adequados, ou que apresentem alto risco de câncer de mama.[108]Eastell R, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society* clinical practice guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1595-622.
https://www.endocrine.org/clinical-practice-guidelines/osteoporosis-in-postmenopausal-women
http://www.ncbi.nlm.nih.gov/pubmed/30907953?tool=bestpractice.com
O ACP concluiu que não há evidências suficientes para recomendar ou não o tratamento com raloxifeno ou bazedoxifeno.[67]Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, et al. Pharmacologic treatment of primary osteoporosis or low bone mass to prevent fractures in adults: a living clinical guideline from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://www.acpjournals.org/doi/full/10.7326/M22-1034
http://www.ncbi.nlm.nih.gov/pubmed/36592456?tool=bestpractice.com
Uma revisão sistemática demonstrou que raloxifeno é eficaz para melhorar a DMO da coluna lombar em mulheres menopausadas com doença renal em estágio terminal, em comparação com placebo, com uma duração média do tratamento de 12 meses.[178]Ma HY, Chen S, Lu LL, et al. Raloxifene in the treatment of osteoporosis in postmenopausal women with end-stage renal disease: a systematic review and meta-analysis. Horm Metab Res. 2021 Nov;53(11):730-7.
https://www.thieme-connect.com/products/ejournals/html/10.1055/a-1655-4362
http://www.ncbi.nlm.nih.gov/pubmed/34740274?tool=bestpractice.com
Nenhum efeito adverso foi relatado no grupo de pacientes que receberam raloxifeno, mas são necessários ECRCs adicionais de grande porte para avaliar a segurança em longo prazo de raloxifeno nesses pacientes.[178]Ma HY, Chen S, Lu LL, et al. Raloxifene in the treatment of osteoporosis in postmenopausal women with end-stage renal disease: a systematic review and meta-analysis. Horm Metab Res. 2021 Nov;53(11):730-7.
https://www.thieme-connect.com/products/ejournals/html/10.1055/a-1655-4362
http://www.ncbi.nlm.nih.gov/pubmed/34740274?tool=bestpractice.com
O bazedoxifeno reduz o risco de hiperplasia endometrial (crescimento excessivo do revestimento interno do útero), que pode ocorrer com o tratamento com estrogênio.[179]Pinkerton JV, Thomas S, Dalkin AC. Osteoporosis treatment and prevention for postmenopausal women: current and future therapeutic options. Clin Obstet Gynecol. 2013 Dec;56(4):711-21.
http://www.ncbi.nlm.nih.gov/pubmed/24100598?tool=bestpractice.com
O bazedoxifeno só está disponível em uma formulação combinada com estrogênios conjugados nos EUA; no entanto, está disponível como formulação de ingrediente único em outros países. Estrogênios conjugados/bazedoxifeno são recomendados como terceira linha apenas após a consideração criteriosa de agentes alternativos que não contêm estrogênio (veja abaixo).[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
terapia hormonal
A queda de estrogênio na menopausa está fortemente associada à diminuição da DMO.[2]NIH Consensus Development Panel on Osteoporosis Prevention, Diagnosis, and Therapy. Osteoporosis prevention, diagnosis, and therapy. JAMA. 2001 Feb 14;285(6):785-95.
http://www.ncbi.nlm.nih.gov/pubmed/11176917?tool=bestpractice.com
[3]WHO Scientific Group on the Prevention and Management of Osteoporosis. Prevention and management of osteoporosis: report of a WHO scientific group. (WHO technical report series: 921.) Geneva, Switzerland: WHO; 2003.
https://apps.who.int/iris/handle/10665/42841
Há várias formas de terapia de reposição hormonal (TRH). O estrogênio, isoladamente ou em combinação com progesterona, é considerado apenas para mulheres com alto risco de fraturas osteoporóticas para quem a terapia não hormonal é inadequada.
A TRH reduz a incidência de fraturas. No entanto, há um aumento considerável no risco de doenças coronarianas, câncer de mama, trombose venosa e acidente vascular cerebral (AVC).[180]Santen RJ, Allred DC, Ardoin SP, et al. Postmenopausal hormone therapy: an Endocrine Society scientific statement. J Clin Endocrinol Metab. 2010 Jul;95(7 suppl 1):s1-66.
https://academic.oup.com/jcem/article/95/7_supplement_1/s1/2835479
http://www.ncbi.nlm.nih.gov/pubmed/20566620?tool=bestpractice.com
[181]Medicines and Healthcare products Regulatory Agency. Hormone replacement therapy (HRT): further information on the known increased risk of breast cancer with HRT and its persistence after stopping. Aug 2019 [internet publication].
https://www.gov.uk/drug-safety-update/hormone-replacement-therapy-hrt-further-information-on-the-known-increased-risk-of-breast-cancer-with-hrt-and-its-persistence-after-stopping
[182]Collaborative Group on Hormonal Factors in Breast Cancer. Type and timing of menopausal hormone therapy and breast cancer risk: individual participant meta-analysis of the worldwide epidemiological evidence. Lancet. 2019 Sep 28;394(10204):1159-68.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(19)31709-X/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/31474332?tool=bestpractice.com
O relatório do WHI avaliou a eficácia de estrogênios conjugados versus placebo em 10,739 mulheres menopausadas, com idade entre 50-79 anos, com histerectomia prévia.[183]Anderson GL, Limacher M, Assaf AR, et al. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy: the Women's Health Initiative randomized controlled trial. JAMA. 2004 Apr 14;291(14):1701-12.
http://www.ncbi.nlm.nih.gov/pubmed/15082697?tool=bestpractice.com
O desfecho primário foi doença coronariana. O estudo relatou que os estrogênios conjugados aumentaram o risco de AVC, reduziram o risco de fratura do quadril e não afetaram a incidência de doença coronariana nessa população em uma média de 6.8 anos.[183]Anderson GL, Limacher M, Assaf AR, et al. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy: the Women's Health Initiative randomized controlled trial. JAMA. 2004 Apr 14;291(14):1701-12.
http://www.ncbi.nlm.nih.gov/pubmed/15082697?tool=bestpractice.com
A Endocrine Society recomenda estrogênio como tratamento de primeira linha para prevenir todos os tipos de fraturas em mulheres (com menos de 60 anos de idade ou <10 anos após a menopausa) com histerectomia, alto risco de fratura osteoporótica e baixo risco de trombose venosa profunda, para quem bifosfonato ou denosumabe não é adequado, que apresentam sintomas vasomotores, que não apresentam contraindicações, infarto do miocárdio, AVC ou câncer de mama prévios e que estejam dispostas a fazer terapia hormonal para menopausa.[108]Eastell R, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society* clinical practice guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1595-622.
https://www.endocrine.org/clinical-practice-guidelines/osteoporosis-in-postmenopausal-women
http://www.ncbi.nlm.nih.gov/pubmed/30907953?tool=bestpractice.com
As mulheres que têm útero devem usar estrogênio somente em combinação com progesterona porque o uso isolado de estrogênio aumenta a incidência de câncer de endométrio.[184]Sjögren LL, Mørch LS, Løkkegaard E. Hormone replacement therapy and the risk of endometrial cancer: a systematic review. Maturitas. 2016 Sep;91:25-35.
http://www.ncbi.nlm.nih.gov/pubmed/27451318?tool=bestpractice.com
A Endocrine Society recomenda estrogênio associado a progestina ou tibolona (não disponível nos EUA) como tratamento de primeira linha para prevenir fraturas vertebrais e não vertebrais em mulheres com menos de 60 anos de idade (ou <10 anos após a menopausa) com alto risco de fratura osteoporótica e baixo risco de trombose venosa profunda, para quem bifosfonato ou denosumabe não é adequado, que apresentam sintomas vasomotores, que não apresentam contraindicações, infarto do miocárdio, AVC ou câncer de mama prévios e que estejam dispostas a fazer terapia para menopausa com tibolona.[108]Eastell R, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society* clinical practice guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1595-622.
https://www.endocrine.org/clinical-practice-guidelines/osteoporosis-in-postmenopausal-women
http://www.ncbi.nlm.nih.gov/pubmed/30907953?tool=bestpractice.com
A Endocrine Society também recomenda estrogênio associado a progestina ou tibolona como tratamento de segunda linha para prevenir fraturas vertebrais e não vertebrais em mulheres com mais de 60 anos para quem bifosfonatos, denosumabe e teriparatida/abaloparatida não são adequados.[108]Eastell R, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society* clinical practice guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1595-622.
https://www.endocrine.org/clinical-practice-guidelines/osteoporosis-in-postmenopausal-women
http://www.ncbi.nlm.nih.gov/pubmed/30907953?tool=bestpractice.com
O ACP não recomenda o uso de estrogênio isolado na menopausa, ou associado à terapia com progestina, para o tratamento de osteoporose em mulheres.[185]Qaseem A, Forciea MA, McLean RM, et al. Treatment of low bone density or osteoporosis to prevent fractures in men and women: a clinical practice guideline update from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10885682
http://www.ncbi.nlm.nih.gov/pubmed/28492856?tool=bestpractice.com
Estrogênios conjugados/bazedoxifeno
Estrogênios conjugados/bazedoxifeno são indicados para a profilaxia da osteoporose decorrente da menopausa em mulheres com útero intacto.[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
O bazedoxifeno isolado é indicado para o tratamento da osteoporose após a menopausa em mulheres com aumento do risco de fratura, mas não está disponível como formulação de ingrediente único nos EUA.
A NOF recomenda estrogênios conjugados/bazedoxifeno para a prevenção da osteoporose apenas em mulheres com risco considerável de fratura, e somente após a consideração cautelosa de tratamentos alternativos que não contenham estrogênio.[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
Esse tratamento deve ser usado apenas pelo período mais curto consistente com os objetivos do tratamento e com os riscos para a mulher em questão.[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
Os efeitos adversos incluem espasmo muscular, náuseas, diarreia, dispepsia, dor na parte superior do abdome, dor orofaríngea, tontura e dor cervical.[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
Homens
Homens com 50 anos ou mais que apresentam qualquer um dos seguintes sintomas devem ser considerados para o tratamento de osteoporose:[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
Fratura do quadril ou vertebral (clinicamente aparente ou encontrada no exame de imagem vertebral), independente do T-score
Fratura da pelve, úmero proximal ou antebraço distal em um indivíduo com baixa massa óssea ou osteopenia
T-score ≤-2.5 no colo do fêmur, quadril total, coluna lombar ou 33% do raio
Alto risco de fratura e necessidade de intervenção farmacológica, conforme indicado pelo T-score entre -1.0 e -2.5 no colo do fêmur ou quadril total e uma probabilidade de 10 anos de fratura do quadril ≥3% ou uma probabilidade de 10 anos de uma importante fratura relacionada com a osteoporose ≥20% (com base na FRAX).
Bifosfonatos
Bifosfonatos orais são o tratamento de primeira linha preferido para homens com osteoporose e alto risco de fraturas, com ou sem fratura vertebral prévia.[82]Fuggle NR, Beaudart C, Bruyère O, et al. Evidence-based guideline for the management of osteoporosis in men. Nat Rev Rheumatol. 2024 Apr;20(4):241-51.
https://www.nature.com/articles/s41584-024-01094-9
http://www.ncbi.nlm.nih.gov/pubmed/38485753?tool=bestpractice.com
Ácido alendrônico, risedronato e ácido zoledrônico são aprovados para o tratamento da osteoporose em homens. No entanto, apesar da compreensão significativa da patogênese e manejo da osteoporose masculina, várias questões importantes permanecem sem solução. Nos EUA, a FDA não aprovou o uso do ácido zoledrônico para homens com osteoporose e deficiência de testosterona.
Um estudo multicêntrico, duplo-cego, controlado por placebo de homens com hipogonadismo primário e hipogonadismo associado à osteoporose com idades entre 50-85 anos descobriu que uma infusão intravenosa de ácido zoledrônico administrado na linha basal do estudo e após 12 meses reduz o risco de novas fraturas vertebrais morfométricas em 67% ao longo de um período de 24 meses, em comparação com placebo.[186]Boonen S, Reginster JY, Kaufman JM, et al. Fracture risk and zoledronic acid therapy in men with osteoporosis. N Engl J Med. 2012 Nov 1;367(18):1714-23.
http://www.nejm.org/doi/full/10.1056/NEJMoa1204061
http://www.ncbi.nlm.nih.gov/pubmed/23113482?tool=bestpractice.com
As diretrizes do ACP indicam que a resposta ao tratamento com bifosfonato e denosumabe é similar em homens e mulheres.[67]Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, et al. Pharmacologic treatment of primary osteoporosis or low bone mass to prevent fractures in adults: a living clinical guideline from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://www.acpjournals.org/doi/full/10.7326/M22-1034
http://www.ncbi.nlm.nih.gov/pubmed/36592456?tool=bestpractice.com
Os efeitos adversos dos bifosfonatos orais referem-se principalmente ao trato gastrointestinal superior e incluem dificuldade de deglutição, esofagite e úlceras gástricas. Dor articular e muscular, osteonecrose da mandíbula e fraturas atípicas do fêmur também foram relatadas.[117]Shane E, Burr D, Abrahamsen B, et al. Atypical subtrochanteric and diaphyseal femoral fractures: second report of a task force of the American Society for Bone and Mineral Research. J Bone Miner Res. 2014 Jan;29(1):1-23.
https://onlinelibrary.wiley.com/doi/full/10.1002/jbmr.1998
http://www.ncbi.nlm.nih.gov/pubmed/23712442?tool=bestpractice.com
[118]Abrahamsen B. Adverse effects of bisphosphonates. Calcif Tissue Int. 2010 Jun;86(6):421-35.
http://www.ncbi.nlm.nih.gov/pubmed/20407762?tool=bestpractice.com
[119]Lee S, Yin RV, Hirpara H, et al. Increased risk for atypical fractures associated with bisphosphonate use. Fam Pract. 2015 Jun;32(3):276-81.
http://fampra.oxfordjournals.org/content/32/3/276.long
http://www.ncbi.nlm.nih.gov/pubmed/25846215?tool=bestpractice.com
[120]Wysowski DK, Chang JT. Alendronate and risedronate: reports of severe bone, joint and muscle pain. Arch Intern Med. 2005 Feb 14;165(3):346-7.
http://www.ncbi.nlm.nih.gov/pubmed/15710802?tool=bestpractice.com
[121]Khan AA, Sándor GK, Dore E, et al. Bisphosphonate associated osteonecrosis of the jaw. J Rheumatol. 2009 Mar;36(3):478-90.
http://www.ncbi.nlm.nih.gov/pubmed/19286860?tool=bestpractice.com
[122]Woo SB, Hellstein JW, Kalmar JR. Narrative [corrected] review: bisphosphonates and osteonecrosis of the jaws. Ann Intern Med. 2006 May 16;144(10):753-61.
http://www.ncbi.nlm.nih.gov/pubmed/16702591?tool=bestpractice.com
testosterona
A deficiência de testosterona tem sido associada à diminuição da DMO em homens, mas evidências de que a terapia de reposição de testosterona melhora a DMO ou reduz o risco de fraturas são limitadas e inconsistentes.[82]Fuggle NR, Beaudart C, Bruyère O, et al. Evidence-based guideline for the management of osteoporosis in men. Nat Rev Rheumatol. 2024 Apr;20(4):241-51.
https://www.nature.com/articles/s41584-024-01094-9
http://www.ncbi.nlm.nih.gov/pubmed/38485753?tool=bestpractice.com
Uma revisão sistemática concluiu que a terapia com testosterona não aumentou a DMO da coluna, do colo do fêmur, do triângulo de Ward e de todo o corpo, com exceção do trocânter e do quadril total em homens com idade avançada.[187]Junjie W, Dongsheng H, Lei S, et al. Testosterone replacement therapy has limited effect on increasing bone mass density in older men: a meta-analysis. Curr Pharm Des. 2019;25(1):73-84.
http://www.ncbi.nlm.nih.gov/pubmed/30727867?tool=bestpractice.com
A terapia com testosterona poderá ser considerada como adjuvante à terapia específica para osteoporose em pacientes com deficiência sintomática de testosterona.[82]Fuggle NR, Beaudart C, Bruyère O, et al. Evidence-based guideline for the management of osteoporosis in men. Nat Rev Rheumatol. 2024 Apr;20(4):241-51.
https://www.nature.com/articles/s41584-024-01094-9
http://www.ncbi.nlm.nih.gov/pubmed/38485753?tool=bestpractice.com
[188]Jayasena CN, Anderson RA, Llahana S, et al. Society for endocrinology guidelines for testosterone replacement therapy in male hypogonadism. Clin Endocrinol (Oxf). 2022 Feb;96(2):200-19.
https://onlinelibrary.wiley.com/doi/epdf/10.1111/cen.14633
http://www.ncbi.nlm.nih.gov/pubmed/34811785?tool=bestpractice.com
Não é recomendada para homens com níveis normais de testosterona.
Agentes anabólicos
Algumas diretrizes recomendam considerar o tratamento inicial com um agente anabólico (por exemplo, teriparatida, abaloparatida, romosozumabe) para homens com risco muito alto de fraturas.[81]Royal Australian College of General Practitioners. Osteoporosis management and fracture prevention in post-menopausal women and men >50 years of age. Mar 2024 [internet publication].
https://www.racgp.org.au/clinical-resources/clinical-guidelines/key-racgp-guidelines/view-all-racgp-guidelines/osteoporosis/executive-summary
[82]Fuggle NR, Beaudart C, Bruyère O, et al. Evidence-based guideline for the management of osteoporosis in men. Nat Rev Rheumatol. 2024 Apr;20(4):241-51.
https://www.nature.com/articles/s41584-024-01094-9
http://www.ncbi.nlm.nih.gov/pubmed/38485753?tool=bestpractice.com
Isso deve ser seguido por terapia sequencial com um agente antirreabsorção.[82]Fuggle NR, Beaudart C, Bruyère O, et al. Evidence-based guideline for the management of osteoporosis in men. Nat Rev Rheumatol. 2024 Apr;20(4):241-51.
https://www.nature.com/articles/s41584-024-01094-9
http://www.ncbi.nlm.nih.gov/pubmed/38485753?tool=bestpractice.com
No entanto, embora a diretriz do ACP recomende essa abordagem para mulheres com risco muito alto de fraturas, concluiu-se que as evidências eram insuficientes para fazer uma recomendação semelhante para homens.[67]Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, et al. Pharmacologic treatment of primary osteoporosis or low bone mass to prevent fractures in adults: a living clinical guideline from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://www.acpjournals.org/doi/full/10.7326/M22-1034
http://www.ncbi.nlm.nih.gov/pubmed/36592456?tool=bestpractice.com
As diretrizes sugerem que o tratamento inicial com um agente anabólico pode ser mais benéfico para pacientes com risco muito alto de fraturas na prática, e normalmente não é usado como terapia inicial em pacientes com alto risco de fratura.[81]Royal Australian College of General Practitioners. Osteoporosis management and fracture prevention in post-menopausal women and men >50 years of age. Mar 2024 [internet publication].
https://www.racgp.org.au/clinical-resources/clinical-guidelines/key-racgp-guidelines/view-all-racgp-guidelines/osteoporosis/executive-summary
[99]Morin SN, Feldman S, Funnell L, et al. Clinical practice guideline for management of osteoporosis and fracture prevention in Canada: 2023 update. CMAJ. 2023 Oct 10;195(39):E1333-48.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10610956
http://www.ncbi.nlm.nih.gov/pubmed/37816527?tool=bestpractice.com
[157]van den Bergh JP, Geusens P, Appelman-Dijkstra NM, et al. The Dutch multidisciplinary guideline osteoporosis and fracture prevention, taking a local guideline to the international arena. Arch Osteoporos. 2024 Apr 2;19(1):23.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10987374
http://www.ncbi.nlm.nih.gov/pubmed/38564062?tool=bestpractice.com
A teriparatida e a abaloparatida estão aprovadas para uso em homens com alto risco de fraturas.[189]Khosla S, Amin S, Orwoll E. Osteoporosis in men. Endocr Rev. 2008 Jun;29(4):441-64.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2528848
http://www.ncbi.nlm.nih.gov/pubmed/18451258?tool=bestpractice.com
A abaloparatida aumenta significativamente a DMO na coluna lombar, quadril total e colo do fêmur em comparação com o placebo em homens com osteoporose.[190]Czerwinski E, Cardona J, Plebanski R, et al. The efficacy and safety of abaloparatide-SC in men with osteoporosis: a randomized clinical trial. J Bone Miner Res. 2022 Dec;37(12):2435-42.
https://asbmr.onlinelibrary.wiley.com/doi/10.1002/jbmr.4719
http://www.ncbi.nlm.nih.gov/pubmed/36190391?tool=bestpractice.com
[191]Beaudart C, Demonceau C, Sabico S, et al. Efficacy of osteoporosis pharmacological treatments in men: a systematic review and meta-analysis. Aging Clin Exp Res. 2023 Sep;35(9):1789-806.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10460304
http://www.ncbi.nlm.nih.gov/pubmed/37400668?tool=bestpractice.com
As diretrizes europeias para osteoporose em homens concluíram que as evidências de melhora da DMO são mais fortes para a abaloparatida.[82]Fuggle NR, Beaudart C, Bruyère O, et al. Evidence-based guideline for the management of osteoporosis in men. Nat Rev Rheumatol. 2024 Apr;20(4):241-51.
https://www.nature.com/articles/s41584-024-01094-9
http://www.ncbi.nlm.nih.gov/pubmed/38485753?tool=bestpractice.com
No Reino Unido, a teriparatida é recomendada como tratamento alternativo para a prevenção secundária de fraturas osteoporóticas em homens.[192]NHS England. Interim clinical commissioning policy statement: teriparatide for osteoporosis in men (adults). Jan 2021 [internet publication].
https://www.england.nhs.uk/publication/interim-clinical-commissioning-policy-statement-teriparatide-for-osteoporosis-in-men-adults-2
ECRCs realizados com homens com osteoporose relatam que a teriparatida aumenta a DMO da coluna e do colo do fêmur.[193]Orwoll ES, Scheele WH, Paul S, et al. The effect of teriparatide [human parathyroid hormone (1-34)] therapy on bone density in men with osteoporosis. J Bone Miner Res. 2003 Jan;18(1):9-17.
https://asbmr.onlinelibrary.wiley.com/doi/full/10.1359/jbmr.2003.18.1.9
http://www.ncbi.nlm.nih.gov/pubmed/12510800?tool=bestpractice.com
Embora a DMO diminua gradualmente após a descontinuação do tratamento, quando seguida de um tratamento antirreabsorção, a teriparatida reduz o risco de fratura vertebral moderada e grave.[194]Kaufman JM, Orwoll E, Goemaere S, et al. Teriparatide effects on vertebral fractures and bone mineral density in men with osteoporosis: treatment and discontinuation of therapy. Osteoporos Int. 2005 May;16(5):510-6.
http://www.ncbi.nlm.nih.gov/pubmed/15322742?tool=bestpractice.com
As evidências também sugerem que a teriparatida é eficaz para tratar osteoporose tanto em homens como em mulheres menopausadas.[195]Niimi R, Kono T, Nishihara A, et al. Analysis of daily teriparatide treatment for osteoporosis in men. Osteoporos Int. 2015 Apr;26(4):1303-9.
http://www.ncbi.nlm.nih.gov/pubmed/25567777?tool=bestpractice.com
Quando o tratamento com teriparatida ou abaloparatida é interrompido, a perda óssea pode ser rápida e agentes alternativos devem ser considerados para manter a densidade mineral óssea.[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
[82]Fuggle NR, Beaudart C, Bruyère O, et al. Evidence-based guideline for the management of osteoporosis in men. Nat Rev Rheumatol. 2024 Apr;20(4):241-51.
https://www.nature.com/articles/s41584-024-01094-9
http://www.ncbi.nlm.nih.gov/pubmed/38485753?tool=bestpractice.com
O uso de romosozumabe não está aprovado em homens com osteoporose nos EUA ou na Europa, mas está aprovado em outros países para tratar homens com osteoporose que apresentam alto risco de fratura.[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
O tratamento com romosozumabe por 12 meses resultou em DMO significativamente maior na coluna, colo do fêmur e quadril total, em comparação com placebo, e foi bem tolerado em homens com osteoporose.[196]Lewiecki EM, Blicharski T, Goemaere S, et al. A phase III randomized placebo-controlled trial to evaluate efficacy and safety of romosozumab in men with osteoporosis. J Clin Endocrinol Metab. 2018 Sep 1;103(9):3183-93.
https://academic.oup.com/jcem/article/103/9/3183/5040365
http://www.ncbi.nlm.nih.gov/pubmed/29931216?tool=bestpractice.com
Denosumabe
O denosumabe está aprovado para o tratamento de homens com osteoporose que apresentam alto risco de fraturas, definido como história de fatores de fragilidade ou múltiplos fatores de risco para fraturas; ou aqueles que não tiveram êxito ou são intolerantes a outros esquemas medicamentosos disponíveis para tratamento de osteoporose (veja o alerta da FDA nas informações sobre denosumabe, na seção de mulheres menopausadas).
Também está aprovado para a profilaxia da osteoporose em homens com alto risco de fraturas após o tratamento de privação androgênica para câncer de próstata não metastático. Em homens com câncer de próstata não metastático, o denosumabe também reduziu a incidência de fratura vertebral.[197]Smith MR, Egerdie B, Hernández Toriz N, et al. Denosumab in men receiving androgen-deprivation therapy for prostate cancer. N Engl J Med. 2009 Aug 20;361(8):745-55.
https://www.nejm.org/doi/full/10.1056/NEJMoa0809003
http://www.ncbi.nlm.nih.gov/pubmed/19671656?tool=bestpractice.com
Osteoporose induzida por glicocorticoides
A osteoporose induzida por corticosteroides é um distúrbio complexo que envolve aumento da reabsorção óssea e formação óssea defeituosa. As fraturas ósseas ocorrem em 30% a 50% dos pacientes que recebem tratamento crônico com corticosteroide; portanto, sua prevenção e tratamento são fundamentais nesta população.[65]Briot K, Roux C. Glucocorticoid-induced osteoporosis. RMD Open. 2015 Apr 8;1(1):e000014.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4613168
http://www.ncbi.nlm.nih.gov/pubmed/26509049?tool=bestpractice.com
Os pacientes que recebem corticosteroides em longo prazo devem ser avaliados para risco de fratura no início da terapia e a cada 1-2 anos durante a continuação do tratamento com corticosteroide.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
O tratamento e a prevenção da osteoporose induzida por corticosteroides se baseiam na idade e no risco de fratura, variando de risco baixo a muito alto. Consulte Critérios de diagnóstico.
[Figure caption and citation for the preceding image starts]: Tratamento da osteoporose induzida por glicocorticoidesCriado pelo BMJ Knowledge Centre [Citation ends].
Mudanças de estilo de vida e suplementos
O American College of Rheumatology (ACR) recomenda que todos os adultos que tomam prednisolona em doses ≥2.5 mg/dia por ≥3 meses otimizem a ingestão de cálcio e vitamina D (com suplementação, caso necessáio) e façam modificações em seu estilo de vida (por exemplo, dieta balanceada, manutenção do peso na faixa recomendada, abandono do hábito de fumar, prática regular de exercícios de resistência ou com carga, limitação do consumo de bebidas alcoólicas a 1-2 por dia).[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Essas medidas devem ser usadas em conjunto com as intervenções farmacológicas para pacientes com risco moderado a muito alto de fratura; no entanto, nenhum tratamento adicional é recomendado para os pacientes com baixo risco de fratura.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Bifosfonatos
O uso de bifosfonato deve ser considerado para a maioria dos pacientes em tratamento contínuo com corticosteroides por >3 meses, que recebem de 2.5 a ≥7.5 mg/dia de prednisolona, e naqueles com história prévia de fratura.[24]Gregson CL, Armstrong DJ, Bowden J, et al. UK clinical guideline for the prevention and treatment of osteoporosis. Arch Osteoporos. 2022 Apr 5;17(1):58.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8979902
http://www.ncbi.nlm.nih.gov/pubmed/35378630?tool=bestpractice.com
[66]Hsu E, Nanes M. Advances in treatment of glucocorticoid-induced osteoporosis. Curr Opin Endocrinol Diabetes Obes. 2017 Dec;24(6):411-7.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5836323
http://www.ncbi.nlm.nih.gov/pubmed/28857847?tool=bestpractice.com
O ACR recomenda bifosfonatos orais ou intravenosos para adultos com risco de fratura moderado, alto ou muito alto que recebem corticosteroides em longo prazo.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Para adultos ≥40 anos de idade e risco alto ou muito alto de fratura, bifosfonatos são condicionalmente recomendados como segunda linha, com base em evidências de melhora superior na DMO com análogos do paratormônio e denosumabe.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Geralmente os pacientes com doença renal crônica (TFGe <35 mL/minuto) não devem ser tratados com bifosfonatos.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Para mulheres em idade fértil que não planejam engravidar durante o tratamento para osteoporose, é recomendado um bifosfonato oral ou intravenoso, mas deve ser usado com precaução devido aos potenciais efeitos adversos aos ossos do feto.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Os pacientes tratados com bifosfonatos orais ou intravenosos que têm risco baixo a moderado de fratura e descontinuam o tratamento com corticosteroide não precisam de terapia sequencial.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
No entanto, se ocorrer uma nova fratura após ≥12 meses da terapia inicial com bifosfonato, a terapia sequencial poderá incluir o denosumabe, um análogo do paratormônio ou o romosozumabe.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Se tratados com terapia sequencial com denosumabe, os pacientes precisarão de terapia adicional com bifosfonatos por 6-7 meses após a última dose de denosumabe para prevenir a perda óssea rápida e o desenvolvimento de novas fraturas por compressão vertebral.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Os bifosfonatos ácido alendrônico e risedronato demonstraram reduzir efetivamente as fraturas ósseas para pacientes com osteoporose induzida por corticosteroide.[198]van Brussel MS, Bultink IE, Lems WF. Prevention of glucocorticoid-induced osteoporosis. Expert Opin Pharmacother. 2009 Apr;10(6):997-1005.
http://www.ncbi.nlm.nih.gov/pubmed/19351276?tool=bestpractice.com
[  ]
How do bisphosphonates compare with placebo for improving outcomes in people with steroid-induced osteoporosis?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.1617/fullMostre-me a resposta[Evidência A]afadd294-f705-412a-b6d4-04a1a35a927cccaAComo os bifosfonatos se comparam ao placebo para melhorar os desfechos em pessoas com osteoporose induzida por corticosteroides?
]
How do bisphosphonates compare with placebo for improving outcomes in people with steroid-induced osteoporosis?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.1617/fullMostre-me a resposta[Evidência A]afadd294-f705-412a-b6d4-04a1a35a927cccaAComo os bifosfonatos se comparam ao placebo para melhorar os desfechos em pessoas com osteoporose induzida por corticosteroides?
Análogos do paratormônio
O ACR recomenda um análogo do paratormônio (por exemplo, teriparatida, abaloparatida) como opção de primeira linha para o tratamento de adultos ≥40 anos de idade com risco alto a muito alto de fratura, inclusive pacientes que fazem tratamento com corticosteroide em doses muito altas (dose inicial de prednisolona ≥30 mg/dia ou dose cumulativa de prednisolona ≥5 g em 1 ano).[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Para pacientes com risco moderado de fratura, um análogo do paratormônio pode ser considerado como opção alternativa.[24]Gregson CL, Armstrong DJ, Bowden J, et al. UK clinical guideline for the prevention and treatment of osteoporosis. Arch Osteoporos. 2022 Apr 5;17(1):58.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8979902
http://www.ncbi.nlm.nih.gov/pubmed/35378630?tool=bestpractice.com
[199]Anastasilaki E, Paccou J, Gkastaris K, et al. Glucocorticoid-induced osteoporosis: an overview with focus on its prevention and management. Hormones (Athens). 2023 Dec;22(4):611-22.
http://www.ncbi.nlm.nih.gov/pubmed/37755658?tool=bestpractice.com
O ACR os recomenda como opção de primeira linha para adultos com risco moderado de fratura e enfatiza a tomada de decisão compartilhada para a escolha da terapia inicial, considerando as preferências do médico e do paciente e as comorbidades.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Os análogos do paratormônio devem ser evitados para o tratamento de adultos jovens com placa epifisária aberta.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
O tratamento com teriparatida demonstrou aumentar a DMO das vértebras lombares, em comparação com o denosumabe, e reduz o risco de fratura vertebral, em comparação com os bifosfonatos, para pacientes com osteoporose induzida por corticosteroides.[200]Yuan C, Liang Y, Zhu K, et al. Clinical efficacy of denosumab, teriparatide, and oral bisphosphonates in the prevention of glucocorticoid-induced osteoporosis: a systematic review and meta-analysis. J Orthop Surg Res. 2023 Jun 22;18(1):447.
https://josr-online.biomedcentral.com/articles/10.1186/s13018-023-03920-4
http://www.ncbi.nlm.nih.gov/pubmed/37349750?tool=bestpractice.com
Estudos pré-clínicos e com animais sugerem que a abaloparatida pode mitigar ou prevenir a perda óssea derivada de glicocorticoides e melhorar a consolidação de fraturas.[201]Brent MB. Abaloparatide: a review of preclinical and clinical studies. Eur J Pharmacol. 2021 Oct 15;909:174409.
https://www.doi.org/10.1016/j.ejphar.2021.174409
http://www.ncbi.nlm.nih.gov/pubmed/34364879?tool=bestpractice.com
Não há dados disponíveis de ensaios clínicos sobre a avaliação da abaloparatida para o tratamento da osteoporose induzida por corticosteroides.
Os pacientes devem ser informados de que a interrupção do tratamento com análogo do paratormônio sem se fazer a transição para outra terapia pode resultar em perda óssea. Isso pode ser evitado iniciando-se bifosfonatos orais ou intravenosos para os pacientes com risco baixo a moderado de fratura quando o análogo do paratormônio e os corticosteroides forem descontinuados.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Se ocorrer fratura quando o paciente tiver sido tratado com um análogo do paratormônio por ≥12 meses, a terapia sequencial poderá incluir bifosfonatos orais ou intravenosos ou denosumabe.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Se tratados com terapia sequencial com denosumabe, os pacientes precisarão de terapia adicional com bifosfonatos por 6-7 meses após a última dose de denosumabe para prevenir a perda óssea rápida e o desenvolvimento de novas fraturas por compressão vertebral.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Denosumabe
O denosumabe está aprovado para o tratamento da osteoporose induzida por glicocorticoides em homens e mulheres com alto risco de fratura, incluindo aqueles com história de fraturas osteoporóticas, com múltiplos fatores de risco clínico para fratura e aqueles que não podem tolerar ou não responderam a outros tratamentos (veja o alerta da FDA nas informações sobre denosumabe, na seção de mulheres menopausadas).
O ACR recomenda denosumabe como opção de primeira linha para adultos com risco moderado de fratura e adultos ≥40 anos de idade com alto risco de fratura.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Para adultos ≥40 anos de idade com risco muito alto de fratura, denosumabe é recomendado como opção de segunda linha.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
O denosumabe deve ser usado com cautela nas mulheres em idade fértil devido aos potenciais efeitos adversos para o feto, e a gravidez deve ser evitada até 5 meses após a última dose.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
O tratamento com denosumabe deve ser evitado no tratamento de adultos jovens com placa epifisária aberta.
Uma revisão sistemática relatou que denosumabe aumentou consideravelmente a DMO na coluna lombar em 6 meses, e na coluna lombar e no colo do fêmur em 12 meses, em comparação com a terapia com bifosfonato em pacientes com osteoporose induzida por corticosteroide.[202]Yamaguchi Y, Morita T, Kumanogoh A. The therapeutic efficacy of denosumab for the loss of bone mineral density in glucocorticoid-induced osteoporosis: a meta-analysis. Rheumatol Adv Pract. 2020;4(1):rkaa008.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7197806
http://www.ncbi.nlm.nih.gov/pubmed/32373775?tool=bestpractice.com
Os pacientes com osteoporose induzida por corticosteroide tratados com denosumabe com risco baixo a moderado de fratura quando o denosumabe e a corticoterapia forem interrompidos devem receber 1-2 anos de terapia sequencial com um bifosfonato para prevenir a perda óssea rápida.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Se ocorrer uma nova fratura quando o paciente tiver sido tratado com denosumabe por ≥12 meses, a terapia sequencial pode incluir bifosfonatos orais ou intravenosos, ou romosozumabe.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Romosozumabe
Romosozumabe está aprovado para o tratamento da osteoporose em mulheres menopausadas com alto risco de fratura, ou pacientes que não obtiveram sucesso ou são intolerantes a outras terapias para osteoporose disponíveis, mas não foi avaliado para o tratamento da osteoporose induzida por corticosteroide.[203]Taylor AD, Saag KG. Anabolics in the management of glucocorticoid-induced osteoporosis: an evidence-based review of long-term safety, efficacy and place in therapy. Core Evid. 2019 Aug 23;14:41-50.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6711555
http://www.ncbi.nlm.nih.gov/pubmed/31692480?tool=bestpractice.com
No entanto, o ACR recomenda condicionalmente o romosozumabe como tratamento para adultos ≥40 anos de idade com risco moderado a alto de fratura, inclusive aqueles que tomam altas doses de corticosteroides (dose inicial de prednisolona ≥30 mg/dia ou dose cumulativa de prednisolona ≥5 g em 1 ano) apenas se forem intolerantes a todos os outros tratamentos.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
O romosozumabe não é recomendado para pacientes <40 anos de idade com risco moderado a alto de fratura, e só deve ser considerado para aqueles que recebem corticosteroides em altas doses se outros tratamentos não forem tolerados.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Os pacientes tratados com romosozumabe que apresentam risco baixo ou moderado de fratura quando o tratamento com romosozumabe e corticosteroide é interrompido precisarão de terapia sequencial com bifosfonato oral ou intravenoso; para aqueles que apresentam nova fratura após ≥12 meses de tratamento com romosozumabe, um bifosfonato oral ou intravenoso ou o denosumabe podem ser usados para a terapia sequencial.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Os pacientes tratados com denosumabe para terapia sequencial precisarão de 6-7 meses adicionais de terapia com bifosfonato para prevenir a perda óssea rápida e o desenvolvimento de novas fraturas vertebrais por compressão.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Raloxifeno
Não há evidências de eficácia do raloxifeno para tratar pacientes com osteoporose induzida por corticosteroides.[204]Popp AW, Isenegger J, Buergi EM, et al. Glucocorticosteroid-induced spinal osteoporosis: scientific update on pathophysiology and treatment. Eur Spine J. 2006 Jul;15(7):1035-49.
http://www.ncbi.nlm.nih.gov/pubmed/16474946?tool=bestpractice.com
No entanto, o ACR recomenda condicionalmente o raloxifeno como tratamento para adultos ≥40 anos de idade com risco moderado a alto de fratura, inclusive aqueles que tomam altas doses de corticosteroides (dose inicial de prednisolona ≥30 mg/dia ou dose cumulativa de prednisolona ≥5 g em 1 ano) apenas se forem intolerantes a todos os outros tratamentos.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
O raloxifeno não é recomendado para pacientes <40 anos de idade com risco moderado a alto de fratura, e só deve ser considerado para aqueles que recebem corticosteroides em altas doses se outros tratamentos não forem tolerados.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Os pacientes tratados com raloxifeno que apresentam risco baixo ou moderado de fratura quando o tratamento com raloxifeno e corticosteroide é interrompido não precisarão de terapia sequencial.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Se ocorrer uma nova fratura após o tratamento com raloxifeno por ≥12 meses, a terapia sequencial com bifosfonato oral ou intravenoso é necessária.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com


 ]
[Evidência A]
]
[Evidência A]