Abordagem
A investigação diagnóstica para adenocarcinoma de sítio primário desconhecido (ASPD) inclui anamnese e exame físico completos, exames laboratoriais, estudos de imagem e biópsia (avaliação patológica).[2]
As investigações desnecessárias (por exemplo, aquelas com baixo rendimento diagnóstico e aquelas com pouca probabilidade de afetar as decisões de tratamento) devem ser evitadas para evitar atrasos no início do tratamento.[16]
As metas principais da investigação diagnóstica são:
confirmar a ausência de um sítio primário,
confirmar o subtipo histológico e
identificar pacientes com um subtipo favorável (por exemplo, lesão metastática única; características clinicopatológicas análogas a um câncer primário conhecido).
Os pacientes com um subtipo favorável podem receber tratamento personalizado com terapia específica para o local, o que pode melhorar os desfechos. Aproximadamente 20% dos pacientes com câncer de sítio primário desconhecido (CSPD) apresentam um subtipo favorável.[2][3] Consulte Etiologia (Classificação) para obter detalhes sobre subtipos favoráveis.
Se um sítio primário for identificado durante a investigação diagnóstica, o paciente deve ser tratado de acordo com as diretrizes pertinentes ao sítio primário.
Anamnese e exame físico
A história deve incluir biópsias ou neoplasias malignas anteriores, qualquer história de lesões removidas ou regredidas e qualquer história familiar de câncer.[2] A história de estilo de vida (incluindo tabagismo e consumo de bebidas alcoólicas) e uma revisão sistemática podem ajudar a determinar o estado geral de saúde e a capacidade funcional do paciente.
O exame físico deve incluir mama, trato geniturinário, pelve, reto, pele, cabeça e pescoço (incluindo cavidade oral, tireoide e linfonodos).[2]
Sinais e sintomas
O quadro clínico do ASPD é geralmente relacionado aos sítios de envolvimento do tumor metastático, que costumam ser vários, e tipicamente incluem fígado, pulmões, linfonodos e ossos. Raramente os sinais e sintomas de apresentação esclarecem alguma informação sobre o sítio primário.
Os sinais e sintomas de apresentação incluem:
Dor (por exemplo, dor abdominal devido à irritação peritoneal; dor torácica devido à irritação pleural; dor óssea devido à fratura patológica com comprometimento ósseo)
Edema localizado (por exemplo, adenopatia da cadeia cervical se os linfonodos superficiais estiverem envolvidos; hepatomegalia se o fígado estiver envolvido)
Icterícia obstrutiva decorrente de lesões pancreático-biliares
massa palpável
Sintomas de pneumonia pós-obstrutiva (pneumonia que ocorre distalmente a uma massa brônquica) ocorrendo com envolvimento pulmonar parenquimatoso (por exemplo, tosse, sibilo, dispneia)
Hemoptise com envolvimento pulmonar parenquimatoso
Sintomas constitucionais (por exemplo, fraqueza, fadiga, mal-estar, anorexia, inapetência, saciedade precoce, náuseas e perda de peso) que geralmente são progressivos
Dor ou fraqueza neuropática
Cefaleias e/ou convulsões
Ascite
Delirium
Se um provável sítio primário for sugerido pela história e exame físico, os exames diagnósticos devem ser direcionados para esse sítio.
Exames laboratoriais
Os exames laboratoriais iniciais incluem:[2][3]
Hemograma completo
Perfil metabólico completo (incluindo testes da função hepática, creatinina, cálcio, eletrólitos).
Os exames adicionais que podem ser realizados, se clinicamente indicados, incluem:[2][3][17]
Exame de sangue oculto nas fezes (se houver suspeita de doença colorretal primária)
Lactato desidrogenase (para avaliar a atividade da doença e a carga tumoral; pode informar a avaliação de risco e o prognóstico)
Urinálise (para avaliar a função renal, detectar síndromes paraneoplásicas ou avaliar anormalidades metabólicas associadas)
Exames de imagem
A tomografia computadorizada (TC) do tórax, abdome e pelve, com contraste intravenoso, deve ser realizada como parte da investigação diagnóstica inicial.[2]
A ressonância nuclear magnética (RNM) com e sem contraste intravenoso pode ser realizada se a TC for contraindicada ou se os pacientes tiverem suspeita de câncer de cabeça e pescoço, metástases cerebrais ou neoplasias pélvicas.[3][18][19][20]
Outros exames de imagem
A tomografia por emissão de pósitrons com 18F-fluordesoxiglucose/CT (FDG-PET/CT) não é recomendada rotineiramente, mas pode ser considerada se a TC ou a RNM com contraste for contraindicada ou se clinicamente indicada (por exemplo, se um paciente apresentar uma massa cervical).[2][19]
A mamografia é necessária para pacientes com um quadro clínico sugestivo de câncer de mama (por exemplo, envolvimento de linfonodos axilares, mediastinais e/ou supraclaviculares).[2][3][21] A RNM da mama com contraste e/ou a ultrassonografia da mama são indicadas se a mamografia não for diagnóstica, mas houver evidências histopatológicas de câncer de mama.[2]
A ultrassonografia transvaginal é a modalidade de imagem preferencial para mulheres que apresentam ascite, para avaliar a presença de massa ovariana. O Doppler colorido deve ser incluído no exame.[22]
[Figure caption and citation for the preceding image starts]: TC abdominal com contraste intravenoso, revelando diversas lesões com realce no lobo hepático direito, com ascite associada; a biópsia percutânea de uma dessas lesões revelou adenocarcinoma, mas nenhum sítio primário foi identificado durante a investigação de rotina: uma manifestação típica de ASPDDo acervo pessoal do Dr. D. Cosgrove [Citation ends].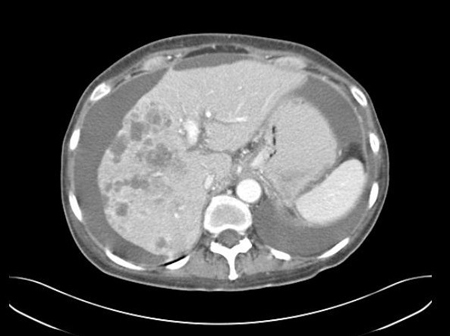 [Figure caption and citation for the preceding image starts]: Tomografia computadorizada (TC) abdominal com contraste intravenoso, revelando diversas lesões hepáticas com realce nos dois lobos hepáticos; a biópsia percutânea de uma lesão do lobo direito revelou adenocarcinomaDo acervo pessoal do Dr. D. Cosgrove [Citation ends].
[Figure caption and citation for the preceding image starts]: Tomografia computadorizada (TC) abdominal com contraste intravenoso, revelando diversas lesões hepáticas com realce nos dois lobos hepáticos; a biópsia percutânea de uma lesão do lobo direito revelou adenocarcinomaDo acervo pessoal do Dr. D. Cosgrove [Citation ends].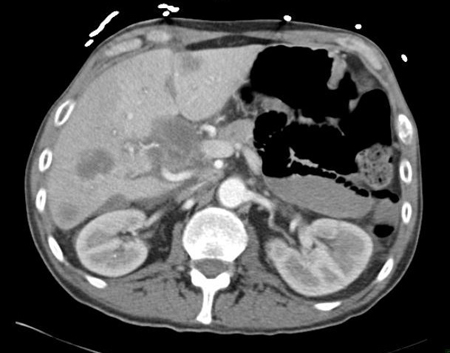
Biópsia e avaliação patológica
O diagnóstico de ASPD requer uma avaliação patológica precisa de uma amostra de biópsia.[2] A amostra deve ser obtida por meio de biópsia percutânea com agulha grossa (preferencial) e/ou aspiração com agulha fina do local metastático mais facilmente acessível.[2] Uma biópsia por agulha grossa, incisional ou excisional pode ser realizada se material adicional para biópsia for necessário.
Consulte um patologista antes de qualquer biópsia para determinar a extensão da amostra necessária para diferenciar entre os prováveis locais primários.
As amostras de biópsia devem ser examinadas inicialmente por microscopia óptica para confirmar o subtipo histológico (isto é, adenocarcinoma).[2]
Exames de coloração imuno-histoquímica
Uma vez confirmado o diagnóstico histológico de adenocarcinoma, é realizado o exame de coloração imuno-histoquímica para biomarcadores específicos. Amostras de biópsia podem fornecer informações sobre a linhagem do tumor e o tipo de célula (tumoral) para ajudar a identificar o provável sítio do tumor primário.[2] Em alguns pacientes, o exame de coloração imuno-histoquímica pode ser realizado para identificar marcadores tumorais potencialmente acionáveis (por exemplo, rearranjos RAS, HER2 ou ALK).
Os exames para marcadores específicos na coloração imuno-histoquímica devem seguir uma abordagem gradual com base nos achados na investigação diagnóstica inicial e em consulta com um patologista.[2][3] Deve-se evitar testar uma grande série de marcadores de coloração imuno-histoquímica.[2]
Os seguintes marcadores de coloração imuno-histoquímica podem ser usados para identificar a linhagem do tumor e o provável sítio primário:[2]
Pan-queratina (AE1/AE3 e CAM5.2): pode indicar uma linhagem de carcinoma
Citoqueratina-7 (CK7): geralmente, a expressão é limitada a câncer de pulmão, mama, ovário, endométrio e gastrointestinal superior/pancreático-biliar, e não é observada em tumores do trato gastrointestinal inferior
Citoqueratina-20 (CK20): geralmente expresso no epitélio gastrointestinal, urotélio e células de Merkel
CDX2: sugere doença primária colorretal ou de outro tipo gastrointestinal, ou doença primária do trato pancreatobiliar
SATB2: sugere câncer colorretal ou de outro trato gastrointestinal, ou osteossarcoma primário
TTF-1: sugere doença primária no pulmão ou tireoide
Napsin A: sugere doença primária no pulmão
GATA3: sugere doença primária na mama, bexiga urinária ou glândula salivar
PAX8: sugere doença primária renal, ovariana, endometrial, do colo uterino, timo ou tireoidiana
Receptor estrogênico/receptor de progesterona: sugere doença primária na mama, ovário ou endométrio
Uma lista mais extensa de marcadores de coloração imuno-histoquímica está disponível em diretrizes publicadas.[2][3][23]
As informações obtidas nesses testes devem ser consideradas em conjunto com o cenário clínico e outros resultados de testes.
Os marcadores iniciais de coloração imuno-histoquímica estreitam o diferencial de prováveis locais primários; antibióticos mais específicos podem ser usados para solidificar ainda mais o diagnóstico.[24] Os resultados de testes adicionais podem não alterar o tratamento; portanto, é preciso ter cautela para evitar atrasos desnecessários no início do tratamento.
Os perfis de marcadores de coloração imuno-histoquímica podem, ocasionalmente, diferir entre lesões primárias e metastáticas.[25][26][27]
Investigações adicionais
Alguns pacientes podem ser submetidos a exames adicionais dependendo do quadro clínico, dos achados das investigações iniciais e da avaliação patológica.
Estudos endoscópicos
A endoscopia deve ser considerada se os exames de coloração imuno-histoquímica sugerirem doença primária gastrointestinal superior ou colorretal, ou se os pacientes apresentarem certos achados clínicos (por exemplo, metástases hepáticas; linfonodos supraclaviculares positivos).[2]
A laringoscopia direta, com ou sem esofagoscopia e broncoscopia, é recomendada para pacientes com linfadenopatia cervical.[19] A extensão dos exames depende do nível de linfonodos cervicais envolvidos. Exames adicionais com coloração imuno-histoquímica podem ajudar a confirmar um tumor primário de cabeça e pescoço oculto.
paracentese
A paracentese (se tecnicamente possível) é recomendada em todos os pacientes que apresentam ascite para avaliar adenocarcinoma peritoneal.[21]
Marcadores tumorais séricos
A avaliação de marcadores tumorais séricos pode ser considerada em cenários clínicos específicos para identificar um possível sítio primário.[2] Entretanto, eles são inespecíficos e não têm nenhuma função diagnóstica em pacientes com ASPD.
O antígeno prostático específico (PSA) deve ser medido para avaliar a próstata como possível sítio primário nos seguintes pacientes:[2]
Homens com idade >40 anos com ASPD (exceto aqueles com metástases limitadas ao fígado ou cérebro)
Todos os homens com ASPD que apresentam metástases ósseas ou múltiplos sítios de comprometimento
A alfafetoproteína sérica (AFP) e a gonadotrofina coriônica humana subunidade beta (beta-hCG) devem ser medidas (seguidas de ultrassonografia testicular, se a AFP ou a beta-hCG estiverem elevadas) para avaliar possível célula germinativa testicular como sítio primário nos seguintes pacientes:[2]
Homens com idade <50 anos com ASPD apresentando linfonodos mediastinais positivos
Homens com idade <65 anos com ASPD apresentando massa retroperitoneal
O CA-125 deve ser medido para avaliar possível câncer ovariano primário (em consulta com um oncologista ginecológico) nas seguintes pacientes com ovários:[2]
Mulheres com idade <50 anos com ASPD apresentando linfonodos mediastinais positivos
Mulheres de qualquer idade com ASPD apresentando metástases nos linfonodos inguinais, tórax (múltiplos nódulos) ou peritônio (com ou sem ascite)
Mulheres com ASPD apresentando derrame pleural ou massa retroperitoneal
O teste para antígeno carcinoembriogênico (CEA), CA 19-9 e CA 15-3, não tem função diagnóstica, mas pode ser útil em certas circunstâncias; por exemplo, na avaliação da resposta ao tratamento, onde pode ser considerada a criação de uma linha basal durante a investigação diagnóstica.[2]
Teste de biomarcadores genéticos
As seguintes investigações podem ser realizadas para identificar biomarcadores genéticos para orientar o uso de terapia e imunoterapia orientadas por biomarcadores:[2]
Teste de instabilidade de microssatélite (IMS)/reparo de erro de pareamento (MMR) para orientar o uso de inibidores de checkpoint imunológico.
Análise da carga mutacional tumoral (TMB) (usando ensaios validados e/ou aprovados pela Food and Drug Administration [FDA] dos EUA) para orientar o uso de inibidores de checkpoint imunológico.
Criação de perfil molecular (por exemplo, usando ensaios de sequenciamento de última geração [NGS]) para identificar mutações genéticas acionáveis (por exemplo, BRAF V600E) e alterações (por exemplo, fusões de genes NTRK ou RET). Considerada após confirmação histológica.
O uso deste conteúdo está sujeito ao nosso aviso legal