Abordagem
Os bebês com IDCG geralmente apresentam infecções recorrentes e incomumente graves (incluindo infecções oportunistas), deficit no crescimento e/ou diarreia crônica. Os principais achados no exame físico podem incluir a ausência de tecido linfoide, ganho de peso insatisfatório ou rash eritematoso difuso. As características diagnósticas precoces incluem a linfopenia e a ausência de uma sombra tímica à radiografia torácica. O diagnóstico específico requer fenotipagem dos linfócitos (por citometria de fluxo) e teste genético molecular.[22] O diagnóstico precoce é fundamental, pois leva a tratamento imediato e redução da morbidade e da mortalidade.[8][10][23][24][25]
Em países como os EUA, onde o rastreamento neonatal para IDCG faz parte da rotina, um diagnóstico precoce pode ser feito antes que os sinais e sintomas da IDCG se desenvolvam.[26][27]
História
O padrão de herança para a IDCG é autossômico recessivo ou ligado ao cromossomo X. Portanto, é essencial obter uma história familiar detalhada, perguntando sobre membros da família com IDCG e mortes de membros da família na primeira infância.[4] Uma história familiar de mortes infantis precoces atribuídas à infecção ou ao retardo do crescimento pôndero-estatural pode ser condizente com uma imunodeficiência primária hereditária como IDCG. Em países que implementaram o rastreamento neonatal para IDCG, os resultados desse teste devem ser obtidos.
Uma história de retardo do crescimento pôndero-estatural, infecções oportunistas (por exemplo, Pneumocystis jirovecii), infecções virais, pneumonias recorrentes, candidíase ou infecções que não curam apesar de tratamento apropriado com antimicrobianos exige uma avaliação para IDCG.[8][23] Devido à transferência placentária de anticorpos maternos e ao isolamento de neonatos (comum em algumas culturas), infecções em bebês com IDCG podem não ocorrer nos primeiros meses de vida. Com infecções crônicas, como gastroenterite viral, a diarreia crônica é um sintoma comum.
A história deve incluir a sorologia para vírus da imunodeficiência humana (HIV) da mãe e investigações para descartar as causas secundárias de imunodeficiência, como medicamentos (por exemplo, corticosteroides), doenças metabólicas (por exemplo, diabetes mellitus, insuficiência renal/hepática) ou doenças infecciosas (por exemplo, HIV, sarampo, varicela, citomegalovírus [CMV], vírus Epstein-Barr [EBV]). História de aleitamento materno seria útil para apurar infecção por CMV congênita ou neonatal.[28]
Uma história familiar de autoimunidade e neoplasias também deve ser investigada.[29]
Histórico étnico e a possibilidade de consanguinidade devem ser avaliados porque há um aumento na incidência de IDCG em regiões com altos índices de consanguinidade (por exemplo, países do Oriente Médio, índios norte-americanos falantes de atabascano).[12][13][14][15][30]
Exame físico
Geralmente, os lactentes com IDCG aparentam estar saudáveis ao nascer. As anormalidades do exame físico que podem aparecer mais tardiamente na vida incluem:[15][31]
Retardo do crescimento pôndero-estatural (ou seja, diminuição do crescimento e ganho inadequado peso)
Achados indicativos de infecção (por exemplo, taquipneia, estertores, candidíase oral e infecções fúngicas da pele ou das unhas)
Ausência de tecido linfoide (amígdalas e linfonodos) pode ser observada, mas pode ser difícil de detectar em bebês pequenos.
Características dismórficas específicas podem se desenvolver, como por exemplo:
Anormalidades esqueléticas, cegueira e distonia em pacientes com IDCG por deficiência de adenosina desaminase.[23]
Úlceras orais e genitais em pacientes com IDCG de Artemis/1C de reparo de ligação cruzada de DNA (DCLRE1C).[32]
Microcefalia em pacientes com IDCG associada à DNA ligase IV.[33]
Erupção cutânea eritrodérmica difusa no primeiro mês de vida em pacientes com variantes hipomórficas da IDCG.[34] Uma apresentação cutânea semelhante (juntamente com hepatoesplenomegalia e eosinofilia) pode ser observada em bebês com IDCG com enxerto materno de células T ocorrendo no útero (isto é, um sinal de doença do enxerto contra o hospedeiro) e com hemoderivados não irradiados.[31] A presença de eritrodermia ou erupção cutânea também sugere a possibilidade de um diagnóstico diferencial de síndrome de Omenn, um diagnóstico clínico associado a vários defeitos genéticos relacionados à IDCG.[4]
Sensibilidade à radiação em pacientes com IDCG de DCLRE1C, deficiência de DNA ligase IV ou deficiência de Cernunnos/XLF.[35][36][37]
Investigações laboratoriais
Contagem absoluta de linfócitos
Um hemograma completo com diferencial e cálculo da contagem absoluta de linfócitos (CAL) é a investigação laboratorial inicial para todos os pacientes com suspeita de IDCG. A linfopenia em um hemograma completo de rotina também deve alertar o médico para considerar IDCG.
A CAL é calculada multiplicando-se a porcentagem de linfócitos pela contagem absoluta de leucócitos. Uma CAL <3000 células/mm³ foi proposta como valor de corte para determinar quais bebês precisam passar por uma nova avaliação para IDCG.[38]
A CAL pode ser normal em casos de enxerto materno de linfócitos ou em condições em que a expressão gênica esteja parcialmente intacta (por exemplo, variantes hipomórficas de IDCG), ou nos casos em que as células B componham a maioria da população de linfócitos (por exemplo, IDCG T-B+).
Citometria de fluxo
A citometria de fluxo é necessária para diagnosticar a IDCG e classificar os pacientes de acordo com o fenótipo dos linfócitos. É o teste diagnóstico inicial para todos os pacientes com suspeita de IDCG.[2][4]
A citometria de fluxo mede o número total de células T, subconjuntos de células T (ou seja, células T CD4+, células T CD8+), células T virgens (CD4+CD45RA+), células T de memória (CD4+CD45RO+), células B e células Natural Killer (NK) no sangue periférico.
A classificação fenotípica da IDCG é baseada na ausência ou presença de células B (B- ou B+) e células NK (NK- ou NK+), além da ausência de células T (T-).[2][3]
Em bebês saudáveis, a maioria das células T é virgem (por exemplo, isótipo CD45RA+). Em todas as formas de IDCG, há uma diminuição profunda no número de todas as células T, incluindo células T virgens. O enxerto materno de células T ou a função genética residual nas variantes hipomórficas de IDCG pode resultar em números baixos a normais de células T, mas quase todas essas células T são células T de memória (CD4+CD45RO+).[8]
O Primary Immune Deficiency Treatment Consortium define a IDCG como ausência ou um número muito baixo de células T (células T CD3 <300/microlitro) e função das células T ausente ou muito baixa (<10% do limite inferior do normal), conforme medida por estudos da proliferação das células T com o uso de fito-hemaglutinina (PHA).[39]
Teste quantitativo de imunoglobulinas (IgG, IgM e IgA)
Realizado em todos os pacientes com suspeita de IDCG para auxiliar na confirmação do diagnóstico.
Todos os pacientes com IDCG (incluindo aqueles com números normais de células B) apresentam hipogamaglobulinemia secundária à falta de células T, auxiliando na indução da produção de anticorpos.[4] Os pacientes não apresentam iso-hemaglutininas e respostas de anticorpos específicas a vacinas inativadas à base de proteínas, como tétano e difteria.[34]
Os neonatos geralmente apresentam níveis mensuráveis de IgG devidos à transferência placentária de IgG materna para o feto, mas a IgM e a IgA estão ausentes ou têm níveis baixos.
Exames por imagem
Uma radiografia torácica demonstra ausência da sombra tímica em todos os pacientes com IDCG (exceto naqueles com IDCG devida a deficiência de coronina 1A).[4][40][Figure caption and citation for the preceding image starts]: Radiografia torácica de um bebê ilustrando a ausência de sombra tímica; os bebês com imunodeficiência combinada grave (IDCG) podem ser atímicos no momento da apresentaçãoChildren's Hospital of Wisconsin, Departamento de Radiologia; usado com permissão [Citation ends].
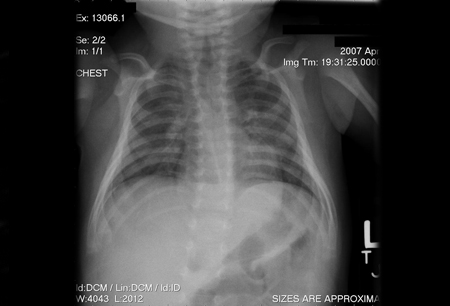 [Figure caption and citation for the preceding image starts]: Radiografia torácica de um bebê ilustrando uma sombra tímica normalChildren's Hospital of Wisconsin, Departamento de Radiologia; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Radiografia torácica de um bebê ilustrando uma sombra tímica normalChildren's Hospital of Wisconsin, Departamento de Radiologia; usado com permissão [Citation ends].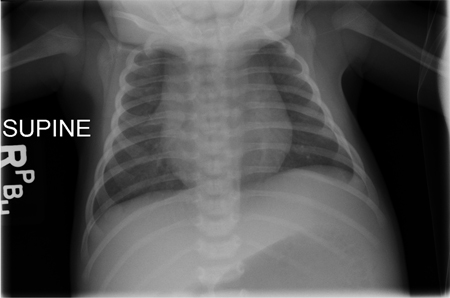 Essa observação dá suporte ao diagnóstico de IDCG, embora a redução do tamanho do timo também possa ser causada por timectomia, inflamação crônica, uso de corticosteroides e estresse.[4]
Essa observação dá suporte ao diagnóstico de IDCG, embora a redução do tamanho do timo também possa ser causada por timectomia, inflamação crônica, uso de corticosteroides e estresse.[4]
Pacientes com IDCG por deficiência de adenosina desaminase podem demonstrar anormalidades costais anteriores à radiografia (isto é, escavação e desgaste das articulações costocondrais).[41]
Ultrassonografia, tomografia computadorizada ou ressonância nuclear magnética também podem demonstrar a ausência de timo.[Figure caption and citation for the preceding image starts]: Radiografia torácica de um bebê ilustrando uma sombra tímica normalChildren's Hospital of Wisconsin, Departamento de Radiologia; usado com permissão [Citation ends].
 [Figure caption and citation for the preceding image starts]: Radiografia torácica de um bebê ilustrando a ausência de sombra tímica; os bebês com imunodeficiência combinada grave (IDCG) podem ser atímicos no momento da apresentaçãoChildren's Hospital of Wisconsin, Departamento de Radiologia; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Radiografia torácica de um bebê ilustrando a ausência de sombra tímica; os bebês com imunodeficiência combinada grave (IDCG) podem ser atímicos no momento da apresentaçãoChildren's Hospital of Wisconsin, Departamento de Radiologia; usado com permissão [Citation ends].
Outras investigações
Em bebês com suspeita de IDCG com infecção por CMV, deve ser realizada avaliação fundoscópica regular da retinite por CMV.
Em casos suspeitos de defeitos metabólicos da purina (por exemplo, deficiência de adenosina desaminase e deficiência de purina nucleosídeo fosforilase), os níveis das enzimas e os metabólitos linfotóxicos associados (por exemplo, desoxi-ATP) devem ser medidos.[34] A deficiência de purina nucleosídeo fosforilase pode ser associada à diminuição do ácido úrico sérico (<59 micromoles/L [<1 mg/dL]).
O teste funcional do sistema imunológico deve ser realizado usando-se estudos da proliferação de células T, se houver um número mensurável de células T no sangue periférico. Os pacientes com IDCG mostram resposta ausente ou reduzida aos mitógenos, incluindo PHA e concanavalina A.[34] Considere adiar os estudos da proliferação de células T se as células T estiverem ausentes.
A testagem para viremia baseada em reação em cadeia da polimerase para HIV-1, CMV e EBV deve ser realizada em todos os pacientes com suspeita de IDCG. Estudos sorológicos para infecções virais não devem ser usados, pois os anticorpos maternos adquiridos por via transplacentária podem levar a resultados falso-positivos.
Em pacientes com suspeita de defeitos nos genes envolvidos no reparo e recombinação de DNA (por exemplo, Artemis/DCLRE1C, DNA ligase IV e Cernunnos/XLF), deve ser realizado o teste de sensibilidade à radiação das culturas de fibroblastos.
Teste genético
Deve ser realizado um exame de DNA para identificar a etiologia genética subjacente à IDCG, mas não deve protelar o tratamento quando o diagnóstico da IDCG for claro. Pacientes com IDCG em decorrência de defeitos nos genes envolvidos na recombinação e reparo de DNA não devem receber esquemas condicionantes padrão para o transplante de células-tronco hematopoiéticas, e deve-se realizar um teste genético ou um teste de sensibilidade à radiação, se possível.[31]
O uso deste conteúdo está sujeito ao nosso aviso legal