História e exame físico
Principais fatores diagnósticos
comuns
presença de fatores de risco
Inclui história de exposição a espécies de Triatoma; história de transfusão sanguínea; história de transplante de órgãos; história de imunossupressão; profissionais de saúde ou técnicos laboratoriais; pobreza; baixo nível educacional; viagens a regiões endêmicas; residência em regiões endêmicas ou de alto risco; ingestão de alimentos ou bebidas contaminados e história familiar positiva (inclusive mãe chagásica).
febre prolongada
Pode estar presente na fase aguda da doença. Trata-se de sinal inespecífico caracterizado por temperaturas febris prolongadas (7-30 dias) e constantes (geralmente de 37.5 °C a 38.5 °C [99.5 °F a 101 °F]), com elevação noturna.
Em determinadas situações de ingestão de alimentos ou bebidas contaminados, os casos podem apresentar ciclo febril curto (em geral <7 dias).
palpitações
Na fase aguda, pode ser um sinal de miocardite aguda.
síncope ou pré-síncope
hepatoesplenomegalia
Leve ou moderada. Tipicamente indolor.
linfonodos aumentados
Leve ou moderada. Tipicamente indolor. Principais regiões: auricular, cervical, submandibular, axilar e inguinal.
taquicardia
Pode estar presente na fase aguda da doença como sinal de miocardite aguda.
hipotensão
Pode estar presente na fase aguda da doença como sinal de miocardite aguda.
cardiomegalia
Pode estar presente na fase aguda da doença como sinal de miocardite aguda ou derrame pericárdico.
Pode estar presente na fase crônica da doença como um sinal de insuficiência cardíaca crônica, e geralmente está associada à disfunção sistólica.
Incomuns
disfagia
Na fase crônica, a disfagia a líquidos e sólidos pode estar correlacionada com comprometimento gastrointestinal.
regurgitação/aspiração
Na fase crônica, pode estar relacionada com comprometimento gastrointestinal.
odinofagia
Na fase crônica, pode estar relacionada com comprometimento gastrointestinal.
desconforto subesternal
Na fase crônica, pode estar relacionada com comprometimento gastrointestinal.
constipação prolongada
Na fase crônica, pode estar relacionada com comprometimento gastrointestinal. Indica oclusão intestinal ou volvo de sigmoide.
dor abdominal aguda
Na fase crônica, pode estar relacionada com comprometimento gastrointestinal. Pode representar emergência gastrointestinal (isquemia intestinal ou volvo). Também pode estar associada à hepatopatia congestiva na doença em fase crônica com comprometimento cardíaco.
distensão abdominal
Na fase crônica, a distensão gasosa ou assimétrica pode estar correlacionada com comprometimento gastrointestinal. Sinal de megacólon, oclusão intestinal ou volvo de sigmoide.
inchaço ao redor do local de inoculação
Evidência específica de fase aguda da doença. Relacionada à transmissão vetorial. Geralmente conhecido como chagoma de inoculação. É uma área em que o parasita entrou através da pele ou da membrana mucosa.
O sinal de Romaña (complexo oftalmoganglionar) ocorre quando o local de inoculação é a conjuntiva, apresentando edema periocular unilateral. Este sinal se correlaciona com nódulo inflamatório subcutâneo ou edema palpebral unilateral não purulento e com conjuntivite com linfadenopatia pré-auricular regional ipsilateral.
Chagoma e sinal de Romaña são patognomônicos, mas só ocorrem em uma minoria de pacientes.[2][Figure caption and citation for the preceding image starts]: Criança apresentando chagoma de inoculação (sinal de Romaña)Grupo de Estudo em Correlação Anátomo-Clínica, Clínica Médica, Pontifícia Universidade Católica de Campinas, São Paulo, Brasil (uso autorizado) [Citation ends].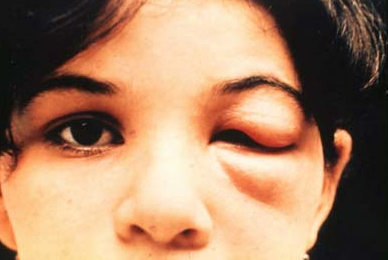
icterícia
Pode estar presente em pacientes na fase aguda da doença após ingestão de alimentos ou bebidas contaminados.
dor à descompressão brusca abdominal
Pode estar presente na fase crônica da doença. Presença de sinais de emergência gastrointestinal, como isquemia intestinal ou volvo.
evidência clínica de irritação meníngea
Ocorre em casos de meningoencefalite (na fase aguda, em neonatos ou na reativação).
sinais clínicos de lesão na massa cerebral
Ocorre em casos de meningoencefalite (na fase aguda, recém-nascidos ou reativação) e está associado ao AVC cardioembólico em pacientes com doença em fase crônica e comprometimento cardíaco.
Outros fatores diagnósticos
comuns
irritabilidade
Pode estar presente em crianças na fase aguda da doença.
anorexia ou fadiga
Pode estar presente na fase aguda da doença.
vômitos ou diarreia
Pode estar presente na fase aguda da doença.
cefaleia
Pode estar presente na fase aguda da doença.
mialgia
Pode estar presente na fase aguda da doença.
tolerância reduzida ao esforço
Pode ser sintoma de insuficiência cardíaca congestiva após cardiopatia induzida pela doença de Chagas.
tontura
Na fase crônica, pode ser sinal de cardiopatia (doença do sistema de condução ou arritmias).
fenômenos tromboembólicos (por exemplo, acidente vascular cerebral, embolia pulmonar)
Podem estar presentes na fase crônica da doença como um sinal de cardiopatia.
Incomuns
dispneia
Pode ser sintoma de insuficiência cardíaca congestiva após cardiopatia induzida pela doença de Chagas.
tosse
Pode estar presente na fase aguda da doença como sinal de miocardite aguda.
edema generalizado
Pode estar presente como sinal de insuficiência cardíaca congestiva.
pericardite
Pode estar presente na fase aguda da doença como sinal de miocardite aguda.
dor epigástrica e/ou hematêmese
Na fase aguda, pode estar relacionada com a ingestão de alimentos ou bebidas contaminados.
melena ou hematoquezia
Na fase aguda, pode estar relacionada com a ingestão de alimentos ou bebidas contaminados.
erupção cutânea
Pode estar presente na fase aguda da doença. Sinal inespecífico caracterizado por erupção cutânea de localização variável, acompanhada ou não de prurido.
convulsões ou tremores
Podem ocorrer na meningoencefalite na fase aguda. Indica prognóstico desfavorável.
Fatores de risco
Fortes
pessoas que residem em áreas endêmicas
A doença de Chagas é endêmica em 21 países latino-americanos, e estima-se que 6-7 milhões de pessoas no mundo todo sejam infectados com Trypanosoma cruzi, incluindo 300,000 pessoas que residem nos EUA e 80,000 na Espanha.[11][27] Também foram relatados residentes infectados na Suíça, França, Itália, Canadá, Austrália e Japão.[2]
exposição a espécies de Triatoma
Os triatomíneos se escondem nos ninhos ou locais de repouso de animais silvestres. Eles se alimentam de sangue enquanto o animal está dormindo (ciclo silvático). As atividades humanas eventualmente podem expor os seres humanos a estes insetos. Algumas dessas espécies de insetos se adaptaram a moradias humanas, onde se escondem em fendas, saindo à noite para o seu repasto sanguíneo (ciclo doméstico). A distribuição de reservatórios humanos (silváticos ou domesticados) em habitats diferentes permite a avaliação do provável local de transmissão, indicando os possíveis riscos de transmissão vetorial e oral.[12][44][45][75]
A transmissão clássica ocorre mediante vetores que se escondem em casas de sapé ou taipa.[76] Estudos demonstraram que as populações de vetores ainda são abundantes e prevalecem altamente em moradias rurais precárias.[77][78] Estima-se que condições heterogêneas de habitat afetem os parâmetros populacionais dos triatomíneos, a dispersão, o controle e a infecção pelo Trypanosoma cruzi. A presença de animais domésticos aumenta a colonização das casas, dificultando ainda mais o controle.[79][80]
condição socioeconômica baixa
A doença de Chagas é uma condição evitável que afeta principalmente populações de baixa renda ou que viviam anteriormente em áreas rurais de regiões endêmicas. Da mesma forma que várias outras infecções parasitárias, ela está correlacionada com a pobreza e com um nível educacional baixo, tanto nas áreas endêmicas quanto nas não endêmicas.[32][79][81][82]
consumo de alimentos ou bebidas contaminados
A falta de higiene no preparo de alimentos pode causar a ingestão acidental de fezes de triatomíneos ou de estruturas dos triatomíneos. Algumas espécies de marsupiais (espécie Didelphis) podem abrigar e excretar o Trypanosoma cruzi nas glândulas anais, causando a contaminação de alimentos e/ou utensílios. Algumas frutas (por exemplo, açaí, juçara, bacaba e cana-de-açúcar) são contaminadas com frequência, já que os vetores e os animais silváticos compartilham este habitat. Os seres humanos são infectados após beberem o suco dessas frutas.[9]
transfusão sanguínea
Nos países latino-americanos mais endêmicos, os doadores de sangue são submetidos a triagens de rotina quanto à doença de Chagas.[28][83] Entretanto, a migração em massa da América Latina para cidades dos EUA aumentou o número de indivíduos infectados nos EUA.[84] O primeiro caso relatado de transmissão relacionada a transfusão nos EUA ocorreu em 1987, porém o rastreamento para Trypanosoma cruzi em sangue doado só começou a ser praticado amplamente no país a partir de 2007.[85] Os bancos de sangue registraram pelo menos 2300 doadores de sangue infectados nos EUA até dezembro de 2017.[11] O risco de transmissão oscila entre 12% e 44% com uma transfusão única de 500 mL de sangue infectado.[86][87] Esse risco depende de vários fatores, como o grau de parasitemia do doador, o tipo de componente sanguíneo transfundido e a cepa do parasita.[85][88][89]
transplante de órgãos
O transplante expõe o receptor a um risco adicional de doença de Chagas devido à imunossupressão induzida. Houve relatos de infecção após transplante de fígado, medula óssea, rim ou coração.[21][90][91][92][93][94][95] Além disso, também pode ocorrer doença aguda após transplante de medula óssea.[15][96][97][98][99][100]
história de imunossupressão
Os pacientes que apresentam imunossupressão (adquirida ou induzida) em associação com a doença de Chagas crônica podem desenvolver uma síndrome de reativação típica.
mudanças climáticas
Prevê-se que as mudanças climáticas afetem as populações de triatomíneos que habitam as áreas circundantes de habitações domésticas de forma muito mais intensa que irão afetar as populações de insetos domésticos.[80][101][102][103] Isso afetará os ecossistemas que influenciam a dinâmica do ciclo silvático: os seus ecossistemas forem destruídos, os insetos vetores (silváticos) procurarão fontes alternativas de sangue e, consequentemente, adaptar-se a novos ambientes próximos de moradias humanas.[102]
Fracos
técnicos de laboratório
Em contextos laboratoriais, há relatos de contaminação através de agulhas contaminadas, exposição a fezes de insetos triatomíneos, manuseio de culturas infecciosas, além da possibilidade da contaminação por inalação.[106] A taxa de acidentes de laboratório reconhecidos por indivíduo de alto risco por ano foi estimada em 1 acidente a cada 15 pessoas-ano, enquanto as contaminações por indivíduo de alto risco por ano foram estimadas em uma contaminação a cada 46 pessoas-ano.[57] Dependendo da natureza do acidente, o risco individual pode ser baixo ou elevado.
viagens a regiões endêmicas
Viajar para áreas rurais em regiões endêmicas representa um risco extremamente baixo de aquisição da doença de Chagas.[86][107][108][109][110][111][112] Não foram documentados quaisquer casos de infecção adquirida durante viagens; no entanto, os viajantes podem estar em risco se permanecerem em habitações de má qualidade em áreas reconhecidamente endêmicas.[86]
mãe chagásica
A transmissão vertical (de mãe para filho) ocorre principalmente no terceiro mês de gestação. O risco de transmissão da mãe infectada para o filho oscila entre 0% e 8%.[43][113][114][115][116][117][118] Em virtude da migração humana, a transmissão vertical também pode ocorrer em regiões não endêmicas. Evidências sugerem que cerca de 0.3% das mulheres latinas grávidas em Houston (Texas, EUA) apresentam sorologia positiva para Chagas.[119]
O uso deste conteúdo está sujeito ao nosso aviso legal