Abordagem
O câncer esofágico tipicamente se apresenta tardiamente, o que, em parte, contribui para o prognóstico geralmente desfavorável. Os médicos precisam permanecer vigilantes e investigar os pacientes por completo para determinar o diagnóstico na primeira oportunidade possível.
Características clínicas
Os sinais de apresentação mais comuns do câncer esofágico são a disfagia e a odinofagia. Para os pacientes com esôfago de Barrett e adenocarcinoma do esôfago e da junção gastroesofágica em estádio precoce, o refluxo é o primeiro sinal mais comum. Geralmente ocorre intensa perda de peso após o início das dificuldades de deglutição.[87]
O comprometimento do nervo frênico pode desencadear soluços. Uma tosse pós-prandial ou paroxística pode indicar a presença de uma fístula traqueoesofágica ou broncoesofágica resultante de invasão local por um tumor.
Investigações iniciais
Embora um paciente que observe disfagia seja frequentemente avaliado primeiro por videoesofagograma, se houver suspeita de câncer esofágico, uma endoscopia digestiva alta é necessária.[88][Figure caption and citation for the preceding image starts]: Imagem endoscópica de câncer esofágicoAcervo pessoal de Mark J. Krasna [Citation ends].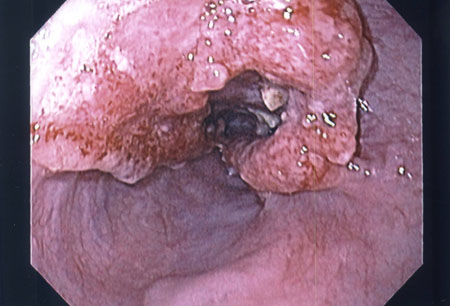 Isso permite a avaliação de qualquer obstrução e biópsia, para confirmar a histologia das lesões da mucosa. O número mínimo recomendado de biópsias não está definido, mas a convenção aceita é obter ≥6 biópsias representativas da lesão.[88] O tipo de tumor histológico deve ser relatado de acordo com os critérios da Organização Mundial da Saúde (OMS).[1] A diferenciação entre carcinoma de células escamosas esofágico (CCEO) e adenocarcinoma esofágico (ACE) é de relevância clínica e prognóstica. A coloração imuno-histoquímica é recomendada nos cânceres pouco diferenciados ou não diferenciados, quando não for possível diferenciar entre o CCEO e o ACE usando-se as características morfológicas.[88] Os tipos de tumor menos comuns, como tumores neuroendócrinos, linfomas, tumores mesenquimais, melanomas e tumores secundários devem ser identificados separadamente do CCEO e do ACE.[88]
Isso permite a avaliação de qualquer obstrução e biópsia, para confirmar a histologia das lesões da mucosa. O número mínimo recomendado de biópsias não está definido, mas a convenção aceita é obter ≥6 biópsias representativas da lesão.[88] O tipo de tumor histológico deve ser relatado de acordo com os critérios da Organização Mundial da Saúde (OMS).[1] A diferenciação entre carcinoma de células escamosas esofágico (CCEO) e adenocarcinoma esofágico (ACE) é de relevância clínica e prognóstica. A coloração imuno-histoquímica é recomendada nos cânceres pouco diferenciados ou não diferenciados, quando não for possível diferenciar entre o CCEO e o ACE usando-se as características morfológicas.[88] Os tipos de tumor menos comuns, como tumores neuroendócrinos, linfomas, tumores mesenquimais, melanomas e tumores secundários devem ser identificados separadamente do CCEO e do ACE.[88]
A endoscopia pode identificar causas benignas de sintomas obstrutivos, além de permitir uma oportunidade para dilatação e o alívio imediato dos sintomas.
Investigações laboratoriais
Devem ser realizados testes de eletrólitos séricos e da função renal em casos avançados com obstrução esofágica completa ou quase completa. Esses pacientes podem apresentar grave depleção de volume e hipocalemia em virtude de sua incapacidade de deglutir líquidos e sua própria saliva rica em potássio.
Estadiamento e prognóstico:
Com frequência, a tomografia computadorizada (TC) do tórax e abdome é realizada se a suspeita de câncer esofágico for alta ou se a biópsia confirmar o diagnóstico.[89] A obtenção de uma tomografia por emissão de pósitrons com 2-flúor-2-desoxi-D-glucose (FDG-PET) e de uma ultrassonografia endoscópica (USE) constituem a base de um estadiamento clínico preciso.
A USE permite avaliar a profundidade da infiltração tumoral na ou através da parede esofágica (estádio T), e avalia qualquer doença nodal locorregional preocupante. A doença metastática, quando presente, ocorre frequentemente nos pulmões, fígado, peritônio e/ou ossos, e é melhor visualizada à PET-CT. A disseminação linfonodal ocorre tipicamente para os linfonodos mediastinais regionais, linfonodos celíacos, linfonodos para-aórticos e cadeia cervical. Em alguns países, a ultrassonografia abdominal é utilizada em vez da TC para diagnosticar metástases para o fígado ou para os linfonodos celíacos.
As lesões T1 e T2 geralmente mostram uma espessura da massa esofágica entre 5 mm e 15 mm, e as lesões T3 mostram uma espessura >15 mm. As lesões T4 mostram a invasão das estruturas contíguas na TC ou na USE. Essa suspeita ocorre ocasionalmente em virtude da presença de "contato" entre o esôfago e as estruturas que o cercam, como as vias aéreas e os grandes vasos. Em geral, um contato com a aorta de mais de 90 graus de circunferência é considerado suspeito para doença T4 e invasão.[90]
Tomografia computadorizada (TC)
A TC desempenha uma função importante na avaliação da massa tumoral e no monitoramento da resposta do tumor à terapia. A TC pode definir se o tumor se espalhou do esôfago para os linfonodos regionais e/ou estruturas adjacentes e pode indicar a presença de metástases à distância.[Figure caption and citation for the preceding image starts]: Tomografia computadorizada (TC) mostrando tumor T3 no nível da veia pulmonarAcervo pessoal de Mark J. Krasna [Citation ends].
Devem ser usados contrastes oral e intravenoso para garantir a opacificação ideal do lúmen e a visualização do coração, dos vasos mediastinais e do fígado.[89] Uma espessura de parede esofágica >5 mm é anormal, independentemente do grau de distensão.
A TC não diferencia com precisão a doença T1a (sem comprometimento da submucosa) e a doença T1b (com comprometimento da submucosa).[91]
Ressonância nuclear magnética (RNM)
A RNM é uma alternativa à TC para o estadiamento do câncer esofágico, particularmente na detecção de doença metastática para órgãos viscerais. Ela é altamente acurada na avaliação do fígado ou das glândulas supra-renais, e para a determinação da disseminação local avançada (T4). Entretanto, ela é menos confiável na definição da infiltração inicial (T1 a T3).
A RNM parece ser sensível para predizer invasão do mediastino; a perda de sinal nos vasos e a traqueia e os brônquios cheios de ar podem fornecer um delineamento claro entre o tumor, a aorta e a árvore traqueobrônquica. De forma semelhante à TC, os exames de RNM são inadequados para a detecção de tumores restritos à mucosa ou à submucosa, e também tendem a fornecer um estadiamento mais baixo aos linfonodos regionais.[92]
tomografia por emissão de pósitrons com 2-flúor-2-desoxi-D-glucose (FDG-PET)
O uso de FDG-PET aumenta a precisão do estadiamento e facilita a seleção dos pacientes para cirurgia, ao detectar doença metastática à distância não identificada por TC isoladamente.[89] A tomografia por emissão de pósitrons (PET) tem uma sensibilidade mais alta que a TC para detectar metástases nodais e à distância, e uma precisão maior que a TC para determinar a possibilidade de ressecção. No entanto, há uma taxa alta de achados falso-positivos na FDG-PET, e pequenas metástases nodais locorregionais (<8 mm) não podem ser identificadas de maneira confiável pela tecnologia atual de PET.[15][93]
A PET pode ser usada para detectar respostas à quimioterapia e à radioterapia.[94][95][96] Em pacientes com câncer esofágico, alterações relativas na captação de FDG podem predizer a resposta à terapia neoadjuvante.[97][98][Figure caption and citation for the preceding image starts]: Tomografia por emissão de pósitrons (PET) mostrando câncer esofágico na junção gastroesofágica. Observe o depósito metastático no fêmur esquerdoAcervo pessoal de Mark J. Krasna [Citation ends].
Geralmente, é realizada a FDG-PET antes da USE para evitar exames desnecessários em pacientes com doença metastática.[99]
Ultrassonografia endoscópica (USE) ± aspiração com agulha fina (AAF)
A USE combinada à AAF (USE/AAF) é a modalidade de exame de imagem mais precisa para o estadiamento locorregional de câncer esofágico antes da terapia. A precisão geral da USE/AAF nesse caso é de 87%; o número para USE isolada é 74%.[100][101]
A precisão da USE no especificidade do câncer esofágico avançado parece ser maior, em comparação com o câncer em estádio inicial (sensibilidade e especificidade da USE para o estadiamento do câncer esofágico: 81.6% e 99.4% em tumores T1; 81.4% e 96.3% em tumores T2; 91.4% e 94.4% em tumores T3; e 92.4% e 97.4% em tumores T4, respectivamente).[102] Evidências de comprometimento de linfonodos patologicamente comprovadas por USE/AAF serão consideradas definitivas, e o paciente poderá ser encaminhado para a terapia estádio-específica adequada.
O reestadiamento da USE subsequente à terapia neoadjuvante não tem precisão.[103][104] Acredita-se que seja uma função da distorção da arquitetura da parede esofágica, em decorrência da fibrose e da ulceração induzidas pelo tratamento.
Doença residual nodal após a terapia neoadjuvante é um achado ameaçador. USE/AAF pode ter um papel, mas isso pode precisar de amostragem de todos os nódulos visíveis, independente dos critérios de suspeita.[105][Figure caption and citation for the preceding image starts]: Aspiração com agulha fina de linfonodo orientada por ultrassonografia endoscópicaAcervo pessoal de Mark J. Krasna [Citation ends].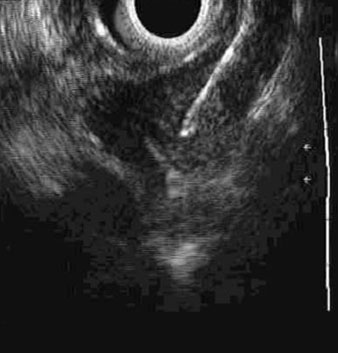
Os achado da USE que indicam que um tumor não pode ser removido incluem a invasão do átrio esquerdo, da parede da aorta descendente, do corpo vertebral, da veia ou artéria pulmonar ou do sistema traqueobrônquico. Esta última deverá ser confirmada por broncoscopia com aspiração com agulha fina (AAF) transbrônquica. A estenose pode limitar a utilidade clínica da USE.[106]
As complicações da USE (com ou sem AAF) incluem perfuração (0.02% a 0.08%), hemorragia (0.13% a 0.69%) e infecção (0.4% a 1.7%).[107]
Broncoscopia
Nos pacientes com doença dos terços médio e superior do esôfago, a broncoscopia com biópsia, com AAF, ou escovados, pode ser útil na determinação do comprometimento da árvore traqueobrônquica. A broncoscopia deve ser realizada antes de se considerar a cirurgia nos tumores nessas localizações.
A AAF pode ser realizada em lesões de mucosa no interior do lúmen ou de forma transbrônquica em lesões adjacentes às vias aéreas.[Figure caption and citation for the preceding image starts]: Invasão traqueal (T4) confirmada por broncoscopiaAcervo pessoal de Mark J. Krasna [Citation ends].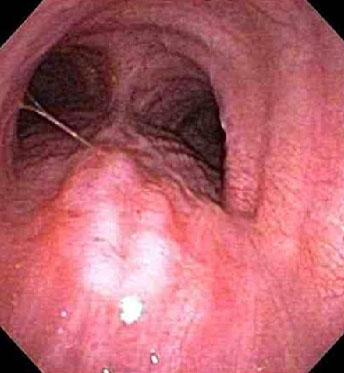
Toracoscopia/laparoscopia
O estadiamento toracoscópico ou laparoscópico raramente é necessário, mas pode ser apropriado em pacientes selecionados; por exemplo, aqueles com adenocarcinoma do esôfago ou da junção gastroesofágica com extensão significativa para a cárdia.[108] As diretrizes da European Society for Medical Oncology (ESMO) recomendam a laparoscopia nos pacientes com adenocarcinomas da junção gastroesofágica localmente avançados (T3/4) para descartar metástases peritoneais1 (as quais são encontradas em aproximadamente 15% dos pacientes). Os tumores que se estendem por mais de 4 cm além da junção gastroesofágica têm um risco particular para doença peritoneal. O achado de metástases desconhecidas pode poupar os pacientes de serem submetidos a cirurgias fúteis.[88] Estudos indicam que a toracoscopia e a laparoscopia podem melhorar a acurácia em comparação com exames não invasivos nessas situações.[109][110]
Exame clínico da região da cabeça e pescoço
Um exame clínico qualificado da região da cabeça e pescoço é recomendado nos pacientes com CCEO para descartar segundos tumores primários de cabeça e pescoço (STPCPs) concomitantes. A prevalência combinada de STPCPs em pacientes com CCEO é de 6.7%, e o prognóstico de pacientes com STPCP adicional é mais desfavorável que para pacientes com apenas CCEO. A detecção precoce de STPCPs pode melhorar o desfecho para os pacientes com CCEO.[88]
Testes moleculares e patológicos
Devem ser realizados no diagnóstico para determinar a adequação para as terapias direcionadas ou a imunoterapia.
Todos os pacientes recém-diagnosticados devem ser testados para instabilidade de microssatélite (IMS) ou deficiência no reparo de erro de pareamento (dMMR). O teste do ligante de morte celular programada 1 (PD-L1) é recomendado nas pessoas com câncer esofágico avançado ou metastático.
A testagem para IMS e dMMR é realizada no tecido fixado em formalina ou embebido com parafina. O status para IMS é avaliado por reação em cadeia da polimerase ou sequenciamento de última geração para medir os níveis de expressão gênica dos marcadores de microssatélites (BAT25, BAT26, MONO27, NR21, NR24). A deficiência de MMR é avaliada por imuno-histoquímica para analisar a expressão nuclear das proteínas envolvidas no reparo de erros de pareamento de DNA (MLH1, MSH2, MSH6, PMS2).[15] Os resultados são interpretados como IMS alta ou deficiência de MMR (dMMR), de acordo com as diretrizes para relatos de biomarcadores de reparo de erro de pareamento de DNA do College of American Pathologists (CAP).[111]
Um ensaio qualitativo de coloração imuno-histoquímica é usado para detectar os níveis de proteína PD-L1 no tecido tumoral fixado em formalina ou embebido com parafina. O escore positivo combinado (CPS) é usado para avaliar se a amostra é considerada como tendo expressão de PD-L1. O CPS é determinado pelo número de células com coloração de PD-L1 (isto é, células tumorais, linfócitos, macrófagos) dividido pelo número total de células tumorais viáveis avaliadas, multiplicado por 100. Um CPS ≥1 indica que a amostra tem expressão de PD-L1.[15][112] Uma alternativa é o escore de proporção tumoral (TPS): ele avalia a porcentagem de células tumorais viáveis, mostrando coloração parcial ou total da membrana em qualquer intensidade (a positividade para PD-L1 é definida como um TPS ≥1%).[88] O TPS só é usado na tomada de decisão clínica para o carcinoma de células escamosas metastáticas (com base no CheckMate 648), em que o CPS é usado no adenocarcinoma esofágico e juncional e no carcinoma de células escamosas.[113]
Todos os pacientes com ACE localmente avançado, recidivante ou metastático inoperável devem ter o status receptor tipo 2 do fator de crescimento epidérmico humano (HER2) determinado ao diagnóstico, pois os pacientes positivos para HER2 se beneficiam com a adição de trastuzumabe à quimioterapia paliativa de primeira linha.[15][114] O direcionamento ao HER2 não é uma prática de rotina nos cenários de doença em estágio inicial e, consequentemente, estabelecer a situação para HER2 não afeta o tratamento clínico fora do contexto dos ensaios clínicos. As taxas relatadas de positividade para HER2 no câncer esofágico variam muito (2% a 45%) e são observadas com mais frequência no adenocarcinoma (15% a 30%) que no carcinoma de células escamosas (5% a 13%).[15]
[Figure caption and citation for the preceding image starts]: Carcinoma esofágico queratinizante moderadamente diferenciadoWikimedia: Néfron https://creativecommons.org/licenses/by-sa/3.0/deed.en [Citation ends].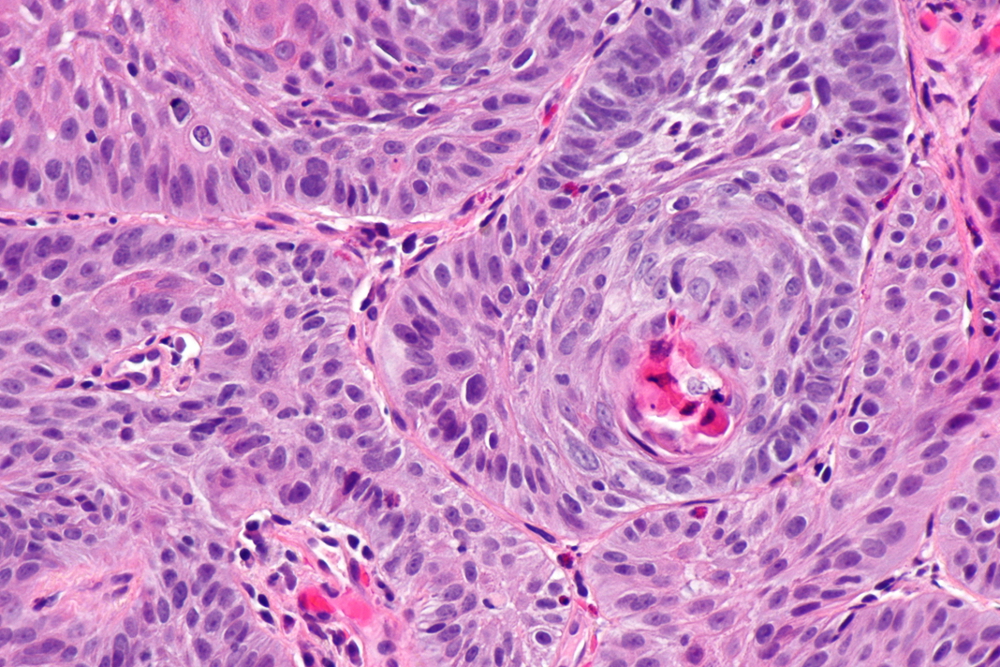 [Figure caption and citation for the preceding image starts]: Adenocarcinoma (à esquerda da imagem) demonstrando aparência glandular com numerosas células mitóticas e tamanho e forma variáveis do núcleo. O epitélio escamoso normal é visível à direita da imagemWikimedia: Néfron https://creativecommons.org/licenses/by-sa/3.0/deed.en [Citation ends].
[Figure caption and citation for the preceding image starts]: Adenocarcinoma (à esquerda da imagem) demonstrando aparência glandular com numerosas células mitóticas e tamanho e forma variáveis do núcleo. O epitélio escamoso normal é visível à direita da imagemWikimedia: Néfron https://creativecommons.org/licenses/by-sa/3.0/deed.en [Citation ends].
Recomenda-se o teste de claudina 18.2 (CLDN18.2) para pacientes com adenocarcinoma esofágico ou da junção gastroesofágica localmente avançado, recorrente ou metastático irressecável, confirmado ou suspeito, para os quais o tratamento com o anticorpo monoclonal CLDN18.2 está sendo considerado.[15]
Biópsia líquida
A biópsia líquida envolve avaliar o DNA tumoral circulante por meio de um exame de sangue. Ela é usada para detectar mutações no DNA provenientes do câncer esofágico, o que ajuda a identificar alterações que podem ser alvos dos tratamentos disponíveis. Ela tem sido usada com mais frequência nos pacientes com doença metastática ou avançada, especialmente naqueles que não podem ser submetidos a biópsias clínicas para a vigilância e o tratamento da doença. Um resultado negativo não descarta a presença de mutações ou amplificações tumorais e, assim, deve ser interpretado com precaução.[15]
Avaliação pré-operatória
Em geral, o tratamento do carcinoma esofágico locorregional requer terapia intensiva tipicamente com uma combinação de quimiorradiação de indução (ou quimioterapia isolada) seguida por cirurgia. No entanto, muitos pacientes apresentam doença avançada e comorbidades que podem afetar a adequação desta via de tratamento.
Testes de função pulmonar (TFPs) são essenciais para determinar a capacidade do paciente em suportar a terapia combinada. Em pacientes com maus resultados no TFP, uma abordagem cirúrgica menos invasiva, como a esofagectomia abdominocervical (trans-hiatal) sem toracotomia, pode estar associada a morbidade e mortalidade menores.
O risco cardíaco é avaliado pela prova de esforço e ecocardiograma.
O estado nutricional e a história de perda de peso devem ser avaliados, e deve ser oferecido suporte nutricional a todos os pacientes, tanto no cenário curativo quanto no cenário paliativo. Mais de 50% dos pacientes perdem >5% do peso corporal antes da internação para esofagectomia, e 40% dos pacientes perdem >10%. A perda de peso (independentemente do índice de massa corporal) está associada com maior risco operatório, redução da qualidade de vida e sobrevida desfavorável na doença avançada.[88] A European Society for Medical Oncology (ESMO) recomenda usar as diretrizes da European Society for Clinical Nutrition and Metabolism (ESPEN) para auxiliar na avaliação e no tratamento.[88][115] A correção da desnutrição pode ser necessária antes de se iniciar a terapia com intenção de cura. Embora a função de deglutição geralmente melhore após a terapia de indução, os níveis de perda de peso e desnutrição à apresentação devem ser abordados precocemente com alimentação enteral, normalmente com colocação de sonda de gastrostomia ou jejunostomia para alimentação.[88]
Deve-se perguntar sobre a prática de exercícios; a redução da atividade física está associada a desfechos mais desfavoráveis após o tratamento perioperatório, e a menor aptidão física é um preditor negativo de sobrevida em longo prazo no câncer esofágico. Um programa de exercícios supervisionado mostrou melhorar a aptidão cardiorrespiratória e alguns aspectos da qualidade de vida em pacientes submetidos a esofagectomia, e é recomendado pelas diretrizes europeias.[88]
O uso deste conteúdo está sujeito ao nosso aviso legal