O diagnóstico de fase blástica de leucemia mieloide crônica (LMC) exige a presença do cromossomo Filadélfia (uma mutação genética que resulta no gene de fusão BCR::ABL1 oncogênico) em caso de agravamento da leucocitose e aumento do número de células blásticas.
Quadros clínicos
As queixas comuns da LMC na fase blástica são anemia, infecções, sangramento anormal/excessivo, dor óssea ou sintomas constitucionais (sudorese noturna, perda de peso, febre). Outros sinais e sintomas incluem esplenomegalia avançada, dor abdominal, lesões cutâneas, saciedade precoce, dor no ombro, anorexia, dor nas articulações, fadiga, petéquias, facilidade para adquirir hematomas e alterações visuais.
Raramente, a doença pode se manifestar como hemorragias retinianas (alterações visuais) ou hiperviscosidade.[6]Ali E, Soliman A, De Sanctis V, et al. Priapism in patients with chronic myeloid leukemia (CML): a systematic review. Acta Biomed. 2021 Jul 1;92(3):e2021193.
https://mattioli1885journals.com/index.php/actabiomedica/article/view/10796
http://www.ncbi.nlm.nih.gov/pubmed/34212918?tool=bestpractice.com
[7]Emerson G, Kaide CG. Rapid fire: acute blast crisis/hyperviscosity syndrome. Emerg Med Clin North Am. 2018 Aug;36(3):603-8.
http://www.ncbi.nlm.nih.gov/pubmed/30037446?tool=bestpractice.com
As características clínicas de hiperviscosidade incluem zumbido, AVC, priapismo, confusão e estupor.[7]Emerson G, Kaide CG. Rapid fire: acute blast crisis/hyperviscosity syndrome. Emerg Med Clin North Am. 2018 Aug;36(3):603-8.
http://www.ncbi.nlm.nih.gov/pubmed/30037446?tool=bestpractice.com
[8]Kirwin M, Yee J. Blast crisis. J Educ Teach Emerg Med. 2020 Apr;5(2):S55-77.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10332564
http://www.ncbi.nlm.nih.gov/pubmed/37465412?tool=bestpractice.com
[9]Stone MJ, Bogen SA. Evidence-based focused review of management of hyperviscosity syndrome. Blood. 2012 Mar 8;119(10):2205-8.
https://ashpublications.org/blood/article/119/10/2205/29515/Evidence-based-focused-review-of-management-of
http://www.ncbi.nlm.nih.gov/pubmed/22147890?tool=bestpractice.com
Exames laboratoriais iniciais
O hemograma completo com contagem diferencial é o exame laboratorial inicial.[2]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: chronic myeloid leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
Devem ser solicitados a pacientes com fadiga, febre e/ou doenças hemorrágicas, com ou sem história de LMC. Citopenias e a presença de blastos fornecem pistas para o diagnóstico. Estas devem levar a esfregaço do sangue periférico e exame da medula óssea.[Figure caption and citation for the preceding image starts]: Seta: células blásticas de leucemia mieloide crônica com neutrófilos em vários estágios de maturaçãoDr. Bruce Villas, Departamento de Patologia, Faculdade de Medicina da Universidade de Flórida, Jacksonville, FL, usado com permissão [Citation ends].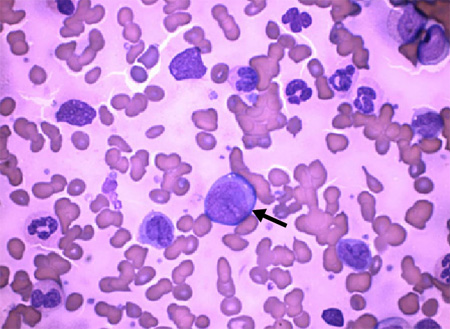
O diagnóstico de crise blástica é confirmado por:[1]Khoury JD, Solary E, Abla O, et al. The 5th edition of the World Health Organization classification of haematolymphoid tumours: myeloid and histiocytic/dendritic neoplasms. Leukemia. 2022 Jul;36(7):1703-19.
https://www.nature.com/articles/s41375-022-01613-1
http://www.ncbi.nlm.nih.gov/pubmed/35732831?tool=bestpractice.com
[2]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: chronic myeloid leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
[29]Cortes JE, Talpaz M, O'Brien S, et al. Staging of chronic myeloid leukemia in the imatinib era: an evaluation of the World Health Organization proposal. Cancer. 2006 Mar 15;106(6):1306-15.
https://acsjournals.onlinelibrary.wiley.com/doi/10.1002/cncr.21756
http://www.ncbi.nlm.nih.gov/pubmed/16463391?tool=bestpractice.com
[30]Arber DA, Orazi A, Hasserjian RP, et al. International consensus classification of myeloid neoplasms and acute leukemias: integrating morphologic, clinical, and genomic data. Blood. 2022 Sep 15;140(11):1200-28.
https://ashpublications.org/blood/article/140/11/1200/485730/International-Consensus-Classification-of-Myeloid
http://www.ncbi.nlm.nih.gov/pubmed/35767897?tool=bestpractice.com
[31]Baccarani M, Deininger MW, Rosti G, et al. European LeukemiaNet recommendations for the management of chronic myeloid leukemia: 2013. Blood. 2013 Aug 8;122(6):872-84.
https://ashpublications.org/blood/article/122/6/872/32231/European-LeukemiaNet-recommendations-for-the
http://www.ncbi.nlm.nih.gov/pubmed/23803709?tool=bestpractice.com
a porcentagem de blastos no sangue periférico e/ou medula óssea (ou seja, ≥20% ou ≥30% dependendo dos critérios utilizados), ou
a presença de uma proliferação extramedular de blastos.
Após a introdução da terapia com inibidor de tirosina quinase (TKI), muitos ensaios clínicos empregam os critérios do MD Anderson Cancer Center (MDACC) ou do International Bone Marrow Transplant Registry (blastos ≥30%).[2]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: chronic myeloid leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
Os critérios do MDACC e os critérios do International Bone Marrow Transplant Registry são preferenciais na prática clínica. Consulte Critérios.
Exame para cromossomo Filadélfia e BCR::ABL1
O teste citogenético do cromossomo Filadélfia deve ser realizado para confirmar a LMC se não tiver sido diagnosticada previamente.[2]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: chronic myeloid leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
[3]Smith G, Apperley J, Milojkovic D, et al; British Society for Haematology. A British Society for Haematology guideline on the diagnosis and management of chronic myeloid leukaemia. Br J Haematol. 2020 Oct;191(2):171-93.
https://onlinelibrary.wiley.com/doi/10.1111/bjh.16971
http://www.ncbi.nlm.nih.gov/pubmed/32734668?tool=bestpractice.com
Vários testes são empregados durante a avaliação inicial e no acompanhamento.
Aspiração e biópsia da medula óssea: necessárias para análise citogenética (cariotipagem) para estabelecer a presença do cromossomo Filadélfia e para confirmar a fase (proporção de blastos e basófilos) da LMC.[2]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: chronic myeloid leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
[32]Cross NCP, Ernst T, Branford S, et al. European LeukemiaNet laboratory recommendations for the diagnosis and management of chronic myeloid leukemia. Leukemia. 2023 Nov;37(11):2150-167.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10624636
http://www.ncbi.nlm.nih.gov/pubmed/37794101?tool=bestpractice.com
A citogenética da medula óssea pode detectar anormalidades cromossômicas adicionais (ACAs; também conhecidas como evolução citogenética clonal) em células Ph-positivas e Ph-negativas.[32]Cross NCP, Ernst T, Branford S, et al. European LeukemiaNet laboratory recommendations for the diagnosis and management of chronic myeloid leukemia. Leukemia. 2023 Nov;37(11):2150-167.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10624636
http://www.ncbi.nlm.nih.gov/pubmed/37794101?tool=bestpractice.com
As ACAs podem estar associadas à resistência aos TKI e ao prognóstico desfavorável.[2]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: chronic myeloid leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
Análise molecular usando reação em cadeia da polimerase via transcriptase reversa quantitativa (qRT-PCR) em sangue periférico: deve ser realizada na avaliação inicial para estabelecer a presença de transcrições quantificáveis de RNAm de BCR::ABL1. Os laboratórios devem relatar os resultados da qRT-PCR de acordo com uma escala internacional (EI).[33]Müller MC, Cross NC, Erben P, et al. Harmonization of molecular monitoring of CML therapy in Europe. Leukemia. 2009 Nov;23(11):1957-63.
http://www.ncbi.nlm.nih.gov/pubmed/19710700?tool=bestpractice.com
A qRT-PCR é altamente sensível e é o único método quantitativo de avaliação da resposta molecular à terapia; o monitoramento regular por qRT-PCR é recomendado após o diagnóstico.[2]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: chronic myeloid leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
[32]Cross NCP, Ernst T, Branford S, et al. European LeukemiaNet laboratory recommendations for the diagnosis and management of chronic myeloid leukemia. Leukemia. 2023 Nov;37(11):2150-167.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10624636
http://www.ncbi.nlm.nih.gov/pubmed/37794101?tool=bestpractice.com
Hibridização in situ fluorescente (FISH): realizada em aspirado de medula óssea ou sangue periférico para identificar rearranjos BCR::ABL1. Usada se a avaliação citogenética da medula óssea não for possível ou se os resultados da citogenética e da qRT-PCR forem diferentes. Às vezes, é usada como um teste de rastreamento inicial ou, se a qRT-PCR não estiver disponível, para monitoramento de doenças. A FISH não consegue detectar ACAs.[2]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: chronic myeloid leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
[32]Cross NCP, Ernst T, Branford S, et al. European LeukemiaNet laboratory recommendations for the diagnosis and management of chronic myeloid leukemia. Leukemia. 2023 Nov;37(11):2150-167.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10624636
http://www.ncbi.nlm.nih.gov/pubmed/37794101?tool=bestpractice.com
Exames auxiliares
Deve-se considerar a realização dos seguintes exames.
Perfil de hepatite B: a reativação do vírus da hepatite B foi relatada em pacientes recebendo terapia com TKI. O exame para hepatite B é recomendado antes de iniciar o tratamento com TKI para que a profilaxia antiviral possa ser considerada para pacientes em risco.[2]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: chronic myeloid leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
[34]Atteya A, Ahmad A, Daghstani D, et al. Evaluation of hepatitis B reactivation among patients with chronic myeloid leukemia treated with tyrosine kinase inhibitors. Cancer Control. 2020 Jan-Dec;27(1):1073274820976594.
https://journals.sagepub.com/doi/10.1177/1073274820976594
http://www.ncbi.nlm.nih.gov/pubmed/33297765?tool=bestpractice.com
Citometria de fluxo: pode ser realizada na biópsia da medula óssea (ou, de maneira alternativa, com sangue periférico) para determinar a linhagem celular (por exemplo, mieloide, linfoide ou linhagem mista).[2]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: chronic myeloid leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
[35]Hochhaus A, Saussele S, Rosti G, et al; ESMO Guidelines Committee. Chronic myeloid leukaemia: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017 Jul 1;28(suppl 4):iv41-51.
https://www.annalsofoncology.org/article/S0923-7534(19)42147-9/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/28881915?tool=bestpractice.com
Análises mutacionais: realizadas para identificar mutações associadas à resistência aos TKI. A análise da mutação do domínio quinase BCR::ABL1 (usando sequenciamento de última geração) deve ser realizada em pacientes que evoluíram para crise blástica durante o tratamento com TKI ou que apresentaram resposta inadequada ao tratamento com TKI.[2]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: chronic myeloid leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
[32]Cross NCP, Ernst T, Branford S, et al. European LeukemiaNet laboratory recommendations for the diagnosis and management of chronic myeloid leukemia. Leukemia. 2023 Nov;37(11):2150-167.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10624636
http://www.ncbi.nlm.nih.gov/pubmed/37794101?tool=bestpractice.com
Um painel de mutação mieloide pode ser considerado nos pacientes sem mutações identificadas no domínio quinase BCR::ABL1 para detectar mutações de baixo nível no domínio quinase BCR::ABL1 ou mutações de resistência independentes de BCR::ABL1.[2]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: chronic myeloid leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
[32]Cross NCP, Ernst T, Branford S, et al. European LeukemiaNet laboratory recommendations for the diagnosis and management of chronic myeloid leukemia. Leukemia. 2023 Nov;37(11):2150-167.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10624636
http://www.ncbi.nlm.nih.gov/pubmed/37794101?tool=bestpractice.com
[35]Hochhaus A, Saussele S, Rosti G, et al; ESMO Guidelines Committee. Chronic myeloid leukaemia: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017 Jul 1;28(suppl 4):iv41-51.
https://www.annalsofoncology.org/article/S0923-7534(19)42147-9/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/28881915?tool=bestpractice.com
Teste de HLA1: pode ser realizado precocemente em pacientes elegíveis para transplante de células-tronco, para encontrar um doador compatível mais rápido.[2]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: chronic myeloid leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
[35]Hochhaus A, Saussele S, Rosti G, et al; ESMO Guidelines Committee. Chronic myeloid leukaemia: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017 Jul 1;28(suppl 4):iv41-51.
https://www.annalsofoncology.org/article/S0923-7534(19)42147-9/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/28881915?tool=bestpractice.com
Punção lombar: o líquido cefalorraquidiano deve ser examinado em pacientes com suspeita de envolvimento do sistema nervoso central (SNC). Pacientes com crise blástica linfoide ou bifenotípica devem ser submetidos a punção lombar com profilaxia do SNC.[2]National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: chronic myeloid leukemia [internet publication].
https://www.nccn.org/guidelines/category_1
[3]Smith G, Apperley J, Milojkovic D, et al; British Society for Haematology. A British Society for Haematology guideline on the diagnosis and management of chronic myeloid leukaemia. Br J Haematol. 2020 Oct;191(2):171-93.
https://onlinelibrary.wiley.com/doi/10.1111/bjh.16971
http://www.ncbi.nlm.nih.gov/pubmed/32734668?tool=bestpractice.com
