Mujeres posmenopáusicas
Antes de iniciar la farmacoterapia para la osteoporosis, deben descartarse las causas secundarias de pérdida ósea; se recomienda la farmacoterapia para la osteoporosis posmenopáusica en pacientes con alto riesgo de fractura que cumplan cualquiera de estos criterios:[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
[108]Eastell R, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society* clinical practice guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1595-622.
https://www.endocrine.org/clinical-practice-guidelines/osteoporosis-in-postmenopausal-women
http://www.ncbi.nlm.nih.gov/pubmed/30907953?tool=bestpractice.com
El puntaje T de -2.5 o inferior mediante absorciometría de doble energía (DEXA) del cuello femoral, cadera total, columna lumbar o 33% del radio
Antecedentes de fractura por fragilidad, incluida la fractura vertebral asintomática
Puntaje T entre -1.0 y -2.5 y mayor riesgo de fractura, determinado por una herramienta clínica formal de evaluación del riesgo
Si las pacientes cumplen estos criterios, la consideración del uso de farmacoterapia para la osteoporosis en mujeres posmenopáusicas debe incluir lo siguiente:[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
Tipo de tratamiento
Comienzo del inicio
Duración del tratamiento
Uso de vacaciones farmacológicas para reducir los efectos adversos
Manejo de la pérdida de masa ósea cuando se interrumpe el tratamiento
Momento de reinicio de la terapia
Indicaciones para la derivación a un endocrinólogo u otro especialista en osteoporosis
[Figure caption and citation for the preceding image starts]: Tratamiento de mujeres posmenopáusicas con osteoporosis no inducida por glucocorticoidesCreado por BMJ Knowledge Centre [Citation ends].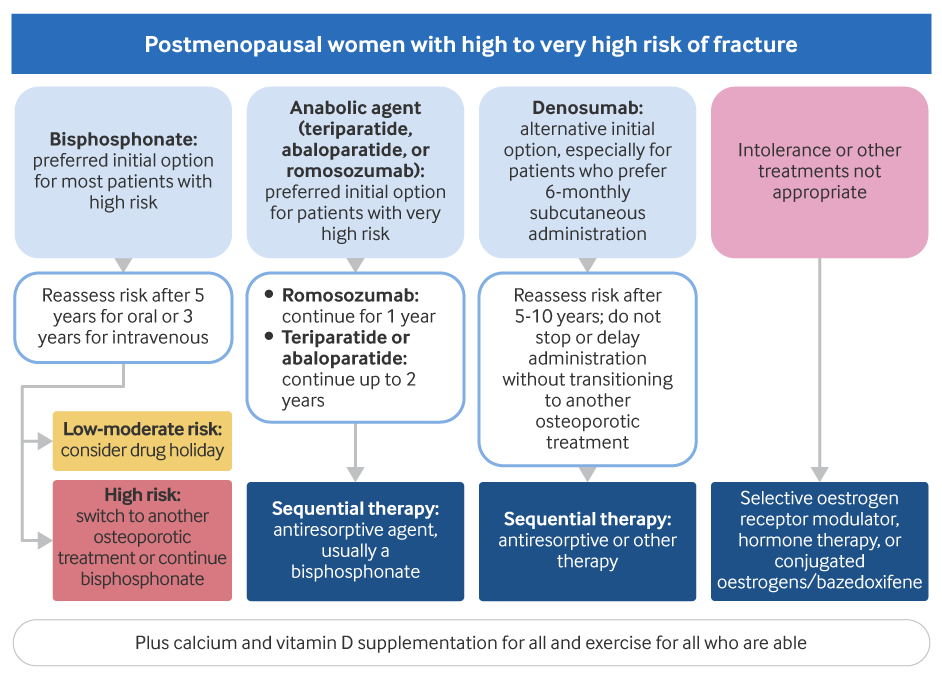
Bifosfonatos
Los bifosfonatos (p. ej., ácido alendrónico, ácido ibandrónico, risedronato y ácido zoledrónico) están indicados para el tratamiento de la osteoporosis en mujeres posmenopáusicas.[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
[109]Rosenberg K. Bisphosphonates likely beneficial for most older women with osteoporosis. Am J Nurs. 2022 Apr 1;122(4):57.
http://www.ncbi.nlm.nih.gov/pubmed/35348523?tool=bestpractice.com
Aumentan eficazmente la DMO y disminuyen el riesgo de fracturas vertebrales y no vertebrales.[110]Bilezikian JP. Efficacy of bisphosphonates in reducing fracture risk in postmenopausal osteoporosis. Am J Med. 2009 Feb;122(2 Suppl):S14-21.
http://www.ncbi.nlm.nih.gov/pubmed/19187808?tool=bestpractice.com
[111]Zhao S, Zhao W, Du D, et al. Effect of bisphosphonate on hip fracture in patients with osteoporosis or osteopenia according to age: a meta-analysis and systematic review. J Investig Med. 2022 Mar;70(3):837-43.
https://journals.sagepub.com/doi/10.1136/jim-2021-001961
http://www.ncbi.nlm.nih.gov/pubmed/34893517?tool=bestpractice.com
Esto es así con la excepción del ácido ibandrónico, que solo ha demostrado disminuir el riesgo de fractura femoral en poblaciones de alto riesgo con una puntuación T de DMO del cuello femoral de -3 o menos mediante análisis post-hoc.[112]Chesnut CH 3rd, Skag A, Christiansen C, et al. Effects of oral ibandronate administered daily or intermittently on fracture risk in postmenopausal osteoporosis. J Bone Miner Res. 2004 Aug;19(8):1241-9.
https://onlinelibrary.wiley.com/doi/full/10.1359/JBMR.040325
http://www.ncbi.nlm.nih.gov/pubmed/15231010?tool=bestpractice.com
Los bifosfonatos son el tratamiento de primera línea para las mujeres posmenopáusicas con alto riesgo de fractura con fracturas previas de cadera o vertebrales y/o un puntaje T de DEXA ≤-2.5. Se recomienda que el tratamiento comience en el momento del diagnóstico.[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
[67]Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, et al. Pharmacologic treatment of primary osteoporosis or low bone mass to prevent fractures in adults: a living clinical guideline from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://www.acpjournals.org/doi/full/10.7326/M22-1034
http://www.ncbi.nlm.nih.gov/pubmed/36592456?tool=bestpractice.com
[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
[108]Eastell R, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society* clinical practice guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1595-622.
https://www.endocrine.org/clinical-practice-guidelines/osteoporosis-in-postmenopausal-women
http://www.ncbi.nlm.nih.gov/pubmed/30907953?tool=bestpractice.com
Los bifosfonatos también se pueden usar para mujeres con un riesgo muy alto de fractura (p. ej., puntuación T muy baja y antecedentes de fracturas vertebrales graves o múltiples, una fractura reciente o múltiples factores de riesgo de fractura), pero las guías de práctica clínica recomiendan el tratamiento inicial con un agente anabólico como la opción preferida para estos pacientes.[67]Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, et al. Pharmacologic treatment of primary osteoporosis or low bone mass to prevent fractures in adults: a living clinical guideline from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://www.acpjournals.org/doi/full/10.7326/M22-1034
http://www.ncbi.nlm.nih.gov/pubmed/36592456?tool=bestpractice.com
[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
[81]Royal Australian College of General Practitioners. Osteoporosis management and fracture prevention in post-menopausal women and men >50 years of age. Mar 2024 [internet publication].
https://www.racgp.org.au/clinical-resources/clinical-guidelines/key-racgp-guidelines/view-all-racgp-guidelines/osteoporosis/executive-summary
[113]Shoback D, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society guideline update. J Clin Endocrinol Metab. 2020 Mar 1;105(3):dgaa048.
https://academic.oup.com/jcem/article/105/3/587/5739968
http://www.ncbi.nlm.nih.gov/pubmed/32068863?tool=bestpractice.com
[114]Tai TW, Chen HY, Shih CA, et al. Asia-Pacific consensus on long-term and sequential therapy for osteoporosis. Osteoporos Sarcopenia. 2024 Mar;10(1):3-10.
https://pmc.ncbi.nlm.nih.gov/articles/PMC11056428
http://www.ncbi.nlm.nih.gov/pubmed/38690538?tool=bestpractice.com
Los bifosfonatos orales reducen el riesgo de fractura en mujeres con fracturas de fragilidad previas.[115]Saito T, Sterbenz JM, Malay S, et al. Effectiveness of anti-osteoporotic drugs to prevent secondary fragility fractures: systematic review and meta-analysis. Osteoporos Int. 2017 Dec;28(12):3289-300.
http://www.ncbi.nlm.nih.gov/pubmed/28770272?tool=bestpractice.com
[116]Lee SY, Jung SH, Lee SU, et al. Can bisphosphonates prevent recurrent fragility fractures? A systematic review and meta-analysis of randomized controlled trials. J Am Med Dir Assoc. 2018 May;19(5):384-90.
http://www.ncbi.nlm.nih.gov/pubmed/29704927?tool=bestpractice.com
Debe considerarse la posibilidad de que los pacientes con un riesgo de fractura de bajo a moderado dejen de tomar el fármaco:[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
Que estén estables tras 5 años de tratamiento con bifosfonatos orales, o
Después de 3 años de tratamiento con ácido zoledrónico.
Para los pacientes con alto riesgo de fractura, se sugiere un tratamiento más prolongado de hasta 10 años con bifosfonatos orales o de hasta 6 años con ácido zoledrónico.[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
Los efectos adversos de los bifosfonatos orales están principalmente relacionados con el tracto gastrointestinal superior e incluyen la dificultad en la deglución, la esofagitis y las úlceras gástricas. También se ha observado dolor articular y muscular, osteonecrosis de la mandíbula y fracturas femorales atípicas.[117]Shane E, Burr D, Abrahamsen B, et al. Atypical subtrochanteric and diaphyseal femoral fractures: second report of a task force of the American Society for Bone and Mineral Research. J Bone Miner Res. 2014 Jan;29(1):1-23.
https://onlinelibrary.wiley.com/doi/full/10.1002/jbmr.1998
http://www.ncbi.nlm.nih.gov/pubmed/23712442?tool=bestpractice.com
[118]Abrahamsen B. Adverse effects of bisphosphonates. Calcif Tissue Int. 2010 Jun;86(6):421-35.
http://www.ncbi.nlm.nih.gov/pubmed/20407762?tool=bestpractice.com
[119]Lee S, Yin RV, Hirpara H, et al. Increased risk for atypical fractures associated with bisphosphonate use. Fam Pract. 2015 Jun;32(3):276-81.
http://fampra.oxfordjournals.org/content/32/3/276.long
http://www.ncbi.nlm.nih.gov/pubmed/25846215?tool=bestpractice.com
[120]Wysowski DK, Chang JT. Alendronate and risedronate: reports of severe bone, joint and muscle pain. Arch Intern Med. 2005 Feb 14;165(3):346-7.
http://www.ncbi.nlm.nih.gov/pubmed/15710802?tool=bestpractice.com
[121]Khan AA, Sándor GK, Dore E, et al. Bisphosphonate associated osteonecrosis of the jaw. J Rheumatol. 2009 Mar;36(3):478-90.
http://www.ncbi.nlm.nih.gov/pubmed/19286860?tool=bestpractice.com
[122]Woo SB, Hellstein JW, Kalmar JR. Narrative [corrected] review: bisphosphonates and osteonecrosis of the jaws. Ann Intern Med. 2006 May 16;144(10):753-61.
http://www.ncbi.nlm.nih.gov/pubmed/16702591?tool=bestpractice.com
Una gran revisión sistemática y metanálisis de más de 650,000 pacientes demostró un mayor riesgo de fracturas atípicas con los bifosfonatos.[119]Lee S, Yin RV, Hirpara H, et al. Increased risk for atypical fractures associated with bisphosphonate use. Fam Pract. 2015 Jun;32(3):276-81.
http://fampra.oxfordjournals.org/content/32/3/276.long
http://www.ncbi.nlm.nih.gov/pubmed/25846215?tool=bestpractice.com
Otras investigaciones concluyeron que los beneficios del tratamiento con bifosfonatos superan el riesgo de fractura atípica de fémur, sobre todo en pacientes tratados durante 3-5 años.[123]Black DM, Abrahamsen B, Bouxsein ML, et al. Atypical femur fractures: review of epidemiology, relationship to bisphosphonates, prevention, and clinical management. Endocr Rev. 2019 Apr 1;40(2):333-68.
https://academic.oup.com/edrv/article/40/2/333/5082430
http://www.ncbi.nlm.nih.gov/pubmed/30169557?tool=bestpractice.com
Está surgiendo un consenso sobre las estrategias para prevenir la fractura atípica de fémur en pacientes tratados con bifosfonatos, incluyendo la suspensión del fármaco tras 5 años de uso en algunos pacientes.[123]Black DM, Abrahamsen B, Bouxsein ML, et al. Atypical femur fractures: review of epidemiology, relationship to bisphosphonates, prevention, and clinical management. Endocr Rev. 2019 Apr 1;40(2):333-68.
https://academic.oup.com/edrv/article/40/2/333/5082430
http://www.ncbi.nlm.nih.gov/pubmed/30169557?tool=bestpractice.com
Ácido alendrónico y risedronato:[124]Barrionuevo P, Kapoor E, Asi N, et al. Efficacy of pharmacological therapies for the prevention of fractures in postmenopausal women: a network meta-analysis. J Clin Endocrinol Metab. 2019 May 1;104(5):1623-30.
https://academic.oup.com/jcem/article/104/5/1623/5418882
http://www.ncbi.nlm.nih.gov/pubmed/30907957?tool=bestpractice.com
[125]Black DM, Schwartz AV, Ensrud KE, et al. Effects of continuing or stopping alendronate after 5 years of treatment: the Fracture Intervention Trial Long-term Extension (FLEX): a randomized trial. JAMA. 2006 Dec 27;296(24):2927-38.
http://jama.jamanetwork.com/article.aspx?articleid=204789
http://www.ncbi.nlm.nih.gov/pubmed/17190893?tool=bestpractice.com
[126]Schwartz AV, Bauer DC, Cummings SR, et al. Efficacy of continued alendronate for fractures in women with and without prevalent vertebral fracture: the FLEX trial. J Bone Miner Res. 2010 May;25(5):976-82.
https://onlinelibrary.wiley.com/doi/10.1002/jbmr.11
http://www.ncbi.nlm.nih.gov/pubmed/20200926?tool=bestpractice.com
[127]Roux C, Seeman E, Eastell R, et al. Efficacy of risedronate on clinical vertebral fractures within six months. Curr Med Res Opin. 2004 Apr;20(4):433-9.
http://www.ncbi.nlm.nih.gov/pubmed/15119979?tool=bestpractice.com
[128]Watts NB, Chines A, Olszynski WP, et al. Fracture risk remains reduced one year after discontinuation of risedronate. Osteoporos Int. 2008 Mar;19(3):365-72.
http://www.ncbi.nlm.nih.gov/pubmed/17938986?tool=bestpractice.com
[129]Watts NB, Diab DL. Long-term use of bisphosphonates in osteoporosis. J Clin Endocrinol Metab. 2010 Apr;95(4):1555-65.
http://www.ncbi.nlm.nih.gov/pubmed/20173017?tool=bestpractice.com
El ácido alendrónico y el risedronato fueron los primeros bifosfonatos aprobados para el tratamiento de la osteoporosis posmenopáusica y siguen estando entre los tratamientos para la osteoporosis más comúnmente recetados. Se ha demostrado que ambos reducen el riesgo de fracturas vertebrales, no vertebrales y de cadera.
En un ensayo de extensión controlado con placebo, las mujeres que continuaron el tratamiento con ácido alendrónico durante 10 años tuvieron un riesgo significativamente menor de fracturas vertebrales clínicamente reconocidas en comparación con aquellas que interrumpieron el tratamiento con ácido alendrónico después de 5 años. El riesgo de fracturas no vertebrales no fue significativamente diferente entre los dos grupos en general, pero un análisis post-hoc encontró que continuar con ácido alendrónico durante 10 años redujo el riesgo de fracturas no vertebrales en un subgrupo de mujeres con una puntuación T de ≤-2.5 y sin fracturas vertebrales después de 5 años de tratamiento. No hubo ningún beneficio de continuar con el ácido alendrónico más allá de 5 años en aquellos con una puntuación T de >-2.0.
El análisis de los ensayos de Eficacia vertebral con terapia con risedronato (VERT) sugiere que el risedronato reduce el riesgo de fracturas vertebrales en los 6 meses posteriores al tratamiento. Los ensayos clínicos respaldan la eficacia sostenida del risedronato durante 5-7 años de tratamiento y un beneficio antifractura continuo durante 1 año después de suspender el tratamiento.
Ácido ibandrónico:[108]Eastell R, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society* clinical practice guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1595-622.
https://www.endocrine.org/clinical-practice-guidelines/osteoporosis-in-postmenopausal-women
http://www.ncbi.nlm.nih.gov/pubmed/30907953?tool=bestpractice.com
[130]Adami S, Felsenberg D, Christiansen C, et al. Efficacy and safety of ibandronate given by intravenous injection once every 3 months. Bone. 2004 May;34(5):881-9.
http://www.ncbi.nlm.nih.gov/pubmed/15121020?tool=bestpractice.com
[131]Stakkestad JA, Benevolenskaya LI, Stepan JJ, et al; Ibandronate Intravenous Study Group. Intravenous ibandronate injections given every three months: a new treatment option to prevent bone loss in postmenopausal women. Ann Rheum Dis. 2003 Oct;62(10):969-75.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1754320
http://www.ncbi.nlm.nih.gov/pubmed/12972476?tool=bestpractice.com
Puede reducir la fractura vertebral, pero sus efectos en la reducción de la fractura de cadera y la fractura no vertebral son inciertos, por lo que no se recomienda para estas indicaciones en las mujeres posmenopáusicas.
El ácido ibandrónico intravenoso ha demostrado ser eficaz para aumentar la DMO en el tratamiento y la prevención de la osteoporosis postmenopáusica.
Ácido zoledrónico:[132]Black DM, Reid IR, Boonen S, et al. The effect of 3 versus 6 years of zoledronic acid treatment of osteoporosis: a randomized extension to the HORIZON-Pivotal Fracture Trial (PFT). J Bone Miner Res. 2012 Feb;27(2):243-54.
https://asbmr.onlinelibrary.wiley.com/doi/full/10.1002/jbmr.1494
http://www.ncbi.nlm.nih.gov/pubmed/22161728?tool=bestpractice.com
[133]Black DM, Reid IR, Cauley JA, et al. The effect of 6 versus 9 years of zoledronic acid treatment in osteoporosis: a randomized second extension to the HORIZON-Pivotal Fracture Trial (PFT). J Bone Miner Res. 2015 May;30(5):934-44.
https://onlinelibrary.wiley.com/doi/full/10.1002/jbmr.2442
http://www.ncbi.nlm.nih.gov/pubmed/25545380?tool=bestpractice.com
[134]Black DM, Delmas PD, Eastell R, et al. Once-yearly zoledronic acid for treatment of postmenopausal osteoporosis. N Engl J Med. 2007 May 3;356(18):1809-22.
https://www.nejm.org/doi/10.1056/NEJMoa067312
http://www.ncbi.nlm.nih.gov/pubmed/17476007?tool=bestpractice.com
[135]Nancollas GH, Tang R, Phipps RJ, et al. Novel insights into actions of bisphosphonates on bone: differences in interactions with hydroxyapatite. Bone. 2006 May;38(5):617-27.
http://www.ncbi.nlm.nih.gov/pubmed/16046206?tool=bestpractice.com
[136]MacLean C, Newberry S, Maglione M, et al. Systematic review: comparative effectiveness of treatments to prevent fractures in men and women with low bone density or osteoporosis. Ann Intern Med. 2008 Feb 5;148(3):197-213.
http://annals.org/article.aspx?articleid=739219
http://www.ncbi.nlm.nih.gov/pubmed/18087050?tool=bestpractice.com
[137]Sharma A, Einstein AJ, Vallakati A, et al. Risk of atrial fibrillation with use of oral and intravenous bisphosphonates. Am J Cardiol. 2014 Jun 1;113(11):1815-21.
http://www.ncbi.nlm.nih.gov/pubmed/24837258?tool=bestpractice.com
[138]Pazianas M, Compston J, Huang CL. Atrial fibrillation and bisphosphonate therapy. J Bone Miner Res. 2010 Jan;25(1):2-10.
https://onlinelibrary.wiley.com/doi/full/10.1359/jbmr.091201
http://www.ncbi.nlm.nih.gov/pubmed/20091928?tool=bestpractice.com
[139]Reid IR, Horne AM, Mihov B, et al. Duration of fracture prevention after zoledronate treatment in women with osteopenia: observational follow-up of a 6-year randomised controlled trial to 10 years. Lancet Diabetes Endocrinol. 2024 Apr;12(4):247-56.
http://www.ncbi.nlm.nih.gov/pubmed/38452783?tool=bestpractice.com
[140]Liu S, Tan Y, Huang W, et al. Cardiovascular safety of zoledronic acid in the treatment of primary osteoporosis: a meta-analysis and systematic review. Semin Arthritis Rheum. 2024 Feb;64:152304.
http://www.ncbi.nlm.nih.gov/pubmed/37984227?tool=bestpractice.com
Un estudio demostró que 6 años de tratamiento con ácido zoledrónico mantenían la DMO, disminuían las fracturas vertebrales y reducían los marcadores de recambio óseo en comparación con 3 años de tratamiento en pacientes con osteoporosis. En un estudio de ampliación, quienes fueron tratados con ácido zoledrónico durante 6 años fueron aleatorizados para continuar con el ácido zoledrónico durante 3 años más o cambiar al placebo. El estudio de extensión no encontró una disminución significativa en el número de fracturas entre los dos grupos. En un seguimiento observacional de mujeres mayores con osteopenia asignadas al azar para recibir ácido zoledrónico o placebo a intervalos de 18 meses durante 6 años, las tasas de fractura reducidas se mantuvieron durante 1.5 a 3.5 años después de la última infusión de ácido zoledrónico, pero fueron similares a las del grupo placebo a partir de entonces.
El ácido zoledrónico ejerce un efecto más rápido en la prevención de fracturas vertebrales y un efecto inicial más lento en la prevención de fracturas de cadera.
Se han comunicado resultados contradictorios sobre el riesgo de fibrilación auricular grave en mujeres tratadas con ácido zoledrónico. Las revisiones sistemáticas de EAC y los estudios observacionales mostraron un aumento significativo del riesgo de fibrilación auricular de nueva aparición con bifosfonatos intravenosos y orales. Sin embargo, los estudios no mostraron evidencia de un aumento en las comorbilidades, como el accidente cerebrovascular o la muerte. En general, la relación beneficio-riesgo es favorable y compensa dichas complicaciones en esta población.
denosumab
El denosumab es un anticuerpo monoclonal totalmente humano contra el activador del receptor del factor nuclear-kappa del ligando B (RANKL), una citocina que participa en la mediación de la actividad de los osteoclastas.
Se ha aprobado para el tratamiento de:
Mujeres postmenopáusicas con osteoporosis que presentan un alto riesgo de fractura
Profilaxis de la osteoporosis en mujeres con alto riesgo de fractura después de recibir una terapia adyuvante de inhibidores de la aromatasa para el cáncer de mama.
El denosumab también se pueden usar para mujeres con un riesgo muy alto de fractura (p. ej., puntuación T muy baja y antecedentes de fracturas vertebrales graves o múltiples, una fractura reciente o múltiples factores de riesgo de fractura), pero las guías de práctica clínica recomiendan el tratamiento inicial con un agente anabólico como la opción preferida para estos pacientes.[67]Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, et al. Pharmacologic treatment of primary osteoporosis or low bone mass to prevent fractures in adults: a living clinical guideline from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://www.acpjournals.org/doi/full/10.7326/M22-1034
http://www.ncbi.nlm.nih.gov/pubmed/36592456?tool=bestpractice.com
[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
[81]Royal Australian College of General Practitioners. Osteoporosis management and fracture prevention in post-menopausal women and men >50 years of age. Mar 2024 [internet publication].
https://www.racgp.org.au/clinical-resources/clinical-guidelines/key-racgp-guidelines/view-all-racgp-guidelines/osteoporosis/executive-summary
[113]Shoback D, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society guideline update. J Clin Endocrinol Metab. 2020 Mar 1;105(3):dgaa048.
https://academic.oup.com/jcem/article/105/3/587/5739968
http://www.ncbi.nlm.nih.gov/pubmed/32068863?tool=bestpractice.com
[114]Tai TW, Chen HY, Shih CA, et al. Asia-Pacific consensus on long-term and sequential therapy for osteoporosis. Osteoporos Sarcopenia. 2024 Mar;10(1):3-10.
https://pmc.ncbi.nlm.nih.gov/articles/PMC11056428
http://www.ncbi.nlm.nih.gov/pubmed/38690538?tool=bestpractice.com
El denosumab debe utilizarse con precaución en pacientes con hipocalcemia preexistente o que corren un alto riesgo de hipocalcemia (deficiencia de vitamina D), y en pacientes con enfermedad renal grave, incluida la enfermedad renal en fase terminal.[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
[108]Eastell R, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society* clinical practice guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1595-622.
https://www.endocrine.org/clinical-practice-guidelines/osteoporosis-in-postmenopausal-women
http://www.ncbi.nlm.nih.gov/pubmed/30907953?tool=bestpractice.com
La Administración de Medicamentos y Alimentos de EE. UU. (FDA) ha advertido de un mayor riesgo de hipocalcemia grave en pacientes con enfermedad renal crónica avanzada que reciben denosumab.[141]Food and Drug Administration. FDA adds boxed warning for increased risk of severe hypocalcemia in patients with advanced chronic kidney disease taking osteoporosis medicine Prolia (denosumab). Jan 2025 [internet publication].
https://www.fda.gov/drugs/drug-safety-and-availability/fda-adds-boxed-warning-increased-risk-severe-hypocalcemia-patients-advanced-chronic-kidney-disease
Dos estudios de seguridad mostraron un aumento significativo en el riesgo de hipocalcemia grave en los pacientes tratados con denosumab en comparación con los tratados con bifosfonatos, con el riesgo más alto notificado en pacientes con enfermedad renal avanzada, en particular aquellos en diálisis.[141]Food and Drug Administration. FDA adds boxed warning for increased risk of severe hypocalcemia in patients with advanced chronic kidney disease taking osteoporosis medicine Prolia (denosumab). Jan 2025 [internet publication].
https://www.fda.gov/drugs/drug-safety-and-availability/fda-adds-boxed-warning-increased-risk-severe-hypocalcemia-patients-advanced-chronic-kidney-disease
[142]Bird ST, Smith ER, Gelperin K, et al. Severe hypocalcemia with denosumab among older female dialysis-dependent patients. JAMA. 2024 Feb 13;331(6):491-9.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10799290
http://www.ncbi.nlm.nih.gov/pubmed/38241060?tool=bestpractice.com
La hipocalcemia grave fue más frecuente en aquellos con un trastorno mineral y óseo. Los pacientes con enfermedad renal crónica avanzada que toman denosumab corren el riesgo de sufrir resultados graves de hipocalcemia grave, que incluyen hospitalización y muerte. Antes de recetar denosumab, los profesionales de la salud deben evaluar la función renal y los niveles de calcio, y considerar otras opciones de tratamiento para los pacientes en riesgo. Durante el tratamiento, es esencial un seguimiento frecuente y un tratamiento oportuno de la hipocalcemia.
El American College of Obstetrics and Gynecology recomienda:[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
Denosumab como tratamiento inicial para pacientes posmenopáusicas con mayor riesgo de fractura que prefieren la administración subcutánea semestral
Los pacientes que interrumpan el tratamiento con denosumab deben pasar a recibir tratamiento con otro agente antirresortivo.
La Endocrine Society recomienda:[108]Eastell R, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society* clinical practice guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1595-622.
https://www.endocrine.org/clinical-practice-guidelines/osteoporosis-in-postmenopausal-women
http://www.ncbi.nlm.nih.gov/pubmed/30907953?tool=bestpractice.com
Denosumab como tratamiento inicial alternativo en mujeres posmenopáusicas con osteoporosis que corren un alto riesgo de sufrir fracturas osteoporóticas.
Los efectos del denosumab en la remodelación de los huesos, reflejados en los marcadores de recambio óseo, se invierten al cabo de 6 meses si el fármaco no se administra a tiempo. Por lo tanto, con este fármaco no se recomienda la interrupción del tratamiento o un descanso de la toma del fármaco.
En las mujeres posmenopáusicas con osteoporosis que toman denosumab, la administración no debe retrasarse, ni interrumpirse sin una terapia antirresortiva posterior (p. ej., bifosfonato, terapia hormonal o SERM) u otra terapia administrada para evitar un rebote en el recambio óseo y para disminuir el riesgo de una rápida pérdida de la DMO y un mayor riesgo de fractura.
El riesgo de fractura debe reevaluarse después de 5 a 10 años de tratamiento y las mujeres con alto riesgo de fractura deben continuar el tratamiento con denusomab, o bien ser tratadas con otro tratamiento osteoporótico.
El American College of Physicians recomienda denosumab como tratamiento de segunda línea para reducir el riesgo de fractura en mujeres posmenopáusicas con osteoporosis primaria que tienen contraindicaciones o experimentan efectos adversos con los bifosfonatos.[67]Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, et al. Pharmacologic treatment of primary osteoporosis or low bone mass to prevent fractures in adults: a living clinical guideline from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://www.acpjournals.org/doi/full/10.7326/M22-1034
http://www.ncbi.nlm.nih.gov/pubmed/36592456?tool=bestpractice.com
El ensayo FREEDOM demostró que el denosumab administrado durante 36 meses se asoció a una reducción del riesgo de fracturas vertebrales, no vertebrales y de cadera en mujeres con osteoporosis que tenían un puntaje T de la DMO de -2.5, pero no inferior a -4.0 en la columna lumbar o la cadera total, en comparación con placebo.[143]Cummings SR, San Martin J, McClung MR, et al; FREEDOM Trial. Denosumab for prevention of fractures in postmenopausal women with osteoporosis. N Engl J Med. 2009 Aug 20;361(8):756-65.
http://www.nejm.org/doi/full/10.1056/NEJMoa0809493#t=article
http://www.ncbi.nlm.nih.gov/pubmed/19671655?tool=bestpractice.com
Los estudios de extensión del ensayo FREEDOM informaron que:[144]Papapoulos S, Lippuner K, Roux C, et al. The effect of 8 or 5 years of denosumab treatment in postmenopausal women with osteoporosis: results from the FREEDOM Extension study. Osteoporos Int. 2015 Dec;26(12):2773-83.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4656716
http://www.ncbi.nlm.nih.gov/pubmed/26202488?tool=bestpractice.com
[145]Bone HG, Wagman RB, Brandi ML, et al. 10 years of denosumab treatment in postmenopausal women with osteoporosis: results from the phase 3 randomised FREEDOM trial and open-label extension. Lancet Diabetes Endocrinol. 2017 Jul;5(7):513-23.
http://www.ncbi.nlm.nih.gov/pubmed/28546097?tool=bestpractice.com
[146]Cummings SR, Ferrari S, Eastell R, et al. Vertebral fractures after discontinuation of denosumab: a post hoc analysis of the randomized placebo-controlled FREEDOM trial and its extension. J Bone Miner Res. 2018 Feb;33(2):190-8.
https://asbmr.onlinelibrary.wiley.com/doi/10.1002/jbmr.3337
http://www.ncbi.nlm.nih.gov/pubmed/29105841?tool=bestpractice.com
El tratamiento con denosumab de la osteoporosis posmenopáusica durante un máximo de 8 años se asoció a una reducción persistente del recambio óseo, un aumento continuado de la DMO, una baja incidencia de fracturas y un perfil entre el beneficio y el riesgo elevado
El tratamiento con denosumab durante un máximo de 10 años se asoció a tasas bajas de eventos adversos, una incidencia baja de fracturas en comparación con la observada durante el ensayo original, y aumentos continuos de la DMO sin meseta
La interrupción del denosumab va seguida de un rápido aumento de los marcadores de recambio, una disminución de la densidad ósea y un aumento del riesgo de fractura vertebral, lo que sugiere que los pacientes que interrumpen el denosumab deben recibir lo antes posible un tratamiento antirresortivo alternativo.
Existen evidencias que sugieren que el ácido zoledrónico administrado después del denosumab es más eficaz 7-8 meses después de la interrupción del denosumab, y que la teriparatida administrada antes del denosumab o en combinación con éste aumenta la DMO.[147]Horne AM, Mihov B, Reid IR. Bone loss after romosozumab/denosumab: effects of bisphosphonates. Calcif Tissue Int. 2018 Jul;103(1):55-61.
http://www.ncbi.nlm.nih.gov/pubmed/29445836?tool=bestpractice.com
[148]Leder BZ, Tsai JN, Uihlein AV, et al. Denosumab and teriparatide transitions in postmenopausal osteoporosis (the DATA-Switch study): extension of a randomised controlled trial. Lancet. 2015 Sep 19;386(9999):1147-55.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4620731
http://www.ncbi.nlm.nih.gov/pubmed/26144908?tool=bestpractice.com
[149]Liu Y, Xu Y, Zhang X, et al. Evaluating the clinical efficacy of teriparatide and denosumab combination therapy in postmenopausal osteoporosis: a systematic review and meta-analysis. Altern Ther Health Med. 2024 Jun;30(6):270-5.
https://alternative-therapies.com/oa/index.html
http://www.ncbi.nlm.nih.gov/pubmed/37944971?tool=bestpractice.com
Sin embargo, es necesario seguir investigando.[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
Se ha informado que el denosumab es significativamente más eficaz para aumentar la DMO en mujeres posmenopáusicas previamente tratadas con bifosfonatos, y ha demostrado una mejora significativa de la DMO en la columna lumbar, la cadera total y el cuello femoral a los 12 y 24 meses en pacientes con DMO baja u osteoporosis, en comparación con los bifosfonatos.[150]Zhu Y, Huang Z, Wang Y, et al. The efficacy and safety of denosumab in postmenopausal women with osteoporosis previously treated with bisphosphonates: a review. J Orthop Translat. 2020 May;22:7-13.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7231967
http://www.ncbi.nlm.nih.gov/pubmed/32440494?tool=bestpractice.com
[151]Lyu H, Jundi B, Xu C, et al. Comparison of denosumab and bisphosphonates in patients with osteoporosis: a meta-analysis of randomized controlled trials. J Clin Endocrinol Metab. 2019 May 1;104(5):1753-65.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6447951
http://www.ncbi.nlm.nih.gov/pubmed/30535289?tool=bestpractice.com
En pacientes de 50 años o más con osteoporosis, denosumab resultó ser tan eficaz como el ácido zoledrónico para reducir el riesgo de fracturas.[152]Li W, Ning Z, Yang Z, et al. Safety of denosumab versus zoledronic acid in the older adults with osteoporosis: a meta-analysis of cohort studies. Arch Osteoporos. 2022 Jun 17;17(1):84.
http://www.ncbi.nlm.nih.gov/pubmed/35715524?tool=bestpractice.com
Se ha informado un aumento del riesgo de infección grave en pacientes tratados con denosumab en comparación con placebo.[153]Diker-Cohen T, Rosenberg D, Avni T, et al. Risk for infections during treatment with denosumab for osteoporosis: a systematic review and meta-analysis. J Clin Endocrinol Metab. 2020 May 1;105(5):dgz322.
https://academic.oup.com/jcem/article/105/5/1641/5695688
http://www.ncbi.nlm.nih.gov/pubmed/31899506?tool=bestpractice.com
[154]Catton B, Surangiwala S, Towheed T. Is denosumab associated with an increased risk for infection in patients with low bone mineral density? A systematic review and meta-analysis of randomized controlled trials. Int J Rheum Dis. 2021 Jul;24(7):869-79.
http://www.ncbi.nlm.nih.gov/pubmed/33793076?tool=bestpractice.com
Sin embargo, el riesgo global de infección es comparable al de otros tratamientos de la osteoporosis, incluidos los bifosfonatos.[153]Diker-Cohen T, Rosenberg D, Avni T, et al. Risk for infections during treatment with denosumab for osteoporosis: a systematic review and meta-analysis. J Clin Endocrinol Metab. 2020 May 1;105(5):dgz322.
https://academic.oup.com/jcem/article/105/5/1641/5695688
http://www.ncbi.nlm.nih.gov/pubmed/31899506?tool=bestpractice.com
[154]Catton B, Surangiwala S, Towheed T. Is denosumab associated with an increased risk for infection in patients with low bone mineral density? A systematic review and meta-analysis of randomized controlled trials. Int J Rheum Dis. 2021 Jul;24(7):869-79.
http://www.ncbi.nlm.nih.gov/pubmed/33793076?tool=bestpractice.com
El denosumab se ha asociado con la osteonecrosis de la mandíbula, el deterioro de la curación de fracturas y fracturas femorales atípicas.[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
[67]Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, et al. Pharmacologic treatment of primary osteoporosis or low bone mass to prevent fractures in adults: a living clinical guideline from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://www.acpjournals.org/doi/full/10.7326/M22-1034
http://www.ncbi.nlm.nih.gov/pubmed/36592456?tool=bestpractice.com
El denosumab no se asocia con un mayor riesgo de resultados cardiovasculares en comparación con placebo o comparadores activos.[152]Li W, Ning Z, Yang Z, et al. Safety of denosumab versus zoledronic acid in the older adults with osteoporosis: a meta-analysis of cohort studies. Arch Osteoporos. 2022 Jun 17;17(1):84.
http://www.ncbi.nlm.nih.gov/pubmed/35715524?tool=bestpractice.com
[155]Lv F, Cai X, Yang W, et al. Denosumab or romosozumab therapy and risk of cardiovascular events in patients with primary osteoporosis: systematic review and meta-analysis. Bone. 2020 Jan;130:115121.
http://www.ncbi.nlm.nih.gov/pubmed/31678488?tool=bestpractice.com
Fármacos anabólicos
Los fármacos anabólicos incluyen teriparatida, abaloparatida y romosozumab.
La teriparatida y la abaloparatida son análogos de la hormona paratiroidea aprobados para tratar la osteoporosis en mujeres posmenopáusicas. La teriparatida es una forma recombinante de la hormona paratiroidea, mientras que la abaloparatida es un análogo del péptido relacionado con la hormona paratiroidea humana.
El romosozumab, un anticuerpo monoclonal inhibidor de la esclerosis que disminuye la reabsorción ósea y aumenta la formación de hueso, está aprobado para el tratamiento de la osteoporosis en mujeres posmenopáusicas con alto riesgo de fractura (definido como un antecedente de fractura osteoporótica, o múltiples factores de riesgo de fractura), o en pacientes que han fracasado o son intolerantes a otras terapias de osteoporosis disponibles.
Las guías de práctica clínica recomiendan el tratamiento inicial con un fármaco anabólico para las mujeres posmenopáusicas con un riesgo muy alto de fractura, como aquellas con una puntuación T muy baja y antecedentes de fracturas vertebrales graves o múltiples, una fractura reciente o múltiples factores de riesgo de fractura.[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
[67]Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, et al. Pharmacologic treatment of primary osteoporosis or low bone mass to prevent fractures in adults: a living clinical guideline from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://www.acpjournals.org/doi/full/10.7326/M22-1034
http://www.ncbi.nlm.nih.gov/pubmed/36592456?tool=bestpractice.com
[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
[81]Royal Australian College of General Practitioners. Osteoporosis management and fracture prevention in post-menopausal women and men >50 years of age. Mar 2024 [internet publication].
https://www.racgp.org.au/clinical-resources/clinical-guidelines/key-racgp-guidelines/view-all-racgp-guidelines/osteoporosis/executive-summary
[108]Eastell R, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society* clinical practice guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1595-622.
https://www.endocrine.org/clinical-practice-guidelines/osteoporosis-in-postmenopausal-women
http://www.ncbi.nlm.nih.gov/pubmed/30907953?tool=bestpractice.com
[113]Shoback D, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society guideline update. J Clin Endocrinol Metab. 2020 Mar 1;105(3):dgaa048.
https://academic.oup.com/jcem/article/105/3/587/5739968
http://www.ncbi.nlm.nih.gov/pubmed/32068863?tool=bestpractice.com
El American College of Obstetrics and Gynecology (ACOG) recomienda que la teriparatida, la abaloparatida o el romosozumab también se puedan usar para personas que continúan sufriendo fracturas o tienen una pérdida ósea significativa mientras reciben terapia antirresortiva.[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
Un metanálisis encontró que teriparatida y romosozumab fueron más efectivos que los bifosfonatos orales para reducir el riesgo de fracturas clínicas y vertebrales, independientemente de los indicadores de riesgo de fractura iniciales (antecedentes de fracturas previas, edad, puntuación T de la columna vertebral, índice de masa corporal [IMC], puntuación de la Herramienta de evaluación del riesgo de fracturas [FRAX] para fracturas osteoporóticas graves).[156]Händel MN, Cardoso I, von Bülow C, et al. Fracture risk reduction and safety by osteoporosis treatment compared with placebo or active comparator in postmenopausal women: systematic review, network meta-analysis, and meta-regression analysis of randomised clinical trials. BMJ. 2023 May 2;381:e068033.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10152340
http://www.ncbi.nlm.nih.gov/pubmed/37130601?tool=bestpractice.com
Sin embargo, las guías de práctica clínica sugieren que el tratamiento inicial con un fármaco anabólico puede ser más beneficioso para los pacientes con un riesgo muy alto de fracturas en la práctica, en parte porque los fármacos anabólicos requieren administración subcutánea.[81]Royal Australian College of General Practitioners. Osteoporosis management and fracture prevention in post-menopausal women and men >50 years of age. Mar 2024 [internet publication].
https://www.racgp.org.au/clinical-resources/clinical-guidelines/key-racgp-guidelines/view-all-racgp-guidelines/osteoporosis/executive-summary
[157]van den Bergh JP, Geusens P, Appelman-Dijkstra NM, et al. The Dutch multidisciplinary guideline osteoporosis and fracture prevention, taking a local guideline to the international arena. Arch Osteoporos. 2024 Apr 2;19(1):23.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10987374
http://www.ncbi.nlm.nih.gov/pubmed/38564062?tool=bestpractice.com
Los fármacos anabólicos no se utilizan normalmente como tratamiento inicial en pacientes con un alto riesgo de fracturas.
La guía de práctica clínica del American College of Physicians (ACP) solo recomienda teriparatida o romosozumab para mujeres con osteoporosis primaria y un riesgo muy alto de fractura; concluyeron que la evidencia a favor o en contra del tratamiento con abaloparatida no eran concluyente.[67]Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, et al. Pharmacologic treatment of primary osteoporosis or low bone mass to prevent fractures in adults: a living clinical guideline from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://www.acpjournals.org/doi/full/10.7326/M22-1034
http://www.ncbi.nlm.nih.gov/pubmed/36592456?tool=bestpractice.com
El ACP sugiere que las mujeres posmenopáusicas con fracturas vertebrales prevalentes se benefician más del tratamiento con teriparatida que las que no presentan fracturas prevalentes.[67]Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, et al. Pharmacologic treatment of primary osteoporosis or low bone mass to prevent fractures in adults: a living clinical guideline from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://www.acpjournals.org/doi/full/10.7326/M22-1034
http://www.ncbi.nlm.nih.gov/pubmed/36592456?tool=bestpractice.com
La guía de práctica clínica del Royal Australian College of General Practitioners recomienda romosozumab como la opción de primera línea preferida para los pacientes con un riesgo muy alto de fractura, basándose en la evidencia de que puede aumentar la DMO de manera más efectiva que el ácido alendrónico o la teriparatida.[81]Royal Australian College of General Practitioners. Osteoporosis management and fracture prevention in post-menopausal women and men >50 years of age. Mar 2024 [internet publication].
https://www.racgp.org.au/clinical-resources/clinical-guidelines/key-racgp-guidelines/view-all-racgp-guidelines/osteoporosis/executive-summary
Romosozumab:[67]Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, et al. Pharmacologic treatment of primary osteoporosis or low bone mass to prevent fractures in adults: a living clinical guideline from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://www.acpjournals.org/doi/full/10.7326/M22-1034
http://www.ncbi.nlm.nih.gov/pubmed/36592456?tool=bestpractice.com
[81]Royal Australian College of General Practitioners. Osteoporosis management and fracture prevention in post-menopausal women and men >50 years of age. Mar 2024 [internet publication].
https://www.racgp.org.au/clinical-resources/clinical-guidelines/key-racgp-guidelines/view-all-racgp-guidelines/osteoporosis/executive-summary
[108]Eastell R, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society* clinical practice guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1595-622.
https://www.endocrine.org/clinical-practice-guidelines/osteoporosis-in-postmenopausal-women
http://www.ncbi.nlm.nih.gov/pubmed/30907953?tool=bestpractice.com
[113]Shoback D, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society guideline update. J Clin Endocrinol Metab. 2020 Mar 1;105(3):dgaa048.
https://academic.oup.com/jcem/article/105/3/587/5739968
http://www.ncbi.nlm.nih.gov/pubmed/32068863?tool=bestpractice.com
[158]Cosman F, Crittenden DB, Adachi JD, et al. Romosozumab treatment in postmenopausal women with osteoporosis. N Engl J Med. 2016 Oct 20;375(16):1532-43.
https://www.nejm.org/doi/10.1056/NEJMoa1607948
http://www.ncbi.nlm.nih.gov/pubmed/27641143?tool=bestpractice.com
[159]Saag KG, Petersen J, Brandi ML, et al. Romosozumab or alendronate for fracture prevention in women with osteoporosis. N Engl J Med. 2017 Oct 12;377(15):1417-27.
https://www.nejm.org/doi/10.1056/NEJMoa1708322
http://www.ncbi.nlm.nih.gov/pubmed/28892457?tool=bestpractice.com
[160]Liu Y, Cao Y, Zhang S, et al. Romosozumab treatment in postmenopausal women with osteoporosis: a meta-analysis of randomized controlled trials. Climacteric. 2018 Apr;21(2):189-95.
http://www.ncbi.nlm.nih.gov/pubmed/29424257?tool=bestpractice.com
[161]Prather C, Adams E, Zentgraf W. Romosozumab: a first-in-class sclerostin inhibitor for osteoporosis. Am J Health Syst Pharm. 2020 Nov 16;77(23):1949-56.
http://www.ncbi.nlm.nih.gov/pubmed/32880646?tool=bestpractice.com
[162]Kaveh S, Hosseinifard H, Ghadimi N, et al. Efficacy and safety of romosozumab in treatment for low bone mineral density: a systematic review and meta-analysis. Clin Rheumatol. 2020 Nov;39(11):3261-76.
http://www.ncbi.nlm.nih.gov/pubmed/32385757?tool=bestpractice.com
[163]Lim SY. Romosozumab for the treatment of osteoporosis in women: efficacy, safety, and cardiovascular risk. Womens Health (Lond). 2022 Jan-Dec;18:17455057221125577.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9511529
http://www.ncbi.nlm.nih.gov/pubmed/36154750?tool=bestpractice.com
[164]Bovijn J, Krebs K, Chen CY, et al. Evaluating the cardiovascular safety of sclerostin inhibition using evidence from meta-analysis of clinical trials and human genetics. Sci Transl Med. 2020 Jun 24;12(549):eaay6570.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7116615
http://www.ncbi.nlm.nih.gov/pubmed/32581134?tool=bestpractice.com
[165]Mariscal G, Nuñez JH, Bhatia S, et al. Safety of romosozumab in osteoporotic men and postmenopausal women: a meta-analysis and systematic review. Monoclon Antib Immunodiagn Immunother. 2020 Apr;39(2):29-36.
http://www.ncbi.nlm.nih.gov/pubmed/32195618?tool=bestpractice.com
[166]Nealy KL, Harris KB. Romosozumab: a novel injectable sclerostin inhibitor with anabolic and antiresorptive effects for osteoporosis. Ann Pharmacother. 2021 May;55(5):677-86.
http://www.ncbi.nlm.nih.gov/pubmed/32862655?tool=bestpractice.com
El romosozumab se recomienda para el tratamiento de la osteoporosis posmenopáusica hasta para 1 año. El romosozumab debe evitarse en pacientes con un alto riesgo de enfermedad cardiovascular o accidente cerebrovascular.
El tratamiento con romosozumab debe ir seguido de un tratamiento secuencial con un fármaco antirresorcional para mantener las ganancias de DMO y reducir el riesgo de fractura.
El romosozumab ha demostrado reducciones significativas de nuevas fracturas vertebrales, nuevas fracturas no vertebrales y fractura de cadera en comparación con otros tratamientos de la osteoporosis, y un aumento de la DMO en la columna lumbar, la cadera total y el cuello femoral en comparación con placebo en mujeres posmenopáusicas y otros pacientes con osteoporosis y baja DMO.
Una revisión sistemática posterior informó que romosozumab aumentaba la DMO en la columna lumbar y la cadera total en comparación con teriparatida a los 12 meses en pacientes con osteoporosis. En mujeres posmenopáusicas con mayor riesgo de fractura, 1 año de romosozumab seguido de 1 año de ácido alendrónico redujo el riesgo de fracturas vertebrales, no vertebrales, clínicas y de cadera, en comparación con el ácido alendrónico solo a los 24 meses. Los eventos cardiovasculares y cerebrovasculares fueron mayores en el grupo de romosozumab que en el de ácido alendrónico.
Algunas evidencias sugieren que el romosozumab puede presentar una menor tasa de efectos adversos en comparación con el ácido alendrónico y un perfil de seguridad similar al de los bifosfonatos; sin embargo, la mayoría de los estudios coinciden en que se necesita más investigación para establecer el riesgo de enfermedad cardiovascular con el tratamiento con romosozumab.
Teriparatida y abaloparatida:[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
[108]Eastell R, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society* clinical practice guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1595-622.
https://www.endocrine.org/clinical-practice-guidelines/osteoporosis-in-postmenopausal-women
http://www.ncbi.nlm.nih.gov/pubmed/30907953?tool=bestpractice.com
[167]Neer RM, Arnaud CD, Zanchetta JR, et al. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med. 2001 May 10;344(19):1434-41.
http://www.nejm.org/doi/full/10.1056/NEJM200105103441904
http://www.ncbi.nlm.nih.gov/pubmed/11346808?tool=bestpractice.com
[168]Yang C, Le G, Lu C, et al. Effects of teriparatide compared with risedronate in the treatment of osteoporosis: a meta-analysis of randomized controlled trials. Medicine (Baltimore). 2020 Feb;99(7):e19042.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7035098
http://www.ncbi.nlm.nih.gov/pubmed/32049802?tool=bestpractice.com
[169]Shen J, Ke Z, Dong S, et al. Pharmacological therapies for osteoporosis: a Bayesian network meta-analysis. Med Sci Monit. 2022 Apr 17;28:e935491.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9022483
http://www.ncbi.nlm.nih.gov/pubmed/35430576?tool=bestpractice.com
[170]Tian A, Jia H, Zhu S, et al. Romosozumab versus teriparatide for the treatment of postmenopausal osteoporosis: a systematic review and meta-analysis through a grade analysis of evidence. Orthop Surg. 2021 Oct;13(7):1941-50.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8528978
http://www.ncbi.nlm.nih.gov/pubmed/34643048?tool=bestpractice.com
[171]Poutoglidou F, Samoladas E, Raikos N, et al. Efficacy and safety of anti-sclerostin antibodies in the treatment of osteoporosis: a meta-analysis and systematic review. J Clin Densitom. 2022 Jul-Sep;25(3):401-15.
http://www.ncbi.nlm.nih.gov/pubmed/34920938?tool=bestpractice.com
[172]Miller PD, Hattersley G, Riis BJ, et al. Effect of abaloparatide vs placebo on new vertebral fractures in postmenopausal women with osteoporosis: a randomized clinical trial. JAMA. 2016 Aug 16;316(7):722-33.
http://www.ncbi.nlm.nih.gov/pubmed/27533157?tool=bestpractice.com
[173]Cosman F, Miller PD, Williams GC, et al. Eighteen months of treatment with subcutaneous abaloparatide followed by 6 months of treatment with alendronate in postmenopausal women with osteoporosis: results of the ACTIVExtend trial. Mayo Clin Proc. 2017 Feb;92(2):200-10.
https://www.mayoclinicproceedings.org/article/S0025-6196(16)30630-9/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/28160873?tool=bestpractice.com
[174]Bone HG, Cosman F, Miller PD, et al. ACTIVExtend: 24 months of alendronate after 18 months of abaloparatide or placebo for postmenopausal osteoporosis. J Clin Endocrinol Metab. 2018 Aug 1;103(8):2949-57.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6097601
http://www.ncbi.nlm.nih.gov/pubmed/29800372?tool=bestpractice.com
[175]Miller PD, Bilezikian JP, Fitzpatrick LA, et al. Abaloparatide: an anabolic treatment to reduce fracture risk in postmenopausal women with osteoporosis. Curr Med Res Opin. 2020 Nov;36(11):1861-72.
https://www.tandfonline.com/doi/full/10.1080/03007995.2020.1824897
http://www.ncbi.nlm.nih.gov/pubmed/32969719?tool=bestpractice.com
[176]Reginster J-Y, Bianic F, Campbell R, et al. Abaloparatide for risk reduction of nonvertebral and vertebral fractures in postmenopausal women with osteoporosis: a network meta-analysis. Osteoporos Int. 2019 Jul;30(7):1465-73.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6614166
http://www.ncbi.nlm.nih.gov/pubmed/30953114?tool=bestpractice.com
Las guías de práctica clínica recomiendan el tratamiento con teriparatida o abaloparatida durante un máximo de 2 años. El tratamiento con teriparatida durante más de 2 años puede considerarse si el paciente sigue o vuelve a presentar un riesgo elevado de fractura.
La Bone Health and Osteoporosis Foundation (BHOF) sugiere que la teriparatida y la abaloparatida deben evitarse en pacientes con un riesgo elevado de osteosarcoma (enfermedad ósea de Paget, radioterapia previa que afecte al esqueleto, antecedentes de metástasis óseas o neoplasias malignas, fosfatasa alcalina elevada inexplicable y trastornos hereditarios que predispongan al osteosarcoma).
Cuando se interrumpe el tratamiento, la pérdida de hueso puede ser rápida y se deben considerar fármacos alternativos para mantener la DMO. La BNOF y la Endocrine Society recomiendan que el tratamiento de teriparatida o abaloparatida sea seguido por un fármaco antirresortivo, generalmente un bifosfonato, para mantener o aumentar aún más la DMO.
Los ensayos clínicos han demostrado que la teriparatida aumenta la DMO en comparación con el placebo. Las evidencias de la eficacia de la teriparatida en comparación con otros tratamientos para la osteoporosis son variables. Una revisión sistemática comprobó que la teriparatida mejora la DMO en columna lumbar, cuello femoral y cadera total, y reduce la incidencia de fractura clínica, nueva fractura vertebral y fractura no vertebral en comparación con el risedronato. Por el contrario, un metanálisis en red sugiere que la teriparatida es menos eficaz en comparación con otros fármacos como los bifosfonatos, el denosumab o el romosozumab para reducir el riesgo de fracturas en pacientes con osteoporosis. Otras dos revisiones sistemáticas demostraron que la teriparatida era menos eficaz que el romosozumab para mejorar la DMO de la columna lumbar, la cadera total y el cuello femoral en pacientes con osteoporosis posmenopáusica a los 6 y 12 meses.
El ensayo controlado doble ciego de fase 3 ACTIVE y los ensayos de extensión posteriores demostraron que la abaloparatida redujo el riesgo de nuevas fracturas vertebrales y no vertebrales durante 18 meses en comparación con el placebo, y que el uso secuencial de ácido alendrónico durante 6 o 24 meses tras el tratamiento con abaloparatida redujo el riesgo de fracturas vertebrales, no vertebrales, clínicas y osteoporóticas mayores y aumentó la DMO en comparación con el placebo en mujeres posmenopáusicas.
Los resultados de los metanálisis en red indican que la abaloparatida reduce el riesgo de fractura vertebral, fractura no vertebral y fractura de muñeca en comparación con otros tratamientos para la osteoporosis como la teriparatida, el romosozumab o ácido ibandrónico en pacientes con osteoporosis, incluidas las mujeres posmenopáusicas.
Los efectos adversos de la teriparatida incluyen calambres en las piernas, náuseas y mareos, y en el caso de la abaloparatida incluyen náuseas, hipotensión postural, mareos, dolor de cabeza y palpitaciones.
MSRE
Los moduladores selectivos de los receptores de estrógeno (MSRE) incluyen el raloxifeno y el bazedoxifeno.
El raloxifeno está aprobado para el tratamiento y la prevención de la osteoporosis en mujeres posmenopáusicas. Aumenta la DMO en la columna, pero en menor grado que los bifosfonatos, y solo es eficaz para reducir la fractura vertebral.[125]Black DM, Schwartz AV, Ensrud KE, et al. Effects of continuing or stopping alendronate after 5 years of treatment: the Fracture Intervention Trial Long-term Extension (FLEX): a randomized trial. JAMA. 2006 Dec 27;296(24):2927-38.
http://jama.jamanetwork.com/article.aspx?articleid=204789
http://www.ncbi.nlm.nih.gov/pubmed/17190893?tool=bestpractice.com
El raloxifeno reduce el riesgo de fracturas vertebrales en las mujeres posmenopáusicas con osteoporosis.[177]Ettinger B, Black DM, Mitlak BH, et al. Reduction of vertebral fracture risk in postmenopausal women with osteoporosis treated with raloxifene: results from a 3-year randomized clinical trial. Multiple Outcomes of Raloxifene Evaluation (MORE) Investigators. JAMA. 1999 Aug 18;282(7):637-45.
https://jamanetwork.com/journals/jama/fullarticle/191242
http://www.ncbi.nlm.nih.gov/pubmed/10517716?tool=bestpractice.com
No hay evidencias sobre la reducción de fracturas no vertebrales.
El uso de raloxifeno se asocia a un mayor riesgo de trombosis venosa e ictus.[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
La posibilidad de efectos adversos se sopesa con respecto a las posibles ventajas de un menor riesgo de fracturas vertebrales y cáncer de mama con receptores de estrógenos positivos.
El ACOG sugiere el uso de raloxifeno en pacientes posmenopáusicas con mayor riesgo de fractura vertebral y cáncer de mama, con bajo riesgo de tromboembolismo venoso y que no presenten síntomas vasomotores significativos.[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
La Endocrine Society recomienda el raloxifeno o el bazedoxifeno para reducir el riesgo de fractura vertebral en las mujeres posmenopáusicas menores de 60 años o <10 años después de la menopausia, con osteoporosis con alto riesgo de fractura y que tienen un bajo riesgo de trombosis venosa profunda, y para las que los bifosfonatos o el denosumab no son indicados, o bien presentan un alto riesgo de cáncer de mama.[108]Eastell R, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society* clinical practice guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1595-622.
https://www.endocrine.org/clinical-practice-guidelines/osteoporosis-in-postmenopausal-women
http://www.ncbi.nlm.nih.gov/pubmed/30907953?tool=bestpractice.com
El ACP concluyó que no hay pruebas suficientes para recomendar a favor o en contra del tratamiento con raloxifeno o bazedoxifeno.[67]Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, et al. Pharmacologic treatment of primary osteoporosis or low bone mass to prevent fractures in adults: a living clinical guideline from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://www.acpjournals.org/doi/full/10.7326/M22-1034
http://www.ncbi.nlm.nih.gov/pubmed/36592456?tool=bestpractice.com
Una revisión sistemática demostró que el raloxifeno es eficaz para mejorar la DMO de la columna lumbar en mujeres posmenopáusicas con enfermedad renal terminal, en comparación con placebo, con una duración media del tratamiento de 12 meses.[178]Ma HY, Chen S, Lu LL, et al. Raloxifene in the treatment of osteoporosis in postmenopausal women with end-stage renal disease: a systematic review and meta-analysis. Horm Metab Res. 2021 Nov;53(11):730-7.
https://www.thieme-connect.com/products/ejournals/html/10.1055/a-1655-4362
http://www.ncbi.nlm.nih.gov/pubmed/34740274?tool=bestpractice.com
No se informaron efectos adversos en el grupo de pacientes con raloxifeno, pero se necesitan más ECA de gran tamaño para evaluar la seguridad a largo plazo del raloxifeno en estas pacientes.[178]Ma HY, Chen S, Lu LL, et al. Raloxifene in the treatment of osteoporosis in postmenopausal women with end-stage renal disease: a systematic review and meta-analysis. Horm Metab Res. 2021 Nov;53(11):730-7.
https://www.thieme-connect.com/products/ejournals/html/10.1055/a-1655-4362
http://www.ncbi.nlm.nih.gov/pubmed/34740274?tool=bestpractice.com
El bazedoxifeno reduce el riesgo de hiperplasia endometrial (crecimiento excesivo del revestimiento del útero) que puede producirse con el tratamiento con estrógenos.[179]Pinkerton JV, Thomas S, Dalkin AC. Osteoporosis treatment and prevention for postmenopausal women: current and future therapeutic options. Clin Obstet Gynecol. 2013 Dec;56(4):711-21.
http://www.ncbi.nlm.nih.gov/pubmed/24100598?tool=bestpractice.com
El bazedoxifeno solo está disponible en una formulación combinada con estrógenos conjugados en los Estados Unidos; sin embargo, está disponible como formulación de un solo ingrediente en otros países. Los estrógenos conjugados/bazedoxifeno se recomiendan en tercera línea solo después de una cuidadosa consideración de los fármacos alternativos que no contienen estrógenos (ver más abajo).[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
Tratamiento hormonal
La disminución de los estrógenos en la menopausia está fuertemente asociada con la disminución de la DMO.[2]NIH Consensus Development Panel on Osteoporosis Prevention, Diagnosis, and Therapy. Osteoporosis prevention, diagnosis, and therapy. JAMA. 2001 Feb 14;285(6):785-95.
http://www.ncbi.nlm.nih.gov/pubmed/11176917?tool=bestpractice.com
[3]WHO Scientific Group on the Prevention and Management of Osteoporosis. Prevention and management of osteoporosis: report of a WHO scientific group. (WHO technical report series: 921.) Geneva, Switzerland: WHO; 2003.
https://apps.who.int/iris/handle/10665/42841
Hay varias formas de tratamiento hormonal sustitutivo (THS). El estrógeno, ya sea solo o en combinación con una progestina, se considera solo para las mujeres con alto riesgo de fracturas osteoporóticas para las que el tratamiento no hormonal es inadecuado.
El THS reduce la incidencia de fracturas. Sin embargo, hay un aumento considerable del riesgo de cardiopatía coronaria, cáncer de mama, trombosis venosa y accidente cerebrovascular.[180]Santen RJ, Allred DC, Ardoin SP, et al. Postmenopausal hormone therapy: an Endocrine Society scientific statement. J Clin Endocrinol Metab. 2010 Jul;95(7 suppl 1):s1-66.
https://academic.oup.com/jcem/article/95/7_supplement_1/s1/2835479
http://www.ncbi.nlm.nih.gov/pubmed/20566620?tool=bestpractice.com
[181]Medicines and Healthcare products Regulatory Agency. Hormone replacement therapy (HRT): further information on the known increased risk of breast cancer with HRT and its persistence after stopping. Aug 2019 [internet publication].
https://www.gov.uk/drug-safety-update/hormone-replacement-therapy-hrt-further-information-on-the-known-increased-risk-of-breast-cancer-with-hrt-and-its-persistence-after-stopping
[182]Collaborative Group on Hormonal Factors in Breast Cancer. Type and timing of menopausal hormone therapy and breast cancer risk: individual participant meta-analysis of the worldwide epidemiological evidence. Lancet. 2019 Sep 28;394(10204):1159-68.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(19)31709-X/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/31474332?tool=bestpractice.com
El informe de WHI evaluó la eficacia de los estrógenos conjugados frente al placebo en 10,739 mujeres posmenopáusicas de 50 a 79 años con histerectomía previa.[183]Anderson GL, Limacher M, Assaf AR, et al. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy: the Women's Health Initiative randomized controlled trial. JAMA. 2004 Apr 14;291(14):1701-12.
http://www.ncbi.nlm.nih.gov/pubmed/15082697?tool=bestpractice.com
El resultado principal fue una enfermedad coronaria. El estudio informó que los estrógenos conjugados aumentaban el riesgo de accidente cerebrovascular, disminuían el riesgo de fractura de cadera y no afectaban a la incidencia de cardiopatía coronaria en esta población en un promedio de 6.8 años.[183]Anderson GL, Limacher M, Assaf AR, et al. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy: the Women's Health Initiative randomized controlled trial. JAMA. 2004 Apr 14;291(14):1701-12.
http://www.ncbi.nlm.nih.gov/pubmed/15082697?tool=bestpractice.com
La Endocrine Society recomienda el estrógeno como tratamiento de primera línea para prevenir todo tipo de fracturas en mujeres (menores de 60 años o <10 años después de la menopausia) con histerectomía y alto riesgo de fractura osteoporótica, con bajo riesgo de trombosis venosa profunda, para las que los bifosfonatos o el denosumab no son adecuados, que presentan síntomas vasomotores, que no presentan contraindicaciones, que no han sufrido previamente un infarto de miocardio, un accidente cerebrovascular o un cáncer de mama, y que están dispuestas a tomar una terapia hormonal menopáusica.[108]Eastell R, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society* clinical practice guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1595-622.
https://www.endocrine.org/clinical-practice-guidelines/osteoporosis-in-postmenopausal-women
http://www.ncbi.nlm.nih.gov/pubmed/30907953?tool=bestpractice.com
Las mujeres con útero deberán utilizar estrógenos únicamente en combinación con progestina porque el uso de estrógenos en monoterapia aumenta la incidencia de cáncer de endometrio.[184]Sjögren LL, Mørch LS, Løkkegaard E. Hormone replacement therapy and the risk of endometrial cancer: a systematic review. Maturitas. 2016 Sep;91:25-35.
http://www.ncbi.nlm.nih.gov/pubmed/27451318?tool=bestpractice.com
La Endocrine Society recomienda el estrógeno más una progestina o tibolona (no disponible en los EE.UU.) como tratamiento de primera línea para prevenir las fracturas vertebrales y no vertebrales para las mujeres menores de 60 años (o <10 años después de la menopausia) con alto riesgo de fractura osteoporótica, con un bajo riesgo de trombosis venosa profunda, para quienes los bifosfonatos o el denosumab no son adecuados, que presentan síntomas vasomotores, que no presentan contraindicaciones, que no han sufrido previamente un infarto de miocardio, un accidente cerebrovascular o un cáncer de mama, y que están dispuestas a tomar una terapia de tibolonas en la menopausia.[108]Eastell R, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society* clinical practice guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1595-622.
https://www.endocrine.org/clinical-practice-guidelines/osteoporosis-in-postmenopausal-women
http://www.ncbi.nlm.nih.gov/pubmed/30907953?tool=bestpractice.com
La Endocrine Society también recomienda el estrógeno más una progestina o tibolona como tratamiento de segunda línea para prevenir las fracturas vertebrales y no vertebrales en las mujeres mayores de más de 60 años para las que los bifosfonatos, el denosumab y la teriparatida/abaloparatida no son adecuados.[108]Eastell R, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society* clinical practice guideline. J Clin Endocrinol Metab. 2019 May 1;104(5):1595-622.
https://www.endocrine.org/clinical-practice-guidelines/osteoporosis-in-postmenopausal-women
http://www.ncbi.nlm.nih.gov/pubmed/30907953?tool=bestpractice.com
El American College of Physicians (ACP) recomienda no utilizar el estrógeno menopáusico en solitario o en combinación con la terapia de progestágeno para el tratamiento de la osteoporosis en las mujeres.[185]Qaseem A, Forciea MA, McLean RM, et al. Treatment of low bone density or osteoporosis to prevent fractures in men and women: a clinical practice guideline update from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10885682
http://www.ncbi.nlm.nih.gov/pubmed/28492856?tool=bestpractice.com
Bazedoxifeno/estrógenos conjugados
Los estrógenos conjugados/bazedoxifeno están indicados para la profilaxis de la osteoporosis debida a la menopausia en mujeres con un útero intacto.[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
[70]ACOG Committee on Clinical Practice Guidelines–Gynecology. Management of postmenopausal osteoporosis: ACOG clinical practice guideline no. 2. Obstet Gynecol. 2022 Apr 1;139(4):698-717.
http://www.ncbi.nlm.nih.gov/pubmed/35594133?tool=bestpractice.com
El bazedoxifeno en monoterapia está indicado para el tratamiento de la osteoporosis posmenopáusica en mujeres con mayor riesgo de fractura, pero no está disponible como formulación de un solo ingrediente en los Estados Unidos.
El BHOF recomienda los estrógenos conjugados/bazedoxifeno para la prevención de la osteoporosis sólo en mujeres con un riesgo significativo de fractura y sólo después de considerar detenidamente tratamientos alternativos que no contengan estrógenos.[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
Este tratamiento sólo debe utilizarse durante el menor tiempo posible, en consonancia con los objetivos del tratamiento y los riesgos para cada mujer.[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
Los efectos adversos incluyen espasmos musculares, náuseas, diarrea, dispepsia, dolor abdominal superior, dolor orofaríngeo, mareos y dolor de cuello.[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
Hombres
Se debe considerar a los hombres de 50 años o más que presenten cualquiera de los siguientes síntomas para el tratamiento de la osteoporosis:[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
Una fractura de cadera o vertebral (clínicamente aparente o detectada en estudios por imágenes vertebrales) independientemente del puntaje T
Fractura de pelvis, húmero proximal o antebrazo distal en una persona con baja masa ósea u osteopenia
Puntaje T ≤-2.5 en el cuello femoral, la cadera total, la columna lumbar o el 33% del radio
Alto riesgo de fractura y necesidad de intervención farmacológica, según lo indicado por un puntaje T entre -1.0 y -2.5 en el cuello femoral o la cadera total y una probabilidad a 10 años de una fractura de cadera ≥3% o una probabilidad a 10 años de una fractura mayor relacionada con la osteoporosis ≥20% (según FRAX).
Bifosfonatos
Los bifosfonatos orales son el tratamiento de elección en primera línea para los hombres con osteoporosis y alto riesgo de fractura, con o sin fracturas vertebrales previas.[82]Fuggle NR, Beaudart C, Bruyère O, et al. Evidence-based guideline for the management of osteoporosis in men. Nat Rev Rheumatol. 2024 Apr;20(4):241-51.
https://www.nature.com/articles/s41584-024-01094-9
http://www.ncbi.nlm.nih.gov/pubmed/38485753?tool=bestpractice.com
El ácido alendrónico, el risedronato y el ácido zoledrónico están aprobados para el tratamiento de la osteoporosis en los hombres. Sin embargo, a pesar de los importantes conocimientos sobre la patogénesis y el tratamiento de la osteoporosis masculina, quedan por resolver varias cuestiones fundamentales. En los EE. UU., la Administración de Medicamentos y Alimentos (FDA) no ha aprobado el uso de ácido zoledrónico para el tratamiento de la osteoporosis en hombres y con deficiencia de testosterona.
Un ensayo controlado con placebo, doble ciego y multicéntrico de hombres con osteoporosis primaria y asociada a hipogonadismo de entre 50 y 85 años demostró que una infusión intravenosa de ácido zoledrónico inicial y a los 12 meses reduce el riesgo de nuevas fracturas vertebrales morfométricas en un 67% durante un período de 24 meses en comparación con placebo.[186]Boonen S, Reginster JY, Kaufman JM, et al. Fracture risk and zoledronic acid therapy in men with osteoporosis. N Engl J Med. 2012 Nov 1;367(18):1714-23.
http://www.nejm.org/doi/full/10.1056/NEJMoa1204061
http://www.ncbi.nlm.nih.gov/pubmed/23113482?tool=bestpractice.com
La guía de práctica clínica del American College of Physicians (ACP) indica que la respuesta al tratamiento con bifosfonato y denosumab es similar, tanto en hombres, como en mujeres.[67]Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, et al. Pharmacologic treatment of primary osteoporosis or low bone mass to prevent fractures in adults: a living clinical guideline from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://www.acpjournals.org/doi/full/10.7326/M22-1034
http://www.ncbi.nlm.nih.gov/pubmed/36592456?tool=bestpractice.com
Los efectos adversos de los bifosfonatos orales están principalmente relacionados con el tracto gastrointestinal superior e incluyen la dificultad en la deglución, la esofagitis y las úlceras gástricas. También se ha observado dolor articular y muscular, osteonecrosis de la mandíbula y fracturas femorales atípicas.[117]Shane E, Burr D, Abrahamsen B, et al. Atypical subtrochanteric and diaphyseal femoral fractures: second report of a task force of the American Society for Bone and Mineral Research. J Bone Miner Res. 2014 Jan;29(1):1-23.
https://onlinelibrary.wiley.com/doi/full/10.1002/jbmr.1998
http://www.ncbi.nlm.nih.gov/pubmed/23712442?tool=bestpractice.com
[118]Abrahamsen B. Adverse effects of bisphosphonates. Calcif Tissue Int. 2010 Jun;86(6):421-35.
http://www.ncbi.nlm.nih.gov/pubmed/20407762?tool=bestpractice.com
[119]Lee S, Yin RV, Hirpara H, et al. Increased risk for atypical fractures associated with bisphosphonate use. Fam Pract. 2015 Jun;32(3):276-81.
http://fampra.oxfordjournals.org/content/32/3/276.long
http://www.ncbi.nlm.nih.gov/pubmed/25846215?tool=bestpractice.com
[120]Wysowski DK, Chang JT. Alendronate and risedronate: reports of severe bone, joint and muscle pain. Arch Intern Med. 2005 Feb 14;165(3):346-7.
http://www.ncbi.nlm.nih.gov/pubmed/15710802?tool=bestpractice.com
[121]Khan AA, Sándor GK, Dore E, et al. Bisphosphonate associated osteonecrosis of the jaw. J Rheumatol. 2009 Mar;36(3):478-90.
http://www.ncbi.nlm.nih.gov/pubmed/19286860?tool=bestpractice.com
[122]Woo SB, Hellstein JW, Kalmar JR. Narrative [corrected] review: bisphosphonates and osteonecrosis of the jaws. Ann Intern Med. 2006 May 16;144(10):753-61.
http://www.ncbi.nlm.nih.gov/pubmed/16702591?tool=bestpractice.com
testosterona
La deficiencia de testosterona se ha asociado con una disminución de la DMO en los hombres, pero la evidencia de que la terapia de reemplazo de testosterona mejora la DMO o reduce el riesgo de fracturas es limitada e inconsistente.[82]Fuggle NR, Beaudart C, Bruyère O, et al. Evidence-based guideline for the management of osteoporosis in men. Nat Rev Rheumatol. 2024 Apr;20(4):241-51.
https://www.nature.com/articles/s41584-024-01094-9
http://www.ncbi.nlm.nih.gov/pubmed/38485753?tool=bestpractice.com
Una revisión sistemática concluyó que el tratamiento con testosterona no aumentaba la DMO en la columna vertebral, el cuello femoral, el triángulo de Ward y todo el cuerpo, con la excepción del trocánter y la cadera total en hombres mayores.[187]Junjie W, Dongsheng H, Lei S, et al. Testosterone replacement therapy has limited effect on increasing bone mass density in older men: a meta-analysis. Curr Pharm Des. 2019;25(1):73-84.
http://www.ncbi.nlm.nih.gov/pubmed/30727867?tool=bestpractice.com
La terapia con testosterona puede considerarse como un complemento de la terapia específica para la osteoporosis en pacientes con deficiencia sintomática de testosterona.[82]Fuggle NR, Beaudart C, Bruyère O, et al. Evidence-based guideline for the management of osteoporosis in men. Nat Rev Rheumatol. 2024 Apr;20(4):241-51.
https://www.nature.com/articles/s41584-024-01094-9
http://www.ncbi.nlm.nih.gov/pubmed/38485753?tool=bestpractice.com
[188]Jayasena CN, Anderson RA, Llahana S, et al. Society for endocrinology guidelines for testosterone replacement therapy in male hypogonadism. Clin Endocrinol (Oxf). 2022 Feb;96(2):200-19.
https://onlinelibrary.wiley.com/doi/epdf/10.1111/cen.14633
http://www.ncbi.nlm.nih.gov/pubmed/34811785?tool=bestpractice.com
No se recomienda para hombres con niveles normales de testosterona.
Fármacos anabólicos
Algunas guías de práctica clínica recomiendan considerar el tratamiento inicial con un fármaco anabólico (por ejemplo, teriparatida, abaloparatida, romosozumab) para los hombres con un riesgo muy alto de fracturas.[81]Royal Australian College of General Practitioners. Osteoporosis management and fracture prevention in post-menopausal women and men >50 years of age. Mar 2024 [internet publication].
https://www.racgp.org.au/clinical-resources/clinical-guidelines/key-racgp-guidelines/view-all-racgp-guidelines/osteoporosis/executive-summary
[82]Fuggle NR, Beaudart C, Bruyère O, et al. Evidence-based guideline for the management of osteoporosis in men. Nat Rev Rheumatol. 2024 Apr;20(4):241-51.
https://www.nature.com/articles/s41584-024-01094-9
http://www.ncbi.nlm.nih.gov/pubmed/38485753?tool=bestpractice.com
A esto le debe seguir un tratamiento secuencial con un fármaco antirresortivo.[82]Fuggle NR, Beaudart C, Bruyère O, et al. Evidence-based guideline for the management of osteoporosis in men. Nat Rev Rheumatol. 2024 Apr;20(4):241-51.
https://www.nature.com/articles/s41584-024-01094-9
http://www.ncbi.nlm.nih.gov/pubmed/38485753?tool=bestpractice.com
Sin embargo, aunque la guía de práctica clínica del ACP recomienda este enfoque para las mujeres con un riesgo muy alto de fracturas, concluyeron que la evidencia era insuficiente para hacer una recomendación similar para los hombres.[67]Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, et al. Pharmacologic treatment of primary osteoporosis or low bone mass to prevent fractures in adults: a living clinical guideline from the American College of Physicians. Ann Intern Med. 2023 Feb;176(2):224-38.
https://www.acpjournals.org/doi/full/10.7326/M22-1034
http://www.ncbi.nlm.nih.gov/pubmed/36592456?tool=bestpractice.com
Las guías de práctica clínica sugieren que el tratamiento inicial con un fármaco anabólico puede ser más beneficioso para los pacientes con un riesgo muy alto de fracturas en la práctica, y no suelen utilizarse como terapia inicial en pacientes con un alto riesgo de fracturas.[81]Royal Australian College of General Practitioners. Osteoporosis management and fracture prevention in post-menopausal women and men >50 years of age. Mar 2024 [internet publication].
https://www.racgp.org.au/clinical-resources/clinical-guidelines/key-racgp-guidelines/view-all-racgp-guidelines/osteoporosis/executive-summary
[99]Morin SN, Feldman S, Funnell L, et al. Clinical practice guideline for management of osteoporosis and fracture prevention in Canada: 2023 update. CMAJ. 2023 Oct 10;195(39):E1333-48.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10610956
http://www.ncbi.nlm.nih.gov/pubmed/37816527?tool=bestpractice.com
[157]van den Bergh JP, Geusens P, Appelman-Dijkstra NM, et al. The Dutch multidisciplinary guideline osteoporosis and fracture prevention, taking a local guideline to the international arena. Arch Osteoporos. 2024 Apr 2;19(1):23.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10987374
http://www.ncbi.nlm.nih.gov/pubmed/38564062?tool=bestpractice.com
La teriparatida y la abaloparatida están aprobadas para hombres con un alto riesgo de fractura.[189]Khosla S, Amin S, Orwoll E. Osteoporosis in men. Endocr Rev. 2008 Jun;29(4):441-64.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2528848
http://www.ncbi.nlm.nih.gov/pubmed/18451258?tool=bestpractice.com
La abaloparatida aumenta significativamente la DMO en la columna lumbar, la cadera total y el cuello femoral en comparación con el placebo en hombres con osteoporosis.[190]Czerwinski E, Cardona J, Plebanski R, et al. The efficacy and safety of abaloparatide-SC in men with osteoporosis: a randomized clinical trial. J Bone Miner Res. 2022 Dec;37(12):2435-42.
https://asbmr.onlinelibrary.wiley.com/doi/10.1002/jbmr.4719
http://www.ncbi.nlm.nih.gov/pubmed/36190391?tool=bestpractice.com
[191]Beaudart C, Demonceau C, Sabico S, et al. Efficacy of osteoporosis pharmacological treatments in men: a systematic review and meta-analysis. Aging Clin Exp Res. 2023 Sep;35(9):1789-806.
https://pmc.ncbi.nlm.nih.gov/articles/PMC10460304
http://www.ncbi.nlm.nih.gov/pubmed/37400668?tool=bestpractice.com
Las guías de práctica clínica europeas para la osteoporosis en hombres concluyeron que la evidencia de mejoría de la DMO es más fuerte para la abaloparatida.[82]Fuggle NR, Beaudart C, Bruyère O, et al. Evidence-based guideline for the management of osteoporosis in men. Nat Rev Rheumatol. 2024 Apr;20(4):241-51.
https://www.nature.com/articles/s41584-024-01094-9
http://www.ncbi.nlm.nih.gov/pubmed/38485753?tool=bestpractice.com
En el Reino Unido, la teriparatida se recomienda como opción de tratamiento alternativo para la prevención secundaria de las fracturas osteoporóticas en los hombres.[192]NHS England. Interim clinical commissioning policy statement: teriparatide for osteoporosis in men (adults). Jan 2021 [internet publication].
https://www.england.nhs.uk/publication/interim-clinical-commissioning-policy-statement-teriparatide-for-osteoporosis-in-men-adults-2
Los EAC en hombres con osteoporosis informan que la teriparatida aumenta la DMO en la columna y el cuello femoral.[193]Orwoll ES, Scheele WH, Paul S, et al. The effect of teriparatide [human parathyroid hormone (1-34)] therapy on bone density in men with osteoporosis. J Bone Miner Res. 2003 Jan;18(1):9-17.
https://asbmr.onlinelibrary.wiley.com/doi/full/10.1359/jbmr.2003.18.1.9
http://www.ncbi.nlm.nih.gov/pubmed/12510800?tool=bestpractice.com
Aunque la DMO disminuye gradualmente después de la interrupción del tratamiento, cuando va seguida de un tratamiento antirresortivo, la teriparatida disminuye el riesgo de fractura vertebral moderada y grave.[194]Kaufman JM, Orwoll E, Goemaere S, et al. Teriparatide effects on vertebral fractures and bone mineral density in men with osteoporosis: treatment and discontinuation of therapy. Osteoporos Int. 2005 May;16(5):510-6.
http://www.ncbi.nlm.nih.gov/pubmed/15322742?tool=bestpractice.com
Las evidencias también sugieren que la teriparatida es tan eficaz en hombres como en mujeres posmenopáusicas para tratar la osteoporosis.[195]Niimi R, Kono T, Nishihara A, et al. Analysis of daily teriparatide treatment for osteoporosis in men. Osteoporos Int. 2015 Apr;26(4):1303-9.
http://www.ncbi.nlm.nih.gov/pubmed/25567777?tool=bestpractice.com
Cuando se interrumpe el tratamiento con teriparatida o abaloparatida, la pérdida de hueso puede ser rápida y deben considerarse fármacos alternativos para mantener la densidad mineral ósea.[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
[82]Fuggle NR, Beaudart C, Bruyère O, et al. Evidence-based guideline for the management of osteoporosis in men. Nat Rev Rheumatol. 2024 Apr;20(4):241-51.
https://www.nature.com/articles/s41584-024-01094-9
http://www.ncbi.nlm.nih.gov/pubmed/38485753?tool=bestpractice.com
El uso de romosozumab en hombres con osteoporosis no está aprobado en EE.UU. ni en Europa, pero sí lo está en otros países para el tratamiento de hombres con osteoporosis con alto riesgo de fractura.[62]LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician's guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-102.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9546973
http://www.ncbi.nlm.nih.gov/pubmed/35478046?tool=bestpractice.com
El tratamiento con romosozumab durante 12 meses produjo un aumento significativo de la DMO en la columna vertebral, el cuello femoral y el total de la cadera en comparación con el placebo, y fue bien tolerado en hombres con osteoporosis.[196]Lewiecki EM, Blicharski T, Goemaere S, et al. A phase III randomized placebo-controlled trial to evaluate efficacy and safety of romosozumab in men with osteoporosis. J Clin Endocrinol Metab. 2018 Sep 1;103(9):3183-93.
https://academic.oup.com/jcem/article/103/9/3183/5040365
http://www.ncbi.nlm.nih.gov/pubmed/29931216?tool=bestpractice.com
denosumab
El denosumab está aprobado para el tratamiento de hombres con osteoporosis que presentan un alto riesgo de fracturas, definido como antecedentes de factores de fragilidad, o múltiples factores de riesgo de fracturas; o personas en las que han fracasado otros regímenes farmacológicos disponibles para la osteoporosis, o bien son intolerantes (véase la advertencia de la FDA en la información sobre denosumab en la sección de mujeres posmenopáusicas).
También está aprobado para la profilaxis de la osteoporosis en hombres con alto riesgo de fractura después de recibir la terapia de privación de andrógenos para el cáncer de próstata no metastásico. En los hombres con cáncer de próstata no metastásico, el denosumab también redujo la incidencia de fractura vertebral.[197]Smith MR, Egerdie B, Hernández Toriz N, et al. Denosumab in men receiving androgen-deprivation therapy for prostate cancer. N Engl J Med. 2009 Aug 20;361(8):745-55.
https://www.nejm.org/doi/full/10.1056/NEJMoa0809003
http://www.ncbi.nlm.nih.gov/pubmed/19671656?tool=bestpractice.com
Osteoporosis inducida por glucocorticoides
La osteoporosis inducida por corticosteroides es una alteración compleja que incluye un aumento de la resorción ósea y una formación ósea defectuosa. La fractura ósea se produce en el 30% al 50% de los pacientes que reciben tratamiento crónico con corticoesteroides; por lo tanto, su prevención y tratamiento es imperativo en esta población.[65]Briot K, Roux C. Glucocorticoid-induced osteoporosis. RMD Open. 2015 Apr 8;1(1):e000014.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4613168
http://www.ncbi.nlm.nih.gov/pubmed/26509049?tool=bestpractice.com
Los pacientes que reciben corticosteroides a largo plazo deben someterse a una evaluación del riesgo de fractura al inicio de la terapia y cada 1-2 años mientras continúe el tratamiento con corticosteroides.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
El tratamiento y la prevención de la osteoporosis inducida por corticosteroides se basan en la edad y el riesgo de fractura, que va de bajo a muy alto riesgo. Ver Criterios diagnósticos.
[Figure caption and citation for the preceding image starts]: Tratamiento de la osteoporosis inducida por glucocorticoidesCreado por BMJ Knowledge Centre [Citation ends].
Cambios en el estilo de vida y suplementos
El American College of Rheumatology (ACR) recomienda que todos los adultos que tomen prednisolona a una dosis ≥2.5 mg/día durante ≥3 meses optimicen la ingesta de calcio y vitamina D (con suplementos si es necesario) y realicen modificaciones en el estilo de vida (p. ej., dieta equilibrada, mantenimiento del peso en el intervalo recomendado, abandono del tabaco, ejercicio regular con pesas o entrenamiento de resistencia, limitación de la ingesta de alcohol a 1-2 bebidas alcohólicas al día).[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Estas medidas deben utilizarse en combinación con intervenciones farmacológicas para los pacientes con riesgo de fractura de moderado a muy alto, sin embargo no se recomienda ningún tratamiento adicional para los pacientes con bajo riesgo de fractura.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Bifosfonatos
Se debe considerar la posibilidad de utilizar bifosfonatos en todos los pacientes que sigan un tratamiento con corticosteroides durante más de tres meses y que reciban entre 2.5 y ≥7.5 mg/día de prednisolona, así como en los que presenten antecedentes de fracturas previas.[24]Gregson CL, Armstrong DJ, Bowden J, et al. UK clinical guideline for the prevention and treatment of osteoporosis. Arch Osteoporos. 2022 Apr 5;17(1):58.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8979902
http://www.ncbi.nlm.nih.gov/pubmed/35378630?tool=bestpractice.com
[66]Hsu E, Nanes M. Advances in treatment of glucocorticoid-induced osteoporosis. Curr Opin Endocrinol Diabetes Obes. 2017 Dec;24(6):411-7.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5836323
http://www.ncbi.nlm.nih.gov/pubmed/28857847?tool=bestpractice.com
El ACR recomienda los bifosfonatos orales o intravenosos para adultos con riesgo moderado, alto o muy alto de fractura que reciben corticosteroides a largo plazo.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Para los adultos de ≥40 años con riesgo alto o muy alto de fractura, se recomienda condicionalmente la segunda línea de bifosfonatos en función de la evidencia de mejorías superiores de la DMO con análogos de la hormona paratiroidea y denosumab.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Los pacientes con enfermedad renal crónica (TFG estimada <35 mL/minuto) generalmente no deben recibir tratamiento con bifosfonatos.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Para las mujeres en edad fértil que no planean un embarazo durante el tratamiento de la osteoporosis, se recomienda un bifosfonato oral o intravenoso, pero debe utilizarse con precaución debido a los posibles efectos adversos para los huesos del feto.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Los pacientes tratados con bifosfonatos orales o intravenosos que presentan un riesgo de fractura de bajo a moderado y suspenden el tratamiento con corticosteroides no requieren terapia secuencial.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Sin embargo, si se produce una nueva fractura después de ≥12 meses de tratamiento inicial con bifosfonatos, el tratamiento secuencial puede incluir denosumab, un análogo de la hormona paratiroidea o romosozumab.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Si reciben tratamiento con terapia secuencial con denosumab, los pacientes requerirán tratamiento adicional con bifosfonatos 6-7 meses después de la última dosis de denosumab para prevenir una rápida pérdida ósea y el desarrollo de nuevas fracturas vertebrales por compresión.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Se ha demostrado que los bifosfonatos ácido alendrónico y risedronato reducen eficazmente las fracturas óseas en pacientes con osteoporosis inducida por corticosteroides.[198]van Brussel MS, Bultink IE, Lems WF. Prevention of glucocorticoid-induced osteoporosis. Expert Opin Pharmacother. 2009 Apr;10(6):997-1005.
http://www.ncbi.nlm.nih.gov/pubmed/19351276?tool=bestpractice.com
[  ]
How do bisphosphonates compare with placebo for improving outcomes in people with steroid-induced osteoporosis?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.1617/fullMostrarme la respuesta[Evidencia A]afadd294-f705-412a-b6d4-04a1a35a927cccaACómo se comparan los bifosfonatos con el placebo para mejorar los resultados en personas con osteoporosis inducida por corticosteroides?
]
How do bisphosphonates compare with placebo for improving outcomes in people with steroid-induced osteoporosis?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.1617/fullMostrarme la respuesta[Evidencia A]afadd294-f705-412a-b6d4-04a1a35a927cccaACómo se comparan los bifosfonatos con el placebo para mejorar los resultados en personas con osteoporosis inducida por corticosteroides?
Análogos de la hormona paratiroidea
El ACR recomienda un análogo de la hormona paratiroidea (p. ej., teriparatida, abaloparatida) como opción de primera línea para el tratamiento de adultos de ≥40 años con riesgo alto a muy alto de fractura, incluidos los pacientes en tratamiento con corticosteroides en dosis muy altas (dosis inicial de prednisolona ≥30 mg/día o dosis acumulada de prednisolona ≥5 g en 1 año).[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Para los pacientes con un riesgo moderado de fractura, se puede considerar un análogo de la hormona paratiroidea como una opción alternativa.[24]Gregson CL, Armstrong DJ, Bowden J, et al. UK clinical guideline for the prevention and treatment of osteoporosis. Arch Osteoporos. 2022 Apr 5;17(1):58.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8979902
http://www.ncbi.nlm.nih.gov/pubmed/35378630?tool=bestpractice.com
[199]Anastasilaki E, Paccou J, Gkastaris K, et al. Glucocorticoid-induced osteoporosis: an overview with focus on its prevention and management. Hormones (Athens). 2023 Dec;22(4):611-22.
http://www.ncbi.nlm.nih.gov/pubmed/37755658?tool=bestpractice.com
El ACR lo recomienda como una opción de primera línea igual para adultos con un riesgo moderado de fractura, y enfatiza la toma de decisiones compartida para la elección del tratamiento inicial, teniendo en cuenta las preferencias y comorbilidades del clínico y del paciente.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Los análogos de la hormona paratiroidea deben evitarse para el tratamiento de adultos jóvenes con placas de crecimiento abiertas.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Se ha demostrado que el tratamiento con teriparatida aumenta la DMO de las vértebras lumbares en comparación con el denosumab, y reduce el riesgo de fractura vertebral, en comparación con los bifosfonatos, en pacientes con osteoporosis inducida por corticosteroides.[200]Yuan C, Liang Y, Zhu K, et al. Clinical efficacy of denosumab, teriparatide, and oral bisphosphonates in the prevention of glucocorticoid-induced osteoporosis: a systematic review and meta-analysis. J Orthop Surg Res. 2023 Jun 22;18(1):447.
https://josr-online.biomedcentral.com/articles/10.1186/s13018-023-03920-4
http://www.ncbi.nlm.nih.gov/pubmed/37349750?tool=bestpractice.com
Los ensayos preclínicos y con animales sugieren que la abaloparatida puede mitigar o prevenir la pérdida ósea provocada por los glucocorticoides y mejorar la curación de las fracturas.[201]Brent MB. Abaloparatide: a review of preclinical and clinical studies. Eur J Pharmacol. 2021 Oct 15;909:174409.
https://www.doi.org/10.1016/j.ejphar.2021.174409
http://www.ncbi.nlm.nih.gov/pubmed/34364879?tool=bestpractice.com
No se dispone de datos de ensayos clínicos sobre la evaluación de la abaloparatida para el tratamiento de la osteoporosis inducida por corticosteroides.
Debe advertirse a los pacientes de que la interrupción del tratamiento con análogos de la hormona paratiroidea sin transición a otra terapia puede provocar pérdida ósea. Esto puede prevenirse iniciando el tratamiento con bifosfonatos orales o intravenosos en pacientes con riesgo de fractura de bajo a moderado cuando se suspenden los análogos de la hormona paratiroidea y los corticosteroides.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Si se produce una fractura cuando se ha tratado al paciente con un análogo de la hormona paratiroidea durante ≥12 meses, la terapia secuencial puede incluir bifosfonatos orales o intravenosos o denosumab.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Si reciben tratamiento con terapia secuencial con denosumab, los pacientes requerirán tratamiento adicional con bifosfonatos 6-7 meses después de la última dosis de denosumab para prevenir una rápida pérdida ósea y el desarrollo de nuevas fracturas vertebrales por compresión.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
denosumab
El denosumab está aprobado para el tratamiento de la osteoporosis inducida por glucocorticoides, tanto en hombres como en mujeres con alto riesgo de fractura, incluidos aquellos con antecedentes de fracturas osteoporóticas, múltiples factores clínicos de riesgo de fractura y personas que no toleran o no han respondido a otros tratamientos (véase la advertencia de la FDA en la información sobre denosumab en la sección de mujeres posmenopáusicas).
El ACR recomienda el denosumab como opción de primera línea para los adultos con un riesgo moderado de fractura y los adultos de ≥40 años con alto riesgo de fractura.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Para adultos de ≥40 años con riesgo muy alto de fracturas, se recomienda denosumab como opción de segunda línea.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
El denosumab debe utilizarse con precaución en mujeres en edad fértil debido a los posibles efectos adversos para el feto, debe evitarse el embarazo hasta 5 meses después de la última dosis.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Debe evitarse el tratamiento con denosumab en adultos jóvenes con placas de crecimiento abiertas.
Una revisión sistemática informó que denosumab aumentó significativamente la DMO en la columna lumbar a los 6 meses, y en la columna lumbar y el cuello femoral a los 12 meses, en comparación con el tratamiento con bifosfonatos en pacientes con osteoporosis inducida por corticosteroides.[202]Yamaguchi Y, Morita T, Kumanogoh A. The therapeutic efficacy of denosumab for the loss of bone mineral density in glucocorticoid-induced osteoporosis: a meta-analysis. Rheumatol Adv Pract. 2020;4(1):rkaa008.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7197806
http://www.ncbi.nlm.nih.gov/pubmed/32373775?tool=bestpractice.com
Los pacientes con osteoporosis inducida por corticosteroides tratados con denosumab con un riesgo de fractura de bajo a moderado cuando se interrumpe el tratamiento con denosumab y corticosteroides deben recibir 1-2 años de tratamiento secuencial con un bifosfonato para prevenir la pérdida ósea rápida.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Si se produce una nueva fractura cuando se ha tratado a los pacientes con denosumab ≥12 meses, la terapia secuencial puede incluir bifosfonatos orales o intravenosos o romosozumab.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Romosozumab
Romosozumab está aprobado para el tratamiento de la osteoporosis en mujeres posmenopáusicas con alto riesgo de fractura, o pacientes que han fracasado o son intolerantes a otra terapia disponible para la osteoporosis, pero no se ha evaluado para el tratamiento de la osteoporosis inducida por corticosteroides.[203]Taylor AD, Saag KG. Anabolics in the management of glucocorticoid-induced osteoporosis: an evidence-based review of long-term safety, efficacy and place in therapy. Core Evid. 2019 Aug 23;14:41-50.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6711555
http://www.ncbi.nlm.nih.gov/pubmed/31692480?tool=bestpractice.com
Sin embargo, el ACR recomienda condicionalmente el uso de romosozumab como tratamiento para adultos de edad ≥40 años con riesgo moderado a alto de fractura, incluidos los que toman una dosis elevada de corticosteroides (dosis inicial de prednisolona ≥30 mg/día o dosis acumulada de prednisolona ≥5 g en 1 año) sólo si no toleran todos los demás tratamientos.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
El romosozumab no se recomienda en pacientes de edad <40 años con un riesgo de fractura de moderado a alto, y solo debe considerarse su uso en personas que reciben corticosteroides en dosis altas si no se toleran otros tratamientos.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Los pacientes tratados con romosozumab que presenten un riesgo bajo o moderado de fractura cuando se interrumpa el tratamiento con romosozumab y corticosteroides necesitarán una terapia secuencial con bifosfonato oral o intravenoso, para las personas que sufren una nueva fractura después de ≥12 meses de tratamiento con romosozumab, se puede utilizar bifosfonato oral o intravenoso o denosumab para la terapia secuencial.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Los pacientes tratados con denosumab como terapia secuencial necesitarán otros 6-7 meses de tratamiento con bifosfonatos para evitar una pérdida ósea rápida y el desarrollo de nuevas fracturas vertebrales por compresión.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
raloxifeno
Se carece de evidencia sobre la eficacia del raloxifeno para tratar a pacientes con osteoporosis inducida por corticosteroides.[204]Popp AW, Isenegger J, Buergi EM, et al. Glucocorticosteroid-induced spinal osteoporosis: scientific update on pathophysiology and treatment. Eur Spine J. 2006 Jul;15(7):1035-49.
http://www.ncbi.nlm.nih.gov/pubmed/16474946?tool=bestpractice.com
Sin embargo, el ACR recomienda condicionalmente el raloxifeno como tratamiento para adultos de edad ≥40 años con riesgo moderado a alto de fractura, incluidas las personas que reciben una dosis elevada de corticosteroides (dosis inicial de prednisolona ≥30 mg/día o dosis acumulada de prednisolona ≥5 g en 1 año) solo si no toleran todos los demás tratamientos.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
El raloxifeno no se recomienda en pacientes de edad <40 años con un riesgo de fractura de moderado a alto, y solo debe considerarse su uso en las personas que reciben corticosteroides en dosis altas si no se toleran otros tratamientos.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Las pacientes tratadas con raloxifeno que presenten un riesgo bajo o moderado de fractura cuando se interrumpa el tratamiento con raloxifeno y corticosteroides no requerirán terapia secuencial.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com
Si se produce una nueva fractura tras un tratamiento con raloxifeno durante ≥12 meses, es necesario un tratamiento secuencial con bifosfonatos orales o intravenosos.[87]Humphrey MB, Russell L, Danila MI, et al. 2022 American College of Rheumatology guideline for the prevention and treatment of glucocorticoid-induced osteoporosis. Arthritis Rheumatol. 2023 Dec;75(12):2088-102.
https://acrjournals.onlinelibrary.wiley.com/doi/10.1002/art.42646
http://www.ncbi.nlm.nih.gov/pubmed/37845798?tool=bestpractice.com


 ]
[Evidencia A]
]
[Evidencia A]