Etiología
La etiopatogenia de la enfermedad de Crohn (EC) es multifactorial e incluye factores genéticos y ambientales.
Factores genéticos
En estudios de asociación del genoma completo se han identificado más de 71 loci de distinta susceptibilidad genética, con las asociaciones más fuertes entre CARD15 (familia del dominio de preselección de caspasas, miembro 15), que codifica la proteína de reconocimiento de agentes patógenos NOD2 (dominio de oligomerización por unión de nucleótidos que contiene la proteína 2), y otros loci, como el locus IBD5, el gen ATG16L1 de la autofagia (ATG16 autofagia 16-tipo 1) y el receptor de interleucina 23.[27][28][29] El genotipo puede influir también en la distribución de la enfermedad de Crohn (EC).[30]
Los loci de susceptibilidad y los factores de riesgo genéticos identificados representan <20% del riesgo hereditario de la enfermedad inflamatoria intestinal.[31][32][33]
Factores ambientales
Incluyen el tabaquismo, la píldora anticonceptiva oral, los antiinflamatorios no esteroideos, la exposición a los antibióticos, la dieta (poca fruta, poca verdura, poca fibra, mucho azúcar refinado, muchos alimentos ultraprocesados, mucha carne, pocos lácteos), estilo de vida sedentario y no ser amamantado.[22][23][24][25][26][34][35][36][37][38][39][40][41][42][43]
Las especies de Campylobacter se han asociado a la enfermedad inflamatoria intestinal incidente y activa, incluida la EC.[44][45]
Algunos estudios sugieren que la Mycobacterium avium paratuberculosis puede contribuir a aumentar el riesgo de EC.[46] Sin embargo, no se ha excluido una asociación casual.[47][48]
La deficiencia de vitamina D y de zinc puede complicar la EC; no se ha establecido un papel causal.[37]
Fisiopatología
Las teorías actuales sobre la fisiopatología de la EC indican un papel de los factores infecciosos, inmunológicos, ambientales, dietéticos y psicosociales en un individuo genética e inmunológicamente susceptible.[1][21][22][36][37][49][50]
La lesión inicial comienza como un infiltrado inflamatorio alrededor de las criptas intestinales que, posteriormente, se convierte en una ulceración de la mucosa superficial. La inflamación progresa hasta afectar capas más profundas y puede formar granulomas no caseificantes. Dichos granulomas afectan todas las capas de la pared intestinal y del mesenterio y los ganglios linfáticos regionales. El hallazgo de estos granulomas es altamente sugestivo de que se trata de EC, aunque si no están presentes, no puede excluirse el diagnóstico.[51][52]
Los primeros hallazgos endoscópicos incluyen hiperemia y edema de la mucosa inflamada. Esto avanza a úlceras profundas y aisladas ubicadas de forma transversal y longitudinal, lo que le da un aspecto empedrado. Estas lesiones a veces están separadas por la mucosa intestinal normal de forma discontinua (lesiones discontinuas).[4][Figure caption and citation for the preceding image starts]: Vista endoscópica de la ileítis de CrohnProporcionado por los doctores Wissam Bleibel, Bishal Mainali, Chandrashekhar Thukral, y Mark A. Peppercorn, los anteriores autores de este tema [Citation ends].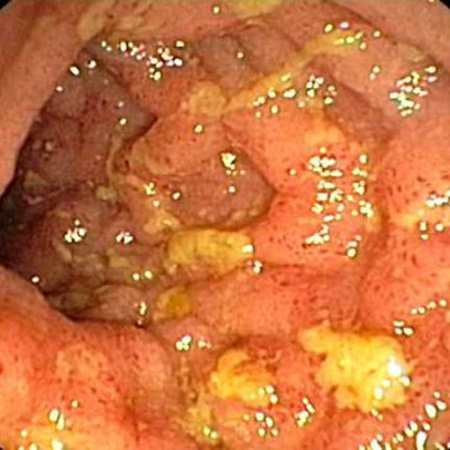 [Figure caption and citation for the preceding image starts]: Vista endoscópica del íleon terminal normalDe la colección personal de la Dra. Charlotte Ford, North Middlesex Hospital Trust, Londres, Reino Unido [Citation ends].
[Figure caption and citation for the preceding image starts]: Vista endoscópica del íleon terminal normalDe la colección personal de la Dra. Charlotte Ford, North Middlesex Hospital Trust, Londres, Reino Unido [Citation ends].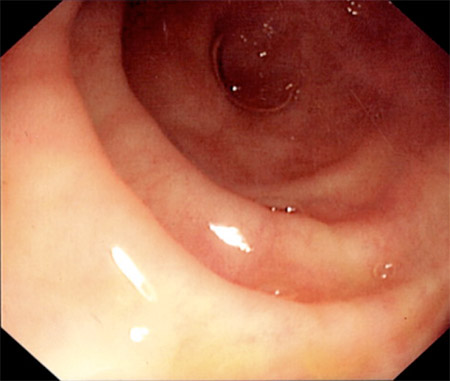
La EC es una enfermedad remitente recurrente con un patrón de daño intestinal acumulativo. La inflamación activa continua aumenta la probabilidad de complicaciones. La inflamación transmural crónica engrosa la pared intestinal y causa la cicatrización, estrechamiento luminal y formación de estenosis. Esto puede conducir a fistulización, formación de tractos sinusales, perforación y/o formación de abscesos. La inflamación crónica también daña la mucosa intestinal y da lugar a una deficiencia de la capacidad de absorción. Esto puede conducir a desnutrición, deshidratación y deficiencias de vitaminas y nutrientes.[10]
La afectación del íleon terminal interfiere con la absorción del ácido biliar, lo que puede provocar diarrea, , la deficiencia de vitaminas liposolubles y la formación de cálculos biliares.[7][53] El exceso de grasa en las heces se une al calcio, lo que causa un aumento de la absorción de oxalato y predispone a la formación de cálculos renales de oxalato.[54]
Además de las manifestaciones relacionadas con el tracto gastrointestinal (GI), la EC puede afectar diversos órganos y sistemas extraintestinales, que incluyen la piel, las articulaciones, la boca, los ojos, el hígado y los conductos biliares.[4][5][6][7] Algunos de estos trastornos poseen mecanismos autoinmunitarios.[4][5]
Clasificación
Clasificación de Viena para la enfermedad de Crohn (EC)[2]
Clasifica a los pacientes con enfermedad de Crohn en 24 subgrupos.
Edad al momento del diagnóstico: cuando se establece de forma definitiva mediante radiología, endoscopia, patología o cirugía.
A1 <40 años de edad.
A2 40 años de edad o más
Localización: máxima extensión de la afectación de la enfermedad en cualquier momento antes de la primera resección. La afectación mínima para una localización es una lesión o ulceración aftosa. Es necesario realizar una exploración, tanto del intestino delgado, como del grueso para una clasificación.
L1 - íleon terminal - limitado al íleon terminal.
L2 - colon - cualquier localización colónica entre el ciego y el recto, sin afectación del intestino delgado ni del tracto gastrointestinal (GI) superior.
L3, ileocólica: enfermedad del íleon y cualquier ubicación entre el colon ascendente y el recto.
L4, tracto gastrointestinal superior: cualquier enfermedad proximal al íleon terminal, independientemente de la afectación adicional del íleon terminal o del colon.
Comportamiento
B1: sin estrechamiento, no penetrante.
B2, con estrechamiento: estrechamiento luminal constante demostrado por métodos radiológicos, endoscópicos o quirúrgicos-patológicos, con dilatación preestenótica o signos o síntomas obstructivos, sin presencia de enfermedad penetrante, en cualquier momento de la evolución de la enfermedad.
B3, penetrante: aparición de fístulas intraabdominales o perianales, masas inflamatorias y/o abscesos en cualquier momento de la evolución de la enfermedad. Se incluyen las úlceras perianales. Se excluyen las complicaciones intraabdominales postoperatorias y los papilomas cutáneos.
Clasificación de Montreal para la CD[3]
La revisión de Montreal de la clasificación de Viena no cambia los tres parámetros predominantes, pero introduce modificaciones en cada categoría para permitir: el inicio temprano; la coexistencia de la enfermedad gastrointestinal (GI) del tracto superior con la enfermedad más distal; la separación de la enfermedad perianal en una subclasificación; un tiempo estipulado que debe establecerse antes de clasificar el comportamiento de la enfermedad.
Edad en el momento del diagnóstico
A1 menores de 16 años
A2 entre 17 y 40 años
A3 por encima de los 40 años
Ubicación
L1 ileal
L2 colónica
L3 ileocolónico
L4 enfermedad superior aislada (L4 es un modificador que puede añadirse a L1 a L3 cuando hay enfermedad gastrointestinal alta concomitante)
Comportamiento
B1 sin estrechamiento, no penetrante
Con estrechamiento B2
B3 penetrante
P modificador de la enfermedad periférica (se añade a B1 a B3 cuando hay enfermedad perianal concomitante)
El uso de este contenido está sujeto a nuestra cláusula de exención de responsabilidad