A chave para o diagnóstico da supressão adrenal iatrogênica é constatar a exposição a glicocorticoides exógenos ou outros agentes desencadeantes.
Os pacientes que recebem doses suprafisiológicas de glicocorticoides orais para doença responsiva a corticosteroide e que apresentam uma aparência com características cushingoides (obesidade centrípeta com uma face redonda ou fácies de lua cheia, adiposidades dorsocervicais e estrias) devem ter um reconhecimento imediato de uma possível supressão no eixo hipotálamo-hipófise-adrenal (HHA).[37]Beuschlein F, Else T, Bancos I, et al. European Society of Endocrinology and Endocrine Society Joint Clinical Guideline: diagnosis and therapy of glucocorticoid-induced adrenal insufficiency. J Clin Endocrinol Metab. 2024 Jun 17;109(7):1657-83.
https://academic.oup.com/jcem/article/109/7/1657/7667842?login=false
http://www.ncbi.nlm.nih.gov/pubmed/38724043?tool=bestpractice.com
A supressão do eixo HHA foi descrita após somente 4 a 5 dias de corticoterapia e como uma consequência da administração local de glicocorticoides.[25]Streck WF, Lockwood DH. Pituitary adrenal recovery following short-term suppression with corticosteroids. Am J Med. 1979 Jun;66(6):910-4.
http://www.ncbi.nlm.nih.gov/pubmed/222143?tool=bestpractice.com
[26]Villabona CV, Koh C, Panergo J, et al. Adrenocorticotropic hormone stimulation test during high-dose glucocorticoid therapy. Endocr Pract. 2009 Mar;15(2):122-7.
http://www.ncbi.nlm.nih.gov/pubmed/19289322?tool=bestpractice.com
Em pacientes que recebem injeções intra-articulares de glicocorticoides, a recuperação do eixo HHA pode levar de 1 a 4 semanas, dependendo da dose e da frequência das injeções.[10]Johnston PC, Lansang MC, Chatterjee S, et al. Intra-articular glucocorticoid injections and their effect on hypothalamic-pituitary-adrenal (HPA)-axis function. Endocrine. 2015 Mar;48(2):410-6.
http://www.ncbi.nlm.nih.gov/pubmed/25182149?tool=bestpractice.com
Embora alguns pacientes apresentem características cushingoides e alguns apresentem sintomas óbvios de insuficiência adrenal quando o agente corticosteroide desencadeador é rapidamente desmamado ou interrompido, a supressão do eixo HHA pode ser sutil. Nem todos os pacientes apresentam características cushingoides, sendo necessário um alto índice de suspeita.
Os pacientes com supressão adrenal correm risco de crise adrenal se o tratamento com glicocorticoide for suspenso subitamente ou se não for aumentado em períodos de estresse elevado (por exemplo, doença febril, trauma ou cirurgia). Os pacientes com uma história compatível com supressão adrenal e que apresentam características de crise adrenal (ou seja, hipotensão, insuficiência circulatória) devem ser tratados com urgência. Os exames diagnósticos não devem atrasar o tratamento.[37]Beuschlein F, Else T, Bancos I, et al. European Society of Endocrinology and Endocrine Society Joint Clinical Guideline: diagnosis and therapy of glucocorticoid-induced adrenal insufficiency. J Clin Endocrinol Metab. 2024 Jun 17;109(7):1657-83.
https://academic.oup.com/jcem/article/109/7/1657/7667842?login=false
http://www.ncbi.nlm.nih.gov/pubmed/38724043?tool=bestpractice.com
[38]Arlt W; Society for Endocrinology Clinical Committee. Society for Endocrinology endocrine emergency guidance: emergency management of acute adrenal insufficiency (adrenal crisis) in adult patients. Endocr Connect. 2016 Sep;5(5):G1-3.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5314805
http://www.ncbi.nlm.nih.gov/pubmed/27935813?tool=bestpractice.com
História
Os pacientes que recebem doses suprafisiológicas de glicocorticoides têm o risco de apresentar supressão adrenal, especialmente se forem potentes e/ou se foram administrados por um período prolongado.[1]Prete A, Bancos I. Glucocorticoid induced adrenal insufficiency. BMJ. 2021 Jul 12;374:n1380.
https://www.doi.org/10.1136/bmj.n1380
http://www.ncbi.nlm.nih.gov/pubmed/34253540?tool=bestpractice.com
[8]Liu D, Ahmet A, Ward L, et al. A practical guide to the monitoring and management of the complications of systemic corticosteroid therapy. Allergy Asthma Clin Immunol. 2013 Aug 15;9(1):30.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3765115
http://www.ncbi.nlm.nih.gov/pubmed/23947590?tool=bestpractice.com
[39]Henzen C, Suter A, Lerch E, et al. Suppression and recovery of adrenal response after short-term, high-dose glucocorticoid treatment. Lancet. 2000 Feb 12;355(9203):542-5.
http://www.ncbi.nlm.nih.gov/pubmed/10683005?tool=bestpractice.com
No entanto, os corticosteroides não sistêmicos também podem causar supressão adrenal.[1]Prete A, Bancos I. Glucocorticoid induced adrenal insufficiency. BMJ. 2021 Jul 12;374:n1380.
https://www.doi.org/10.1136/bmj.n1380
http://www.ncbi.nlm.nih.gov/pubmed/34253540?tool=bestpractice.com
Os pacientes podem precisar ser questionados; por exemplo, sobre colírios, pulverizadores nasais, inaladores para problemas respiratórios ou injeções para a dor.
A história deve ser direcionada para detectar o padrão do uso de glicocorticoides. É importante perguntar sobre doenças para as quais os corticosteroides são comumente prescritos e sobre vias de administração oral ou alternativas como:[10]Johnston PC, Lansang MC, Chatterjee S, et al. Intra-articular glucocorticoid injections and their effect on hypothalamic-pituitary-adrenal (HPA)-axis function. Endocrine. 2015 Mar;48(2):410-6.
http://www.ncbi.nlm.nih.gov/pubmed/25182149?tool=bestpractice.com
[11]Iranmanesh A, Gullapalli D, Singh R, et al. Hypothalamo-pituitary-adrenal axis after a single epidural triamcinolone injection. Endocrine. 2017 Aug;57(2):308-13.
http://www.ncbi.nlm.nih.gov/pubmed/28674775?tool=bestpractice.com
[12]Ahmet A, Kim H, Spier S. Adrenal suppression: a practical guide to the screening and management of this under-recognized complication of inhaled corticosteroid therapy. Allergy Asthma Clin Immunol. 2011 Aug 25;7(1):13.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3177893
http://www.ncbi.nlm.nih.gov/pubmed/21867553?tool=bestpractice.com
[13]Wlodarczyk JH, Gibson PG, Caeser M. Impact of inhaled corticosteroids on cortisol suppression in adults with asthma: a quantitative review. Ann Allergy Asthma Immunol. 2008 Jan;100(1):23-30.
http://www.ncbi.nlm.nih.gov/pubmed/18254478?tool=bestpractice.com
[14]Scutelnicu A, Panaitescu AM, Ciobanu AM, et al. Iatrogenic Cushing's syndrome as a consequence of nasal use of betamethasone spray during pregnancy. Acta Endocrinol (Buchar). 2020 Oct-Dec;16(4):511-7.
http://www.ncbi.nlm.nih.gov/pubmed/34084246?tool=bestpractice.com
[15]Güven A. Different potent glucocorticoids, different routes of exposure but the same result: iatrogenic Cushing’s syndrome and adrenal insufficiency. J Clin Res Pediatr Endocrinol. 2020 Nov 25;12(4):383-92.
https://www.doi.org/10.4274/jcrpe.galenos.2020.2019.0220
http://www.ncbi.nlm.nih.gov/pubmed/32431136?tool=bestpractice.com
[16]Nieman LK. Consequences of systemic absorption of topical glucocorticoids. J Am Acad Dermatol. 2011 Jul;65(1):250-2.
http://www.ncbi.nlm.nih.gov/pubmed/21679844?tool=bestpractice.com
Corticosteroides inalatórios para asma ou doença pulmonar obstrutiva crônica
Corticosteroides intranasais para rinite alérgica
Corticosteroides tópicos para o tratamento de quadros clínicos dermatológicos
Corticosteroides intra-articulares e epidurais para doenças reumatológicas ou distúrbios relacionados à dor.
As doses equivalentes de hidrocortisona, prednisolona, prednisona e dexametasona são:[Figure caption and citation for the preceding image starts]: Equivalência de dose para glicocorticoidesCriada por MC Lansang e SL Quinn [Citation ends].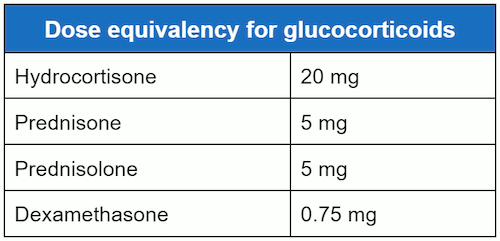 Outras fontes de corticosteroides prescritos, como enemas ou espumas retais para doença inflamatória intestinal, também devem ser buscadas. Também devem ser obtidas informações adicionais como o tipo, a dose, a via de administração e a duração do tratamento com corticosteroide. De forma menos comum, os pacientes fornecem uma história de tomar medicamentos que atuam no receptor de glicocorticoide, como o acetato de megestrol ou medroxiprogesterona.[1]Prete A, Bancos I. Glucocorticoid induced adrenal insufficiency. BMJ. 2021 Jul 12;374:n1380.
https://www.doi.org/10.1136/bmj.n1380
http://www.ncbi.nlm.nih.gov/pubmed/34253540?tool=bestpractice.com
[17]Delitala AP, Fanciulli G, Maioli M, et al. Primary symptomatic adrenal insufficiency induced by megestrol acetate. Neth J Med. 2013 Jan;71(1):17-21.
http://www.ncbi.nlm.nih.gov/pubmed/23412818?tool=bestpractice.com
[18]Malik KJ, Wakelin K, Dean S, et al. Cushing's syndrome and hypothalamic-pituitary adrenal axis suppression induced by medroxyprogesterone acetate. Ann Clin Biochem. 1996 May;33 (Pt 3):187-9.
http://www.ncbi.nlm.nih.gov/pubmed/8791979?tool=bestpractice.com
Outras fontes de corticosteroides prescritos, como enemas ou espumas retais para doença inflamatória intestinal, também devem ser buscadas. Também devem ser obtidas informações adicionais como o tipo, a dose, a via de administração e a duração do tratamento com corticosteroide. De forma menos comum, os pacientes fornecem uma história de tomar medicamentos que atuam no receptor de glicocorticoide, como o acetato de megestrol ou medroxiprogesterona.[1]Prete A, Bancos I. Glucocorticoid induced adrenal insufficiency. BMJ. 2021 Jul 12;374:n1380.
https://www.doi.org/10.1136/bmj.n1380
http://www.ncbi.nlm.nih.gov/pubmed/34253540?tool=bestpractice.com
[17]Delitala AP, Fanciulli G, Maioli M, et al. Primary symptomatic adrenal insufficiency induced by megestrol acetate. Neth J Med. 2013 Jan;71(1):17-21.
http://www.ncbi.nlm.nih.gov/pubmed/23412818?tool=bestpractice.com
[18]Malik KJ, Wakelin K, Dean S, et al. Cushing's syndrome and hypothalamic-pituitary adrenal axis suppression induced by medroxyprogesterone acetate. Ann Clin Biochem. 1996 May;33 (Pt 3):187-9.
http://www.ncbi.nlm.nih.gov/pubmed/8791979?tool=bestpractice.com
Observe que os tratamentos para eczema de venda livre, os cremes clareadores para pele e os medicamentos fitoterápicos podem conter corticosteroides
Os pacientes devem ser questionados sobre medicamentos concomitantes. Alguns podem interferir no metabolismo dos glicocorticoides.[1]Prete A, Bancos I. Glucocorticoid induced adrenal insufficiency. BMJ. 2021 Jul 12;374:n1380.
https://www.doi.org/10.1136/bmj.n1380
http://www.ncbi.nlm.nih.gov/pubmed/34253540?tool=bestpractice.com
O CYP3A4 é a via primária para o metabolismo da maioria dos glicocorticoides prescritos, portanto, os inibidores do CYP3A4 aumentarão a exposição aos glicocorticoides.[1]Prete A, Bancos I. Glucocorticoid induced adrenal insufficiency. BMJ. 2021 Jul 12;374:n1380.
https://www.doi.org/10.1136/bmj.n1380
http://www.ncbi.nlm.nih.gov/pubmed/34253540?tool=bestpractice.com
Por exemplo, o medicamento antirretroviral ritonavir aumenta as concentrações plasmáticas dos metabólitos da prednisona (prednisolona).[1]Prete A, Bancos I. Glucocorticoid induced adrenal insufficiency. BMJ. 2021 Jul 12;374:n1380.
https://www.doi.org/10.1136/bmj.n1380
http://www.ncbi.nlm.nih.gov/pubmed/34253540?tool=bestpractice.com
Outros inibidores fortes do CYP3A4 incluem antifúngicos, como itraconazol e cetoconazol, e tratamentos contra o câncer, como ceritinibe e idelalisibe.[1]Prete A, Bancos I. Glucocorticoid induced adrenal insufficiency. BMJ. 2021 Jul 12;374:n1380.
https://www.doi.org/10.1136/bmj.n1380
http://www.ncbi.nlm.nih.gov/pubmed/34253540?tool=bestpractice.com
O agente de indução anestésico etomidato pode interferir na síntese de esteroides adrenais e aumentar o risco de insuficiência adrenal e mortalidade em pacientes com sepse.[19]Chan CM, Mitchell AL, Shorr AF. Etomidate is associated with mortality and adrenal insufficiency in sepsis: a meta-analysis*. Crit Care Med. 2012 Nov;40(11):2945-53.
http://www.ncbi.nlm.nih.gov/pubmed/22971586?tool=bestpractice.com
Esta lista não é exaustiva; consulte sua fonte local de informações sobre medicamentos.
Em pacientes com supressão adrenal induzida por glicocorticoides, a interação com medicamentos que induzem o CYP3A4 diminuirá os níveis de glicocorticoides sintéticos e pode causar sintomas de insuficiência adrenal. Exemplos de agentes que induzem o CYP3A4 incluem carbamazepina, fenobarbital, fenitoína, primidona, rifampicina e nafcilina.[1]Prete A, Bancos I. Glucocorticoid induced adrenal insufficiency. BMJ. 2021 Jul 12;374:n1380.
https://www.doi.org/10.1136/bmj.n1380
http://www.ncbi.nlm.nih.gov/pubmed/34253540?tool=bestpractice.com
Esta lista não é exaustiva; consulte sua fonte local de informações sobre medicamentos.
Raramente, os pacientes apresentam uma história de remoção de carcinoma ou adenoma hipofisário que causou a síndrome de Cushing.[20]Bertagna C, Orth DN. Clinical and laboratory findings and results of therapy in 58 patients with adrenocortical tumors admitted to a single medical center (1951 to 1978). Am J Med. 1981 Nov;71(5):855-75.
http://www.ncbi.nlm.nih.gov/pubmed/6272575?tool=bestpractice.com
[21]Luton JP, Cerdas S, Billaud L, et al. Clinical features of adrenocortical carcinoma, prognostic factors, and the effect of mitotane therapy. N Engl J Med. 1990 Apr 26;322(17):1195-201.
https://www.nejm.org/doi/full/10.1056/NEJM199004263221705#t=articleTop
http://www.ncbi.nlm.nih.gov/pubmed/2325710?tool=bestpractice.com
Sintomas
Sintomas de insuficiência adrenal podem estar presentes, especialmente quando o agente desencadeante é rapidamente reduzido ou interrompido.
Os sintomas de insuficiência adrenal geralmente são vagos. Eles incluem fadiga, anorexia, náuseas e/ou vômitos e perda de peso.[1]Prete A, Bancos I. Glucocorticoid induced adrenal insufficiency. BMJ. 2021 Jul 12;374:n1380.
https://www.doi.org/10.1136/bmj.n1380
http://www.ncbi.nlm.nih.gov/pubmed/34253540?tool=bestpractice.com
[37]Beuschlein F, Else T, Bancos I, et al. European Society of Endocrinology and Endocrine Society Joint Clinical Guideline: diagnosis and therapy of glucocorticoid-induced adrenal insufficiency. J Clin Endocrinol Metab. 2024 Jun 17;109(7):1657-83.
https://academic.oup.com/jcem/article/109/7/1657/7667842?login=false
http://www.ncbi.nlm.nih.gov/pubmed/38724043?tool=bestpractice.com
[38]Arlt W; Society for Endocrinology Clinical Committee. Society for Endocrinology endocrine emergency guidance: emergency management of acute adrenal insufficiency (adrenal crisis) in adult patients. Endocr Connect. 2016 Sep;5(5):G1-3.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5314805
http://www.ncbi.nlm.nih.gov/pubmed/27935813?tool=bestpractice.com
[40]National Institute for Health and Care Excellence. Adrenal insufficiency: identification and management. Aug 2024 [internet publication].
https://www.nice.org.uk/guidance/ng243/chapter/Recommendations
Tontura, sintomas ortostáticos, mialgias e artralgias podem estar presentes. A dor abdominal pode ser leve ou intensa o suficiente para levar ao diagnóstico equivocado de abdome agudo.[8]Liu D, Ahmet A, Ward L, et al. A practical guide to the monitoring and management of the complications of systemic corticosteroid therapy. Allergy Asthma Clin Immunol. 2013 Aug 15;9(1):30.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3765115
http://www.ncbi.nlm.nih.gov/pubmed/23947590?tool=bestpractice.com
[38]Arlt W; Society for Endocrinology Clinical Committee. Society for Endocrinology endocrine emergency guidance: emergency management of acute adrenal insufficiency (adrenal crisis) in adult patients. Endocr Connect. 2016 Sep;5(5):G1-3.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5314805
http://www.ncbi.nlm.nih.gov/pubmed/27935813?tool=bestpractice.com
Os pacientes podem relatar sintomas consistentes com a síndrome de Cushing, incluindo fraqueza muscular, sintomas do sistema nervoso central como depressão, agitação ou distúrbios do sono.[37]Beuschlein F, Else T, Bancos I, et al. European Society of Endocrinology and Endocrine Society Joint Clinical Guideline: diagnosis and therapy of glucocorticoid-induced adrenal insufficiency. J Clin Endocrinol Metab. 2024 Jun 17;109(7):1657-83.
https://academic.oup.com/jcem/article/109/7/1657/7667842?login=false
http://www.ncbi.nlm.nih.gov/pubmed/38724043?tool=bestpractice.com
Pode haver uma história prévia de ganho de peso e aumento no apetite, face redonda, adiposidades dorsocervicais e facilidade de formação de hematomas.[37]Beuschlein F, Else T, Bancos I, et al. European Society of Endocrinology and Endocrine Society Joint Clinical Guideline: diagnosis and therapy of glucocorticoid-induced adrenal insufficiency. J Clin Endocrinol Metab. 2024 Jun 17;109(7):1657-83.
https://academic.oup.com/jcem/article/109/7/1657/7667842?login=false
http://www.ncbi.nlm.nih.gov/pubmed/38724043?tool=bestpractice.com
Outras afecções médicas como hipertensão e diabetes podem se tornar mais difíceis de controlar e menos responsivas ao tratamento medicamentoso.[8]Liu D, Ahmet A, Ward L, et al. A practical guide to the monitoring and management of the complications of systemic corticosteroid therapy. Allergy Asthma Clin Immunol. 2013 Aug 15;9(1):30.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3765115
http://www.ncbi.nlm.nih.gov/pubmed/23947590?tool=bestpractice.com
[41]Mehlich A, Bolanowski M, Mehlich D, et al. Medical treatment of Cushing's disease with concurrent diabetes mellitus. Front Endocrinol (Lausanne). 2023;14:1174119.
https://www.frontiersin.org/journals/endocrinology/articles/10.3389/fendo.2023.1174119/full
http://www.ncbi.nlm.nih.gov/pubmed/37139336?tool=bestpractice.com
A supressão adrenal na população pediátrica pode se manifestar como uma crise adrenal em momentos de estresse, mas tem maior probabilidade de ser sutil. Os sintomas inespecíficos de supressão adrenal em crianças são semelhantes aos observados em adultos; no entanto, as crianças também podem apresentar deficit de crescimento e hipoglicemia.[2]Goldbloom EB, Mokashi A, Cummings EA, et al. Symptomatic adrenal suppression among children in Canada. Arch Dis Child. 2017 Apr;102(4):338-9.
http://www.ncbi.nlm.nih.gov/pubmed/28320817?tool=bestpractice.com
[40]National Institute for Health and Care Excellence. Adrenal insufficiency: identification and management. Aug 2024 [internet publication].
https://www.nice.org.uk/guidance/ng243/chapter/Recommendations
Exame físico
Pacientes com risco de supressão adrenal que interromperam repentinamente glicocorticoides ou não aumentaram a dose durante períodos de estresse aumentado podem apresentar uma crise adrenal aguda com colapso devido a choque hipovolêmico, hipotensão, tontura postural e taquicardia.[37]Beuschlein F, Else T, Bancos I, et al. European Society of Endocrinology and Endocrine Society Joint Clinical Guideline: diagnosis and therapy of glucocorticoid-induced adrenal insufficiency. J Clin Endocrinol Metab. 2024 Jun 17;109(7):1657-83.
https://academic.oup.com/jcem/article/109/7/1657/7667842?login=false
http://www.ncbi.nlm.nih.gov/pubmed/38724043?tool=bestpractice.com
[38]Arlt W; Society for Endocrinology Clinical Committee. Society for Endocrinology endocrine emergency guidance: emergency management of acute adrenal insufficiency (adrenal crisis) in adult patients. Endocr Connect. 2016 Sep;5(5):G1-3.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5314805
http://www.ncbi.nlm.nih.gov/pubmed/27935813?tool=bestpractice.com
Em casos menos agudos, os pacientes podem ou não ter aparência cushingoide, e a hipertensão pode estar presente. Pode-se verificar fraqueza muscular. A cor da pele pode ser pletórica com estrias pigmentadas; pele fina com fácil formação de hematomas; e acne. Características associadas a elevações do hormônio adrenocorticotrópico (ACTH) como hiperpigmentação mucosal e cutânea não estarão presentes. Também estão provavelmente ausentes outros estigmas de doenças autoimunes associadas à insuficiência adrenal autoimune, como o vitiligo. Essas características ajudam a distinguir a supressão adrenal induzida endogenamente da supressão adrenal iatrogênica.
Suspeita de crise adrenal
Os exames diagnósticos não devem protelar o tratamento em casos de crise adrenal aguda.[37]Beuschlein F, Else T, Bancos I, et al. European Society of Endocrinology and Endocrine Society Joint Clinical Guideline: diagnosis and therapy of glucocorticoid-induced adrenal insufficiency. J Clin Endocrinol Metab. 2024 Jun 17;109(7):1657-83.
https://academic.oup.com/jcem/article/109/7/1657/7667842?login=false
http://www.ncbi.nlm.nih.gov/pubmed/38724043?tool=bestpractice.com
[38]Arlt W; Society for Endocrinology Clinical Committee. Society for Endocrinology endocrine emergency guidance: emergency management of acute adrenal insufficiency (adrenal crisis) in adult patients. Endocr Connect. 2016 Sep;5(5):G1-3.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5314805
http://www.ncbi.nlm.nih.gov/pubmed/27935813?tool=bestpractice.com
As investigações para suspeita de crise adrenal incluem o monitoramento rigoroso da pressão arterial, equilíbrio hídrico e sangue no estado basal (hemograma completo, eletrólitos, ureia, creatinina, função tireoidiana [o hipertireoidismo pode desencadear crise adrenal], cortisol e nível de ACTH). Se o paciente estiver estável hemodinamicamente, considere um rápido teste de estímulo com o hormônio adrenocorticotrófico.[38]Arlt W; Society for Endocrinology Clinical Committee. Society for Endocrinology endocrine emergency guidance: emergency management of acute adrenal insufficiency (adrenal crisis) in adult patients. Endocr Connect. 2016 Sep;5(5):G1-3.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5314805
http://www.ncbi.nlm.nih.gov/pubmed/27935813?tool=bestpractice.com
Achados de exames laboratoriais incidentais como hipoglicemia, hiperglicemia, hipocalemia, hipomagnesemia e alcalose de contração podem levantar suspeita de uso de glicocorticoides. Anormalidades eletrolíticas consistentes com a deficiência de mineralocorticoides como hipercalemia estão ausentes porque o sistema renina-angiotensina-aldosterona permanece intacto.
Enquanto os corticosteroides suprafisiológicos continuarem, a avaliação da função adrenal não é útil.[37]Beuschlein F, Else T, Bancos I, et al. European Society of Endocrinology and Endocrine Society Joint Clinical Guideline: diagnosis and therapy of glucocorticoid-induced adrenal insufficiency. J Clin Endocrinol Metab. 2024 Jun 17;109(7):1657-83.
https://academic.oup.com/jcem/article/109/7/1657/7667842?login=false
http://www.ncbi.nlm.nih.gov/pubmed/38724043?tool=bestpractice.com
Exame diagnóstico em um paciente que descontinua ou reduz a dose de corticosteroide para níveis fisiológicos ou subfisiológicos
A redução gradual dos corticosteroides é recomendada em pacientes que não necessitam mais de corticoterapia sistêmica.[37]Beuschlein F, Else T, Bancos I, et al. European Society of Endocrinology and Endocrine Society Joint Clinical Guideline: diagnosis and therapy of glucocorticoid-induced adrenal insufficiency. J Clin Endocrinol Metab. 2024 Jun 17;109(7):1657-83.
https://academic.oup.com/jcem/article/109/7/1657/7667842?login=false
http://www.ncbi.nlm.nih.gov/pubmed/38724043?tool=bestpractice.com
[38]Arlt W; Society for Endocrinology Clinical Committee. Society for Endocrinology endocrine emergency guidance: emergency management of acute adrenal insufficiency (adrenal crisis) in adult patients. Endocr Connect. 2016 Sep;5(5):G1-3.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5314805
http://www.ncbi.nlm.nih.gov/pubmed/27935813?tool=bestpractice.com
Pacientes com risco de insuficiência adrenal durante a redução gradual (por exemplo, aqueles com comorbidades) ou que apresentam sintomas de insuficiência adrenal são candidatos a um exame de cortisol sérico matinal (entre 9h e 10h). O exame deve ser realizado somente após atingir a faixa de uma dose diária equivalente fisiológica. Os valores de corte do cortisol sérico servem como guia. Embora valores mais altos de cortisol sérico indiquem recuperação do eixo HHA, as diretrizes observam que o valor do cortisol sérico matinal deve ser visto como uma continuidade.[37]Beuschlein F, Else T, Bancos I, et al. European Society of Endocrinology and Endocrine Society Joint Clinical Guideline: diagnosis and therapy of glucocorticoid-induced adrenal insufficiency. J Clin Endocrinol Metab. 2024 Jun 17;109(7):1657-83.
https://academic.oup.com/jcem/article/109/7/1657/7667842?login=false
http://www.ncbi.nlm.nih.gov/pubmed/38724043?tool=bestpractice.com
Os níveis de cortisol sérico aleatório não são recomendados como indicadores confiáveis do estado adrenal.
O cortisol salivar tem valor limitado no diagnóstico de insuficiência adrenal e não é recomendado rotineiramente.[42]El-Farhan N, Rees DA, Evans C. Measuring cortisol in serum, urine and saliva - are our assays good enough? Ann Clin Biochem. 2017 May;54(3):308-22.
https://journals.sagepub.com/doi/10.1177/0004563216687335?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
http://www.ncbi.nlm.nih.gov/pubmed/28068807?tool=bestpractice.com
Pode ser considerado em pacientes nos quais a flebotomia é impraticável ou difícil; ou naqueles com doença hepática com hipoalbuminemia e cirrose, onde os níveis de cortisol salivar se correlacionam melhor com a função adrenal e o cortisol plasmático livre do que o cortisol plasmático total.[43]Thevenot T, Borot S, Remy-Martin A, et al. Assessment of adrenal function in cirrhotic patients using concentration of serum-free and salivary cortisol. Liver Int. 2011 Mar;31(3):425-33.
http://www.ncbi.nlm.nih.gov/pubmed/21281437?tool=bestpractice.com
[44]Galbois A, Rudler M, Massard J, et al. Assessment of adrenal function in cirrhotic patients: salivary cortisol should be preferred. J Hepatol. 2010 Jun;52(6):839-45.
http://www.ncbi.nlm.nih.gov/pubmed/20385427?tool=bestpractice.com
Teste dinâmico: teste de estímulo com o hormônio adrenocorticotrófico
Um teste de estímulo pode ser considerado em um paciente com valor de cortisol sérico indeterminado.[37]Beuschlein F, Else T, Bancos I, et al. European Society of Endocrinology and Endocrine Society Joint Clinical Guideline: diagnosis and therapy of glucocorticoid-induced adrenal insufficiency. J Clin Endocrinol Metab. 2024 Jun 17;109(7):1657-83.
https://academic.oup.com/jcem/article/109/7/1657/7667842?login=false
http://www.ncbi.nlm.nih.gov/pubmed/38724043?tool=bestpractice.com
[38]Arlt W; Society for Endocrinology Clinical Committee. Society for Endocrinology endocrine emergency guidance: emergency management of acute adrenal insufficiency (adrenal crisis) in adult patients. Endocr Connect. 2016 Sep;5(5):G1-3.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5314805
http://www.ncbi.nlm.nih.gov/pubmed/27935813?tool=bestpractice.com
No entanto, o teste de estímulo com o hormônio adrenocorticotrófico de rotina não é recomendado para avaliar a recuperação do eixo HHA em pacientes que estão diminuindo ou descontinuando a corticoterapia.[37]Beuschlein F, Else T, Bancos I, et al. European Society of Endocrinology and Endocrine Society Joint Clinical Guideline: diagnosis and therapy of glucocorticoid-induced adrenal insufficiency. J Clin Endocrinol Metab. 2024 Jun 17;109(7):1657-83.
https://academic.oup.com/jcem/article/109/7/1657/7667842?login=false
http://www.ncbi.nlm.nih.gov/pubmed/38724043?tool=bestpractice.com
O teste com dose convencional de ACTH (1-24) (usando 250 microgramas de tetracosactida por injeção ou infusão) mede os níveis séricos de cortisol (antes e depois da administração de tetracosactida) para determinar a produção de cortisol adrenal. Um aumento apropriado no nível de cortisol dentro de 60 minutos descarta insuficiência adrenal.
As diretrizes sugerem não usar o protocolo de baixa dose (usando 1 micrograma de tetracosactida) devido à disponibilidade limitada ou inexistente de formulações comerciais dessa dose mais baixa.[37]Beuschlein F, Else T, Bancos I, et al. European Society of Endocrinology and Endocrine Society Joint Clinical Guideline: diagnosis and therapy of glucocorticoid-induced adrenal insufficiency. J Clin Endocrinol Metab. 2024 Jun 17;109(7):1657-83.
https://academic.oup.com/jcem/article/109/7/1657/7667842?login=false
http://www.ncbi.nlm.nih.gov/pubmed/38724043?tool=bestpractice.com
Além disso, a precisão do diagnóstico usando ACTH em baixa dose não é superior à do teste com dose convencional.
O teste de estímulo com o hormônio adrenocorticotrófico pode não ser confiável em pacientes com início recente de supressão do eixo HHA, em que as glândulas adrenais ainda não tiveram tempo suficiente para atrofiar. Se os pacientes estão tomando hidrocortisona ou prednisolona, é recomendável manter o tratamento durante 24 horas antes do teste para evitar falso-positivos. Outras preparações com corticosteroides, como a dexametasona, não apresentam reação cruzada com o ensaio de cortisol usado pelo teste de estímulo com o hormônio adrenocorticotrófico.
Testes dinâmicos menos comumente usados
O teste de tolerância à insulina (TTI) e o teste de metirapona noturna avaliam todo o eixo HHA e são capazes de avaliar a supressão adrenal parcial.[45]Grinspoon SK, Biller BM. Clinical review 62: laboratory assessment of adrenal insufficiency. J Clin Endocrinol Metab. 1994 Oct;79(4):923-31.
http://www.ncbi.nlm.nih.gov/pubmed/7962298?tool=bestpractice.com
O TTI pode ser usado se houver necessidade de determinar se o paciente tem deficiência de hormônio do crescimento concomitante. Tanto o TTI quanto os testes de metirapona podem ser usados para determinar se o paciente apresenta insuficiência adrenal secundária devido a uma lesão recente da hipófise (por exemplo, cirurgia da hipófise). Nessa situação, as glândulas adrenais ainda podem produzir uma resposta normal ao teste de estímulo com o hormônio adrenocorticotrófico por até 2 a 3 semanas após a lesão hipofisária em decorrência da reserva adrenal. Entretanto, o TTI pode revelar que a hipófise não é capaz de responder ao estresse.
O TTI depende da produção de hipoglicemia sintomática para estimular a liberação de cortisol. Há, portanto, um risco associado de convulsões hipoglicêmicas e o teste deve ser realizado sob observação estrita. Não é recomendado para pacientes frágeis ou idosos com doença cardiovascular ou convulsões. A metirapona pode, teoricamente, precipitar insuficiência adrenal aguda.
Rastreamento de urina para corticosteroides sintéticos
Em pacientes que apresentam uma vaga lembrança de ter recebido preparações de glicocorticoides locais (como a administração epidural ou intra-articular) suspeitas de provocarem a supressão adrenal, o rastreamento da urina para corticosteroides sintéticos irá confirmar a absorção sistêmica de glicocorticoides exógenos, mas não é diagnóstico de supressão adrenal.
[Figure caption and citation for the preceding image starts]: Tabela de testes para a supressão adrenalCriada por MC Lansang e SL Quinn [Citation ends].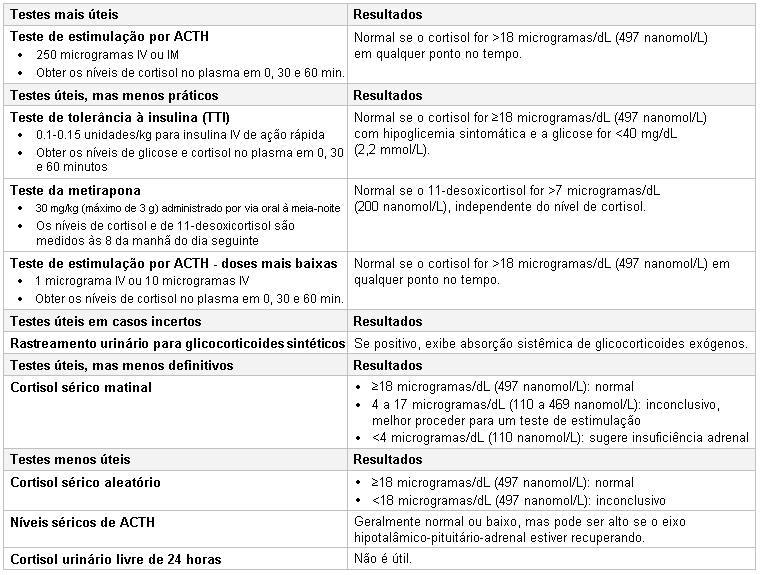
 Outras fontes de corticosteroides prescritos, como enemas ou espumas retais para doença inflamatória intestinal, também devem ser buscadas. Também devem ser obtidas informações adicionais como o tipo, a dose, a via de administração e a duração do tratamento com corticosteroide. De forma menos comum, os pacientes fornecem uma história de tomar medicamentos que atuam no receptor de glicocorticoide, como o acetato de megestrol ou medroxiprogesterona.[1][17][18]
Outras fontes de corticosteroides prescritos, como enemas ou espumas retais para doença inflamatória intestinal, também devem ser buscadas. Também devem ser obtidas informações adicionais como o tipo, a dose, a via de administração e a duração do tratamento com corticosteroide. De forma menos comum, os pacientes fornecem uma história de tomar medicamentos que atuam no receptor de glicocorticoide, como o acetato de megestrol ou medroxiprogesterona.[1][17][18]