Abordagem
O nódulo pulmonar solitário é um achado comum na radiografia torácica, e o uso disseminado de tomografia computadorizada (TC) aumentou ainda mais a detecção deste tipo de nódulo.[14][15][16] O objetivo inicial do médico é distinguir a lesão benigna da maligna. Se houver forte suspeita de neoplasia maligna, indica-se ressecção imediata da lesão, na maioria dos casos.
Critérios clínicos e achados radiográficos são utilizados para determinar a probabilidade de malignidade e para tomar decisões diagnósticas e terapêuticas. Não há uma única abordagem que se aplique a todos os pacientes.[17]
Os diagnósticos diferenciais mais comuns são anormalidades infecciosas e inflamatórias, vasculites como granulomatose com poliangiite (anteriormente conhecida como granulomatose de Wegener), câncer primário de pulmão e metástases pulmonares.
Critérios clínicos para malignidade
As características clínicas preditoras independentes de neoplasia maligna incluem idade avançada, tabagismo e história de câncer anterior.
Idade avançada
A probabilidade de malignidade em um nódulo pulmonar solitário está diretamente ligada à idade do paciente. A fim de quantificar a influência da idade na probabilidade de malignidade, razões de probabilidade podem ser calculadas. A razão de probabilidade é a razão da fração positiva verdadeira (sensibilidade) para a fração falso-positiva (1-especificidade). Uma razão de probabilidade alta é útil para incluir uma doença, uma razão de probabilidade baixa é útil para excluir uma doença, e uma razão de probabilidade de 1 não fornece informações adicionais sobre a probabilidade de malignidade.[18] A razão de probabilidade foi calculada como 0.05 para pessoas <30 anos de idade e 4.16 a 5.7 para pessoas com >70 anos de idade.[19][20] Uma análise multivariada demonstrou que a idade é um preditor independente de neoplasia maligna.[21]
Status de tabagismo
O fumo de cigarros é um fator de risco para câncer pulmonar e um preditor independente de neoplasia maligna em um nódulo pulmonar solitário.[21] Em uma pessoa que nunca fumou, a razão de probabilidade para malignidade em um nódulo pulmonar solitário foi calculada como 0.15 a 0.19.[19][20] Essa razão de probabilidade aumenta conforme o número de cigarros fumados aumenta (por exemplo, razão de probabilidade para 10-20 cigarros ao dia = 1.0 e razão de probabilidade para >40 cigarros ao dia = 3.9) e diminui com o aumento da duração de abstinência ao tabagismo (por exemplo, razão de probabilidade para abstinência <3 anos = 1.4 e razão de probabilidade para abstinência >13 anos = 0.1).
O fumo de charutos é um fator de risco independente para câncer pulmonar. O risco relativo de câncer pulmonar em fumantes de >5 charutos/dia é de 3.24 (IC 1.01 a 10.4).[22] As razões de probabilidade calculadas para neoplasia maligna em um nódulo pulmonar solitário em um fumante de charutos têm variado de 0.3 a 1.0. Portanto, um fumante de charutos com um nódulo pulmonar solitário é aproximadamente 2 a 5 vezes tão susceptível quanto um não fumante (que tem uma razão de probabilidade de 0.15 a 0.19) de ter uma neoplasia maligna.[19][20] As razões de probabilidade calculadas, consideradas isoladamente, não constituem provas suficientes para tirar conclusões sobre a natureza de um nódulo pulmonar solitário.
História pregressa de neoplasia maligna
Uma história de câncer prévio (>5 anos atrás) é um preditor independente de neoplasia maligna em um nódulo pulmonar solitário.[21] As razões de probabilidade em um paciente com malignidade prévia conhecida variam de 3.82 a 4.95, dependendo da definição da malignidade prévia.[19][21]
Considere outros fatores de risco conhecidos para câncer pulmonar
A presença de doença pulmonar obstrutiva moderada ou grave e a exposição a partículas finas ou poluição relacionada a óxido de enxofre estão associadas ao câncer pulmonar.[23][24] Outras características históricas, como a presença de hemoptise, têm sido utilizadas em modelos de predição clínica, mas ainda não mostraram ser preditores independentes de malignidade. A única combinação de características clínicas que poderiam justificar uma decisão do médico para observar sem investigação adicional é idade <30 em alguém que nunca tenha fumado na vida. Todas as demais características clínicas são usadas para formular uma probabilidade de câncer para direcionar decisões adicionais. As diretrizes recomendam o uso de modelos de risco validados derivados de estudos de rastreamento para estimar o risco.[4][25]
Critérios radiográficos para malignidade
Diversos critérios radiográficos são usados para estimar a probabilidade de malignidade em um nódulo pulmonar solitário.
Padrão de calcificação
Um padrão denso de calcificação condroide, laminado e central (geralmente chamado de calcificação em pipoca) ou um padrão difuso de calcificação sugere fortemente que o nódulo seja benigno.[Figure caption and citation for the preceding image starts]: Tomografia computadorizada (TC) mostrando granuloma calcificado benigno no lobo médio direito, estável há >10 anos. O paciente relatou pneumonia prévia no mesmo ladoDo acervo de Dr. George Tsaknis, MD, PhD, FRCP (Londres), MRQA, MAcadMEd, PGCert; usado com permissão [Citation ends].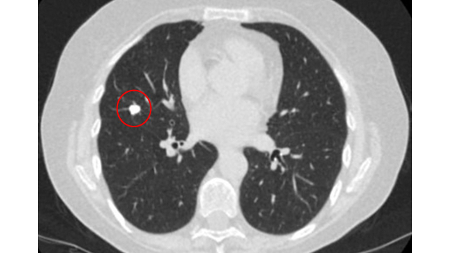
Uma razão de probabilidade calculada para malignidade com um padrão benigno de calcificação é próximo de zero.[19] Aproximadamente 10% dos nódulos malignos apresentam um padrão de calcificação não benigno (ver E e F).[26][Figure caption and citation for the preceding image starts]: A-D: padrões de calcificação de nódulos benignos; E, F: podem ser vistos em nódulos malignosMazzone P.J., Stoller J.K. Semin Thorac Cardiovasc Surg. 2002;14:250-260; usado com permissão [Citation ends].
Taxa de crescimento
Um nódulo pulmonar solitário com crescimento bastante lento (tempo de duplicação do volume >500 dias) ou, paradoxalmente, um nódulo pulmonar solitário com crescimento muito rápido (tempo de duplicação do volume <30 dias) sugere uma etiologia benigna, embora esta não seja uma regra absoluta. A ideia tradicional de 2 anos de estabilidade confirmando uma doença benigna é razoável para nódulos pulmonares solitários. No entanto, ela foi questionada e deve ser usada com cautela em casos de opacidade em vidro fosco.[27] O médico deve ter em mente que um aumento de aproximadamente 30% de diâmetro de uma lesão esférica na radiografia representa uma duplicação do volume.[28]
As diretrizes do Reino Unido fazem as seguintes recomendações em relação à taxa de crescimento:[4][29]
Nódulos sólidos: um tempo de duplicação do volume >600 dias não requer acompanhamento, enquanto um tempo de duplicação do volume <400 dias, ou crescimento nítido definido como um aumento de 25% ou mais no volume, sugere a necessidade de investigações diagnósticas.[Figure caption and citation for the preceding image starts]: Tomografia computadorizada (TC) mostrando nódulo solitário espiculado no lobo superior direito dentro de enfisema, em fumante atual com exposição prévia ao amianto. Observe a placa pleural visível no lado esquerdo. A histologia da ressecção revelou adenocarcinoma do pulmãoDo acervo de Dr. George Tsaknis, MD, PhD, FRCP (Londres), MRQA, MAcadMEd, PGCert; usado com permissão [Citation ends].
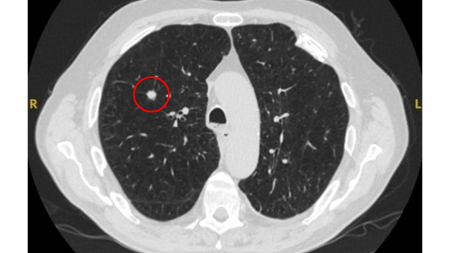
Nódulos com opacidade em vidro fosco: um crescimento de 2 mm no diâmetro máximo deve ser considerado potencialmente significativo, enquanto o desenvolvimento de um componente sólido sugere a necessidade de considerar uma investigação e/ou tratamento adicionais.[Figure caption and citation for the preceding image starts]: Tomografia computadorizada (TC) mostrando nódulo com opacidade em vidro fosco no lobo superior esquerdo. Este foi eventualmente ressecado após 2 anos de vigilância em decorrência de crescimento, e a histopatologia confirmou adenocarcinoma de pulmão com padrão mucinoso-lepídico mistoDo acervo de Dr. George Tsaknis, MD, PhD, FRCP (Londres), MRQA, MAcadMEd, PGCert; usado com permissão [Citation ends].
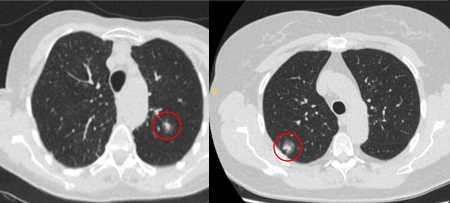
Nódulos semissólidos: o crescimento de um componente sólido sugere a necessidade de considerar uma investigação e/ou tratamento adicionais.[Figure caption and citation for the preceding image starts]: Cortes de tomografia computadorizada (TC) com exemplos de nódulos solitários semissólidosDo acervo de Dr. George Tsaknis, MD, PhD, FRCP (Londres), MRQA, MAcadMEd, PGCert; usado com permissão [Citation ends].
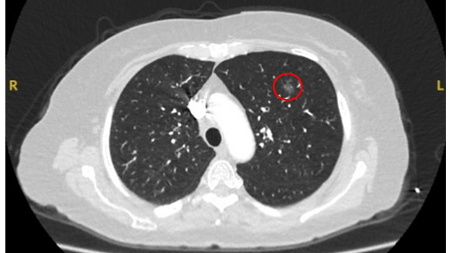
Características das margens
Nódulos benignos tendem a apresentar bordas bem definidas, enquanto nódulos malignos tendem a ser irregulares ou alongados. No entanto, muitas vezes, ocorre um grau de sobreposição e, considerada isoladamente, essa característica não pode ser usada com segurança como fator discriminador.[Figure caption and citation for the preceding image starts]: Tomografia computadorizada (TC) mostrando um pequeno nódulo no lobo superior esquerdo com margens lisas, posteriormente considerado uma metástase colorretal solitária na ressecçãoDo acervo de Dr. George Tsaknis, MD, PhD, FRCP (Londres), MRQA, MAcadMEd, PGCert; usado com permissão [Citation ends].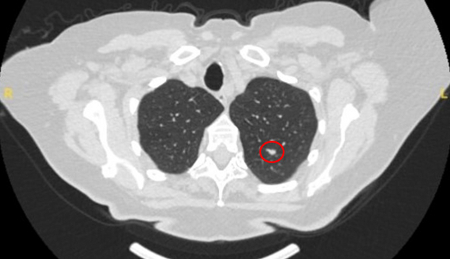
Tamanho
Lesões benignas tendem a ser menores que lesões malignas.[3] A prevalência de neoplasia maligna em nódulos <5 mm é muito baixa, entre 0% e 1%.[30] Em contrapartida, aproximadamente 10% dos pacientes que apresentam um nódulo pulmonar incidental com >8 mm receberão um diagnóstico de câncer.[31] As diretrizes do Reino Unido sugerem que nódulos <5 mm não requerem acompanhamento ou investigação de rotina.[4][30]
Localização
Nódulos pulmonares solitários nos lobos superior e médio têm uma razão de probabilidade para malignidade de 1.2 a 1.6.[19][32] A localização no lobo superior mostrou ser um preditor independente de malignidade.[21]
O aparecimento da fissura adjacente, bem como quaisquer "marcas" pleurais visíveis, são sinais que devem ser considerados na avaliação de nódulos pulmonares solitários perifissurais ou periféricos. Uma fissura retraída associada a um nódulo não liso aumenta a possibilidade de neoplasia maligna.[33][34][Figure caption and citation for the preceding image starts]: Cortes de tomografia computadorizada (TC) de dois casos com nódulos perifissurais benignos. Observe as margens lisas e a fissura adjacente normal e intactaDo acervo de Dr. George Tsaknis, MD, PhD, FRCP (Londres), MRQA, MAcadMEd, PGCert; usado com permissão [Citation ends].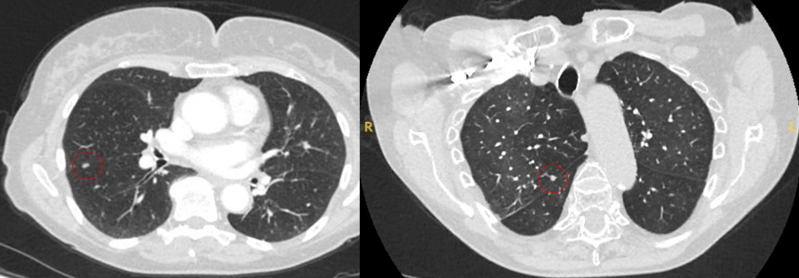 [Figure caption and citation for the preceding image starts]: Tomografia computadorizada (TC) mostrando exemplos de nódulos perifissurais malignos. Observe a borda espiculada dos nódulos e a evidente retração da fissura adjacente. Ambas as análises de tecido de ressecção confirmaram adenocarcinoma de pulmãoDo acervo de Dr. George Tsaknis, MD, PhD, FRCP (Londres), MRQA, MAcadMEd, PGCert; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Tomografia computadorizada (TC) mostrando exemplos de nódulos perifissurais malignos. Observe a borda espiculada dos nódulos e a evidente retração da fissura adjacente. Ambas as análises de tecido de ressecção confirmaram adenocarcinoma de pulmãoDo acervo de Dr. George Tsaknis, MD, PhD, FRCP (Londres), MRQA, MAcadMEd, PGCert; usado com permissão [Citation ends].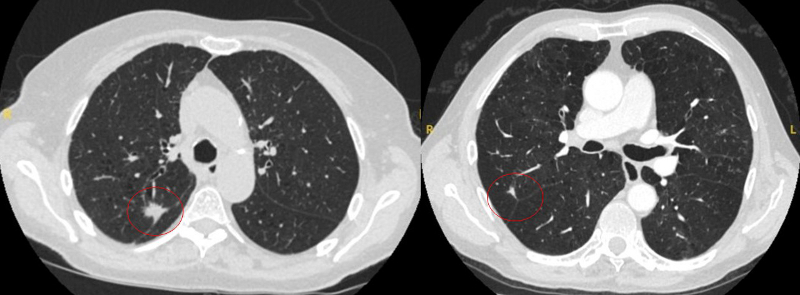 [Figure caption and citation for the preceding image starts]: Tomografia computadorizada (TC) mostrando nódulo espiculado no lobo superior esquerdo com "marca" pleural. A histopatologia da ressecção confirmou câncer pulmonar de células escamosas moderadamente diferenciadoDo acervo de Dr. George Tsaknis, MD, PhD, FRCP (Londres), MRQA, MAcadMEd, PGCert; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Tomografia computadorizada (TC) mostrando nódulo espiculado no lobo superior esquerdo com "marca" pleural. A histopatologia da ressecção confirmou câncer pulmonar de células escamosas moderadamente diferenciadoDo acervo de Dr. George Tsaknis, MD, PhD, FRCP (Londres), MRQA, MAcadMEd, PGCert; usado com permissão [Citation ends].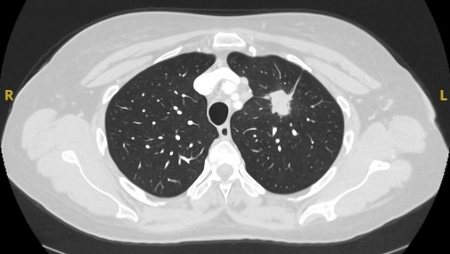 [Figure caption and citation for the preceding image starts]: Tomografia computadorizada (TC) mostrando nódulo periférico no lobo superior esquerdo com várias "marcas" pleurais e elemento de retração da pleura adjacente. A histopatologia da ressecção confirmou câncer pulmonar de células escamosas bem diferenciadoDo acervo de Dr. George Tsaknis, MD, PhD, FRCP (Londres), MRQA, MAcadMEd, PGCert; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Tomografia computadorizada (TC) mostrando nódulo periférico no lobo superior esquerdo com várias "marcas" pleurais e elemento de retração da pleura adjacente. A histopatologia da ressecção confirmou câncer pulmonar de células escamosas bem diferenciadoDo acervo de Dr. George Tsaknis, MD, PhD, FRCP (Londres), MRQA, MAcadMEd, PGCert; usado com permissão [Citation ends].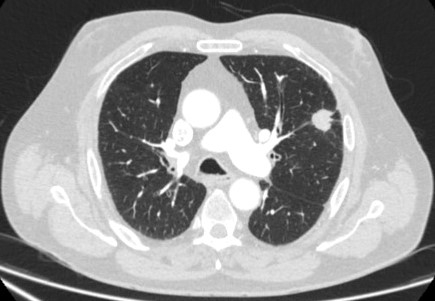
Estratégias de diagnóstico
Uma investigação apropriada para avaliação de um nódulo pulmonar solitário inclui estudos de imagem e uma avaliação da probabilidade clínica de neoplasia maligna.[4][12]
Nos Estados Unidos, diretrizes, incluindo as produzidas pelo American College of Chest Physicians e pelo American College of Radiology, são utilizadas para orientar a avaliação e o tratamento subsequente de nódulos pulmonares.[9][12] No Reino Unido, os pneumologistas seguem as diretrizes da British Thoracic Society.[4]
[Figure caption and citation for the preceding image starts]: Abordagem inicial para nódulos pulmonares sólidosCallister MEJ et al. Thorax 2015;70:ii1-ii54; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Algoritmo de vigilância para nódulos pulmonares sólidos. TDV, tempo de duplicação de volumeCallister MEJ et al. Thorax 2015;70:ii1-ii54; usado com permissão [Citation ends]. [Figure caption and citation for the preceding image starts]: Algoritmo para nódulos pulmonares subsólidos. NPS, nódulos parcialmente sólidos; NSS, nódulos subsólidosCallister MEJ et al. Thorax 2015;70:ii1-ii54; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Algoritmo para nódulos pulmonares subsólidos. NPS, nódulos parcialmente sólidos; NSS, nódulos subsólidosCallister MEJ et al. Thorax 2015;70:ii1-ii54; usado com permissão [Citation ends].
Comparação com outra radiografia ou tomografia computadorizada (TC) do tórax
Se o nódulo já estava presente antes e não tiver mudado em um período de 2 anos, observação é adequada e nenhuma investigação adicional pode ser indicada, a menos que haja uma alta suspeita de malignidade de crescimento lento (por exemplo, carcinoide e carcinoma broncoalveolar).[9][12] A ideia tradicional de que 2 anos de estabilidade confirma que a doença é benigna é razoável para nódulos pulmonares solitários sólidos. No entanto, ela tem sido questionada e deve ser usada com cautela em casos de opacidade em vidro fosco.[27]
Consideração de TC do tórax
Se a lesão foi detectada na radiografia de tórax, a tomografia deve ser obtida.[12] Uma TC de alta resolução identifica com precisão características do nódulo, como tamanho, bordas, calcificação e localização.[9] Ela pode também identificar outros nódulos e ajudar a estadiar a doença, se ela for confirmada como maligna.
Avaliação da probabilidade clínica de neoplasia maligna
Com base nas características históricas (por exemplo, idade do paciente, uso de tabaco e presença de outras malignidades) e as características radiográficas (por exemplo, calcificação, taxa de crescimento e tamanho), o médico pode estimar a probabilidade de malignidade e, então, discutir com o paciente a necessidade de observação e testes não invasivos ou invasivos, de acordo com o desejo do paciente e seu estado de saúde geral.
Métodos de estratificação de risco no desenvolvimento
Estratégias não invasivas para avaliação adicional de nódulos pulmonares com o uso de biomarcadores estão em fases de desenvolvimento e validação, incluindo biomarcadores baseados em proteínas sanguíneas, biópsias líquidas e compostos orgânicos voláteis exalados.[35]
Os biomarcadores podem ser benéficos em pacientes com nódulos pulmonares classificados como de risco intermediário com base em características clínicas e radiográficas, e que podem exigir testes invasivos para descartar neoplasia maligna.[35] Estudos de utilidade clínica que demonstrem melhores desfechos centrados no paciente são necessários antes que esses testes sejam utilizados na prática clínica.
Ferramentas de inteligência artificial (IA) baseadas em radiômica podem desempenhar um papel na avaliação de nódulos pulmonares solitários.[36] São necessárias mais pesquisas para avaliar o papel potencial das ferramentas de IA na avaliação de nódulos pulmonares na prática clínica de rotina.[36]
Determinação da probabilidade de neoplasia maligna (probabilidade pré-teste)
A probabilidade pré-teste de neoplasia maligna, com base nas características clínicas e radiográficas, permite que o médico determine quais pacientes podem ser observados com segurança, quais requerem excisão, quais são indeterminados. Calculadoras de previsão de risco foram desenvolvidas para auxiliar os médicos no diagnóstico e tratamento de nódulos pulmonares, incluindo o modelo de Brock, o modelo de Herder e o tempo de duplicação do volume.[4][37]
Nos Estados Unidos, Canadá e Reino Unido, o modelo de Brock (também conhecido como modelo pan-canadense de avaliação de risco para detecção precoce de câncer pulmonar [modelo PanCan]) é usado para ajudar a determinar a probabilidade de neoplasia maligna.[4][5][7] Este modelo foi validado nas populações do Reino Unido e da Alemanha.[6][38]
O modelo de Herder (que incorpora a avidez de fluordesoxiglucose F-18 [FDG]) foi considerado mais preciso em pacientes submetidos à avaliação de nódulos pulmonares por tomografia por emissão de pósitrons (PET-CT).[38][39] As diretrizes do Reino Unido recomendam que determinados pacientes (probabilidade pré-teste de neoplasia maligna >10% e componente sólido de um nódulo maior que o tamanho do limiar local [geralmente 8 a 10 mm]) sejam avaliados por PET-CT e que o modelo de Herder seja usado para determinar o risco posteriormente.[4][40]
18 F-FDG-PET/TC
Uma metanálise indicou uma sensibilidade de 96.8% e uma especificidade de 77.8%.[41] Isso se traduz em uma razão de probabilidade de 4.36 para neoplasia maligna, dado um teste positivo, e em uma razão de probabilidade de 0.04 para neoplasia maligna, dado um teste negativo. Resultados falso-positivos podem ocorrer em nódulos benignos metabolicamente ativos (por exemplo, infecções) e resultados falso-negativos podem ocorrer com tumores com atividade metabólica relativamente baixa, como carcinoma bronquíolo-alveolar ou tumores pequenos (5 a 8 mm).[42]
O exame PET-CT pode subestimar o risco de neoplasia maligna em relação aos nódulos puros com opacidade em vidro fosco, por causa da falta de tecido sólido suficiente para captar a FDG.
A PET pode ter função no estadiamento de tumores e tem um valor preditivo negativo especialmente elevado na exclusão do envolvimento mediastinal.[43][Figure caption and citation for the preceding image starts]: Cortes de tomografia computadorizada (TC) de dois casos com nódulos perifissurais benignos. Observe as margens lisas e a fissura adjacente normal e intactaDo acervo de Dr. George Tsaknis, MD, PhD, FRCP (Londres), MRQA, MAcadMEd, PGCert; usado com permissão [Citation ends]. [Figure caption and citation for the preceding image starts]: PET-CT com 18-fluordesoxiglucose (18-FDG) mostrando baixa captação em lesão semissólida posterior no lobo superior direito. A ressecção cirúrgica confirmou adenocarcinoma com padrão primariamente lepídicoDo acervo de Dr. George Tsaknis, MD, PhD, FRCP (Londres), MRQA, MAcadMEd, PGCert; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: PET-CT com 18-fluordesoxiglucose (18-FDG) mostrando baixa captação em lesão semissólida posterior no lobo superior direito. A ressecção cirúrgica confirmou adenocarcinoma com padrão primariamente lepídicoDo acervo de Dr. George Tsaknis, MD, PhD, FRCP (Londres), MRQA, MAcadMEd, PGCert; usado com permissão [Citation ends].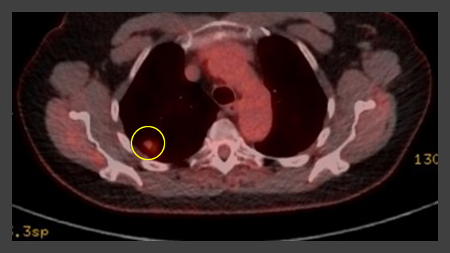 [Figure caption and citation for the preceding image starts]: PET-CT com 18-fluordesoxiglucose (18-FDG) mostrando lesão periférica de alta captação no pulmão esquerdo. A ressecção cirúrgica confirmou câncer pulmonar de células escamosas moderadamente diferenciadoDo acervo de Dr. George Tsaknis, MD, PhD, FRCP (Londres), MRQA, MAcadMEd, PGCert; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: PET-CT com 18-fluordesoxiglucose (18-FDG) mostrando lesão periférica de alta captação no pulmão esquerdo. A ressecção cirúrgica confirmou câncer pulmonar de células escamosas moderadamente diferenciadoDo acervo de Dr. George Tsaknis, MD, PhD, FRCP (Londres), MRQA, MAcadMEd, PGCert; usado com permissão [Citation ends].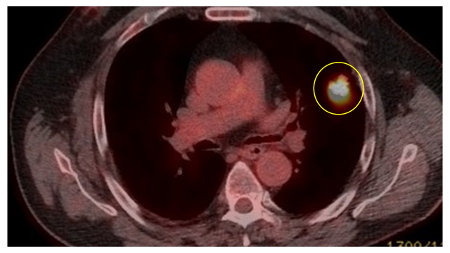
TCs em série e indicações para investigação adicional durante a vigilância
Se a probabilidade inicial de neoplasia maligna for <10%, as diretrizes do Reino Unido recomendam TCs em série e observação.[4] Alguns pacientes com este nível de risco podem desejar prosseguir diretamente com uma abordagem mais invasiva. O desejo dos pacientes deve ser levado em consideração durante o processo de decisão.
O acompanhamento em série serve para:
tranquilizar os pacientes sobre a não malignidade da patologia quando os nódulos são estáveis, regridem ou apresentam crescimento muito lento, ou
permitir o tratamento definitivo de patologias malignas em tempo hábil.
A vigilância por TC não é recomendada para pacientes que não estejam suficientemente aptos para tolerar o tratamento.
Radiologias anteriores devem ser analisadas para verificar se o nódulo já havia sido visualizado anteriormente. O exame de imagem mais antigo (primeiro) que capturar o nódulo por completo é considerado a linha basal. A volumetria é o método preferido de medição (medições do diâmetro, com duração prolongada da vigilância, quando a volumetria não estiver disponível). Um aumento de 25% ou mais no volume durante exames de imagem em série deve ser considerado um crescimento significativo.[4]
Estratégias de diagnóstico e acompanhamento de um nódulo pulmonar solitário: uma abordagem geral
Estas recomendações representam a abordagem dos autores. As recomendações, no entanto, variam entre diretrizes.[4][12][25][33][40][44] Os períodos de vigilância podem ser determinados retrospectivamente se exames de imagem anteriores capturarem adequadamente o nódulo em questão.
Nódulos sólidos - tamanho inicial do nódulo
Diâmetro máximo <5 mm ou volume <80 mm³, ou característica benigna evidente: não é recomendado acompanhamento[Figure caption and citation for the preceding image starts]: A-D: padrões de calcificação de nódulos benignos; E, F: podem ser vistos em nódulos malignosMazzone P.J., Stoller J.K. Semin Thorac Cardiovasc Surg. 2002;14:250-260; usado com permissão [Citation ends].
 [Figure caption and citation for the preceding image starts]: Cortes de tomografia computadorizada (TC) de dois casos com nódulos perifissurais benignos. Observe as margens lisas e a fissura adjacente normal e intactaDo acervo de Dr. George Tsaknis, MD, PhD, FRCP (Londres), MRQA, MAcadMEd, PGCert; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Cortes de tomografia computadorizada (TC) de dois casos com nódulos perifissurais benignos. Observe as margens lisas e a fissura adjacente normal e intactaDo acervo de Dr. George Tsaknis, MD, PhD, FRCP (Londres), MRQA, MAcadMEd, PGCert; usado com permissão [Citation ends]. [Figure caption and citation for the preceding image starts]: Corte de tomografia computadorizada (TC) com configuração de tecidos moles, mostrando hamartoma de pulmão direito, como achado incidental em paciente assintomático. Observe a calcificação central e vários pequenos pontos de gordura dentro do nódulo. Este nódulo permaneceu estável durante um período de 12 anos, não tendo sido necessária nenhuma intervençãoDo acervo de Dr. George Tsaknis, MD, PhD, FRCP (Londres), MRQA, MAcadMEd, PGCert; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Corte de tomografia computadorizada (TC) com configuração de tecidos moles, mostrando hamartoma de pulmão direito, como achado incidental em paciente assintomático. Observe a calcificação central e vários pequenos pontos de gordura dentro do nódulo. Este nódulo permaneceu estável durante um período de 12 anos, não tendo sido necessária nenhuma intervençãoDo acervo de Dr. George Tsaknis, MD, PhD, FRCP (Londres), MRQA, MAcadMEd, PGCert; usado com permissão [Citation ends].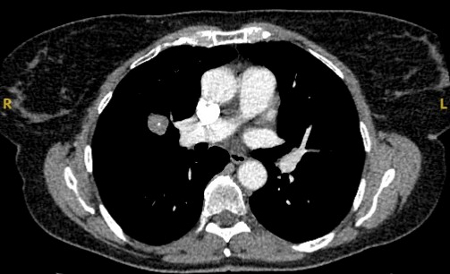 [Figure caption and citation for the preceding image starts]: Tomografia computadorizada (TC) mostrando pequeno nódulo triangular periférico no lobo inferior direito, condizente com linfonodo intrapulmonarDo acervo de Dr. George Tsaknis, MD, PhD, FRCP (Londres), MRQA, MAcadMEd, PGCert; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Tomografia computadorizada (TC) mostrando pequeno nódulo triangular periférico no lobo inferior direito, condizente com linfonodo intrapulmonarDo acervo de Dr. George Tsaknis, MD, PhD, FRCP (Londres), MRQA, MAcadMEd, PGCert; usado com permissão [Citation ends].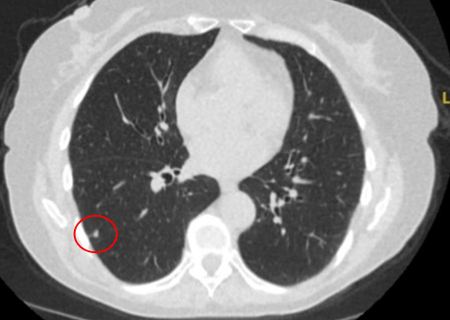
Diâmetro máximo ≥5 a <6 mm: repetir a TC em 1 ano e novamente em 2 anos, se baseada apenas em medições 2D
Diâmetro máximo ≥6 a <8 mm ou volume ≥80 a <300 mm³: repetir a TC em 3 meses; se o nódulo estiver estável/tempo de duplicação do volume for de 400 dias ou mais, repetir novamente em 1 ano (a partir do exame inicial) e em 2 anos se baseado apenas em medidas 2D
Nódulos com diâmetro máximo ≥8 mm ou volume ≥300 mm³, segundo o modelo de avaliação de risco PanCan, apresentam risco de neoplasia maligna <10%: acompanhamento conforme indicado para nódulos de ≥6 a <8 mm
Diâmetro máximo ≥8 mm ou volume ≥300 mm³, o modelo de avaliação de risco PanCan sugere risco de neoplasia maligna >10%, utilize PET-CT e atualize o risco usando o modelo de Herder:
Risco <10%, acompanhamento conforme nódulo com diâmetro máximo ≥6 a <8 mm
risco de 10% a 70%, considerar biópsia guiada por imagem como primeira linha
risco >70%, considerar tratamento definitivo de primeira linha
Nódulos sólidos - aumento do volume do nódulo
Aumento do volume do nódulo ≥25% ou tempo de duplicação do volume <400 dias em qualquer momento durante o acompanhamento: considere investigações adicionais e/ou tratamento definitivo
Tempo de duplicação do volume de 400-600 dias em qualquer momento durante o acompanhamento: tanto a biópsia quanto o acompanhamento adicional são aceitáveis, dependendo da preferência do paciente
Tempo de duplicação do volume >600 dias ao final do período de vigilância: pode-se considerar a alta ou acompanhamento adicional, dependendo da preferência do paciente
Estabilidade do nódulo ao final do período de vigilância: sugere que a alta para o atendimento habitual (incluindo qualquer rastreamento) é apropriada
Nódulos com opacidade em vidro fosco puro e nódulos semissólidos
Diâmetro máximo <5 mm: não é recomendado acompanhamento
Diâmetro máximo ≥5 mm: acompanhamento em 3 meses; se o nódulo se resolver, não será necessário acompanhamento adicional
Diâmetro máximo ≥5 mm: acompanhamento em 3 meses; se o nódulo persistir, determinar o risco usando o modelo de avaliação de risco PanCan
Risco de neoplasia maligna aproximadamente <10%: acompanhamento em 1 ano, 2 anos e 4 anos a partir do basal
Risco de neoplasia maligna aproximadamente >10%: discutir biópsia/ressecção guiada por imagem ou acompanhamento adicional
Ao longo do acompanhamento, se houver crescimento significativo de um componente sólido ou o desenvolvimento de um novo componente sólido em um nódulo previamente com opacidade em vidro fosco, o tratamento definitivo deve ser priorizado. O crescimento de um nódulo com opacidade em vidro fosco puro ≥2 mm de diâmetro máximo justifica a consideração de tratamento ou acompanhamento precoce (<6 meses).
Novos nódulos incidentais
Descobertos durante a vigilância (em decorrência de um nódulo anterior ou por meio de um programa nacional de rastreamento). Podem justificar um manejo diferente.[45] A abordagem dos autores inclui as seguintes recomendações:[46]
Diâmetro máximo <4 mm ou volume <30 mm³: não requerem vigilância (observe que o limite inferior para vigilância é recomendado para nódulos novos)
Volume ≥30 mm³ a <300 mm³: acompanhamento aos 3 e 12 meses
Diâmetro máximo ≥4 a <8 mm: se a volumetria não estiver disponível, realizar acompanhamento aos 3, 12 e 24 meses
Volume ≥300 mm³ ou diâmetro máximo ≥8 mm: PET-CT, se apropriado, e/ou investigação invasiva através do protocolo para suspeita de câncer pulmonar
Avaliação invasiva
Se houver suspeita de neoplasia maligna ou o diagnóstico não for claro após exame clínico, avaliação radiológica e aplicação dos critérios de diagnóstico relevantes, uma biópsia e exame histológico podem ser necessários para confirmar o diagnóstico.[47]
Os princípios fundamentais para a amostragem de um nódulo pulmonar suspeito incluem:
Navegação até a lesão
Confirmação da lesão por meio de instrumento
Biópsia tecidual adequada
A abordagem varia de acordo com o tamanho e a localização do nódulo, epidemiologia local e recursos tecnológicos e humanos disponíveis. De forma ideal, a técnica investigativa preferencial deve ser escolhida após consulta a um especialista treinado e/ou por consenso em reunião com a equipe multidisciplinar. A experiência local e a consideração dos riscos e benefícios de cada procedimento servirão de base para a abordagem para cada paciente.
Broncoscopia flexível
A broncoscopia, geralmente realizada com um broncoscópio flexível, é um procedimento endoscópico no qual a árvore brônquica proximal pode ser visualizada diretamente e as áreas suspeitas podem ser submetidas a biópsia. A principal vantagem de broncoscopia é a baixa taxa de complicações quando comparada com outras técnicas de amostragem.
Amostras de massas endobrônquicas podem ser submetidas à biópsia com pinça. Escovados endobrônquicos, lavados e lavagem alveolar aumentam o rendimento diagnóstico. A biópsia por aspiração transbrônquica com agulha das lesões parenquimatosas e dos linfonodos mediastinais acessíveis pode ser realizada com ou sem orientação de ultrassonografia endobrônquica.[48][49][50][51][52]
A probabilidade de sucesso depende da localização e do tamanho do nódulo, e da presença de brônquio que leva diretamente à lesão (sinal de brônquios), bem como experiência e disponibilidade local de fluoroscopia. A sensibilidade desta técnica é amplamente variável, mas, segundo relatos, é de 40% a 70% para nódulos de 20 mm a 30 mm.[53][54][55]
Uma metanálise mostrou um rendimento diagnóstico combinado de 70% para técnicas broncoscópicas orientadas, com aumento do rendimento de acordo com o aumento do tamanho da lesão.[56] A taxa de pneumotórax combinada foi de 1.5% em 39 estudos, incluindo 3052 nódulos pulmonares.
Broncoscopia navegacional/broncoscopia assistida por robô
A broncoscopia navegacional eletromagnética (ENB) utiliza dados da TC do paciente para melhorar a localização da lesão. No entanto, o rendimento da ENB isoladamente (59%) não é significativamente melhor em comparação com as sondas de ultrassonografia endobrônquica (EBUS) radial isoladamente (69%).[57] Quando combinada com EBUS radial, a ENB melhora o rendimento diagnóstico para 88%.[57] Observe que é necessário cautela ao interpretar os rendimentos diagnósticos obtidos a partir de dados de ensaios clínicos publicados; as diferentes ferramentas, tecnologias e definições de biópsia diagnóstica não são padronizadas.
As plataformas de broncoscopia assistida por robô (RAB), quando disponíveis, podem potencialmente oferecer um rendimento diagnóstico superior em comparação com a broncoscopia convencional.[58][59][60] A RAB oferece navegação precisa e coleta de amostragem tecidual, além de solucionar problemas documentados da ENB, incluindo instabilidade do endoscópio e navegação em vias aéreas complexas.[61] A RAB pode ser particularmente benéfica na avaliação e no tratamento de lesões pulmonares <20 mm ou lesões localizadas no terço externo do pulmão.[61]
Broncoscopia flexível com ultrassonografia endobrônquica periférica (EBUS periférica)
Comumente chamada de miniprobe EBUS radial. A ultrassonografia endobrônquica permite que o operador visualize as estruturas em locais distais ao alcance do broncoscópio flexível. Uma sonda de 20 mHz com diâmetro de 1.4 mm ou 1.8 mm pode ser introduzida com o miniprobe correspondente no segmento de interesse após uma interpretação cuidadosa da TC do tórax. Assim que o alvo desejado for atingido, a sonda pode ser removida, deixando o miniprobe no lugar. Nesse momento, podem-se introduzir o fórceps, as agulhas ou a escova da biópsia, e as amostras são obtidas. O rendimento diagnóstico geral dessa técnica é 34% a 84%.[55][62][63] Os fatores de confusão que podem afetar o rendimento diagnóstico incluem presença de “sinal de brônquio” na TC, visão concêntrica (maior rendimento) ou visão excêntrica (menor rendimento).[Figure caption and citation for the preceding image starts]: Tomografia computadorizada (TC) mostrando nódulo espiculado no lobo superior esquerdo posterior, com "sinal de brônquio" em mulher não fumante. Uma biópsia broncoscópica com fórceps e escovação assistida por localização de miniprobe EBUS radial confirmaram linfoma não HodgkinDo acervo de Dr. George Tsaknis, MD, PhD, FRCP (Londres), MRQA, MAcadMEd, PGCert; usado com permissão [Citation ends].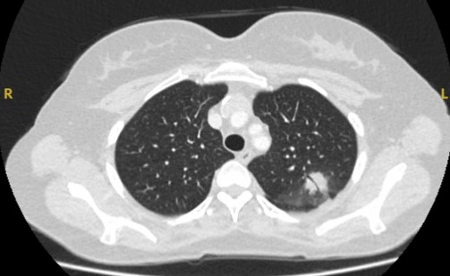
TC de feixe cônico (CBCT) como técnica adjuvante
A CBCT pode ser usada com plataformas de navegação convencionais e RAB para melhorar a localização e o rendimento diagnóstico.[64][65][66][67][68]
Aspiração/biópsia transtorácica com agulha
A aspiração transtorácica com agulha (ATTA) ou a biópsia pulmonar cirúrgica geralmente são reservadas para situações em que há limitações de recursos, falta de experiência ou surgem problemas técnicos. A ATTA pode ser considerada em casos em que a broncoscopia seja negativa, mas em que seja necessária uma investigação contínua.
A sensibilidade da ATTA guiada por TC varia de 72% a 99%, mas 90% é considerada a média aceita.[54] A determinação de doença benigna é mais difícil por causa da pequena quantidade de tecido coletado por este método.[1] A complicação mais comum associada à ATTA é o pneumotórax, que ocorre em cerca de 20% a 45% dos casos.[9][Figure caption and citation for the preceding image starts]: Corte de tomografia computadorizada (TC) capturando punção transtorácica por agulha grossa (core biopsy) visando um nódulo lobulado no lobo inferior esquerdo. A histopatologia confirmou câncer pulmonar de células escamosas bem diferenciadoDo acervo de Dr. George Tsaknis, MD, PhD, FRCP (Londres), MRQA, MAcadMEd, PGCert; usado com permissão [Citation ends].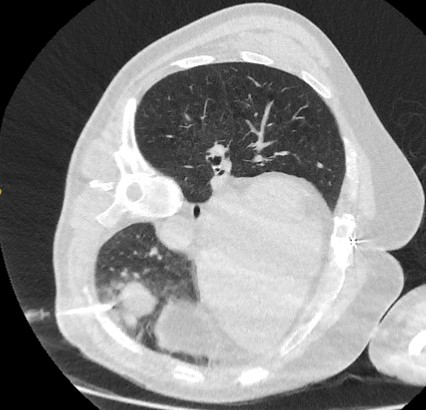
Cirurgia toracoscópica videoassistida (CTVA) ou ressecção cirúrgica por via aberta
A CTVA, ou ressecção cirúrgica por via aberta, é indicada para diagnóstico e possível tratamento de um nódulo pulmonar solitário que não seja diagnosticado pelas técnicas acima, mas continue sendo uma preocupação.
Dados de um ensaio clínico randomizado e controlado que comparou a lobectomia aberta com CTVA para câncer pulmonar inicial (incluindo nódulos solitários) sugeriram que a CTVA estava associada a menos dor, menos complicações hospitalares e menos tempo de internação quando comparada com a toracotomia por via aberta.[69] A CTVA foi associada a uma recuperação funcional superior no pós-operatório, sem nenhuma diferença na sobrevida livre de progressão até 1 ano.
Ao discutir as opções cirúrgicas com os pacientes, é importante considerar que a lobectomia está associada a uma mortalidade operatória de 3% a 7%, enquanto a ressecção da cunha ou do nódulo apresenta uma mortalidade de 0.5% a 1%.[32][70][71] Sempre que a biópsia cirúrgica de um nódulo pulmonar solitário confirmar a presença de câncer pulmonar de células não pequenas, uma lobectomia com dissecção sistemática no linfonodo mediastinal será o tratamento de primeira escolha. É importante lembrar que a abordagem cirúrgica demanda uma avaliação da capacidade cardiopulmonar antes da ressecção.
O uso deste conteúdo está sujeito ao nosso aviso legal