Abordagem
Meninas e meninos que apresentarem sinais precoces de puberdade antes dos 8 e 9 anos de idade, respectivamente, deverão ser avaliados. O médico examinador deve ser bem versado nos estágios da puberdade normal, a fim de saber quem avaliar e tratar. A anamnese e o exame clínico devem ser realizados cuidadosamente. Deve-se registrar com precisão altura, estadiamento puberal e idade óssea. O acompanhamento do crescimento linear e do progresso puberal é imprescindível para diferenciar as diversas etiologias e determinar a necessidade de intervenção terapêutica. Muitos pacientes não precisam de investigações exaustivas, embora uma causa subjacente sinistra, como um tumor, deva sempre ser considerada e excluída.
História
A avaliação deve incluir inicialmente uma história detalhada sobre o início das características sexuais secundárias, o padrão de progressão puberal e, em meninas, o início da menarca. Uma história sobre o crescimento recente deverá ser colhida com precisão, inclusive com perguntas sobre as roupas da criança estarem ficando pequenas muito rapidamente. As alturas e idades do início da puberdade dos pais — e da menarca na mãe — também devem ser registradas. A história social deve incluir qualquer eventual histórico de adoção.[35][36] O abuso infantil, especialmente o abuso sexual, é um fator de risco para desenvolvimento puberal precoce.[37] Uma história completa sobre medicamentos deve ser colhida, para descartar a ingestão de medicamentos exógenos.[22] A história deve ser conduzida dependendo de a puberdade ser congruente ou incongruente (ou seja, o padrão da alteração endócrina ser igual ao da puberdade normal ou não).
Desenvolvimento puberal normal
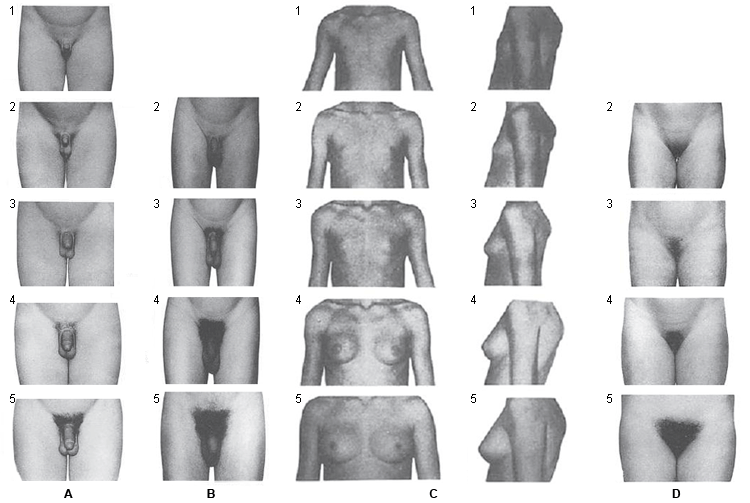
O desenvolvimento puberal e sua evolução são mais bem-determinados com os estágios de Tanner.[1][2]
O primeiro sinal de puberdade em meninos é o aumento do tamanho dos testículos. Esse aumento é seguido por alterações penianas e escrotais. O tamanho dos testículos é documentado como a medida do eixo mais longo ou o volume dos testículos medido pelo orquidômetro de Prader. Um volume de 4 mL ou um comprimento de 2.5 cm definem o início da puberdade. A presença de pelos axilares e outras mudanças, como alterações da voz e aumento da velocidade de crescimento, ocorrem apenas entre o meio e o final da puberdade. Os pelos faciais não aparecem até a fase final da puberdade.
[Figure caption and citation for the preceding image starts]: Orquidômetro de PraderCriado pelo BMJ Knowledge Centre [Citation ends].
 [Figure caption and citation for the preceding image starts]: Método de comparação do tamanho testicular usando o orquidômetro de PraderDo acervo de Dra. A. Mehta [Citation ends].
[Figure caption and citation for the preceding image starts]: Método de comparação do tamanho testicular usando o orquidômetro de PraderDo acervo de Dra. A. Mehta [Citation ends].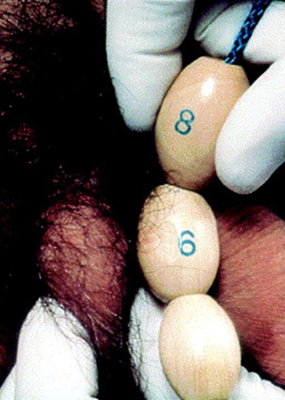
O primeiro sinal visível de puberdade nas meninas é o desenvolvimento das mamas. Deve-se ter cautela no exame físico do tecido mamário em meninas obesas, pois a gordura pode ser confundida com tecido mamário. Com o desenvolvimento verdadeiro das mamas, um pequeno brotamento mamário deve ser palpável atrás do mamilo. Os pelos púbicos e axilares, a acne e o odor corporal se desenvolvem como resultado de androgênios secretados pela glândula adrenal. O pico da velocidade de crescimento ocorre no estágio 3 de Tanner e, normalmente, a menarca ocorre no estágio 4 de desenvolvimento mamário de Tanner.
[Figure caption and citation for the preceding image starts]: Estágios de Tanner: A, padrões de classificação genital em meninos; B, padrões de classificação de pelos púbicos em meninos; C, padrões de classificação mamária em meninas; D, padrões de classificação de pelos púbicos em meninasAdaptado de Marshall WA, Tanner JM. Arch Dis Child. 1970;45:13-23; Marshall WA, Tanner JM. Arch Dis Child. 1969;44:291-303 [Citation ends].
Puberdade precoce central (PPC) ou congruente
O desenvolvimento puberal congruente sugere uma causa central. O eixo hipotálamo-hipófise-gonadal é ativado prematuramente. Em meninas, a PPC normalmente é idiopática (97% dos casos em meninas de 6-8 anos e 75% em meninas <6 anos) e é um diagnóstico de exclusão.[23] Uma causa subjacente, porém, deve ser descartada e buscada ativamente nas pacientes do sexo feminino muito novas. Nos meninos, deve-se investigar uma causa subjacente, pois apenas cerca de 60% dos casos são classificados como idiopáticos.[24][25][26]
Os tumores que podem resultar em PPC incluem gliomas ópticos e hipotalâmicos, astrocitomas, ependimomas e tumores pineais, e raramente tumores endócrinos primitivos, como os craniofaringiomas. Os hamartomas do túber cinéreo são tumores congênitos compostos por uma massa heterotópica com presença de neurônios secretores de hormônio liberador de gonadotrofina (GnRH), feixes nervosos e células gliais, que estão comumente associados à PPC, geralmente antes dos 3 anos de idade.[46] Eles estão comumente associados à epilepsia gelástica, geralmente apresentando episódios de riso e atraso no desenvolvimento.
Hidrocefalia, traumatismo cranioencefálico, infecções prévias como meningite ou encefalite e neurofibromatose também estão associadas à PPC. Portanto, deve-se verificar a história em relação a estes fatores.
A história prévia pode indicar cirurgia (em decorrência de tumor) ou radioterapia no cérebro. A prevalência da PPC aumenta após uma irradiação craniana para tumores locais ou leucemia. Doses moderadas de radiação usadas para o tratamento de tumores cerebrais em crianças, ao contrário de doses baixas ou elevadas, estão associadas à puberdade precoce, com uma relação direta entre a idade do início da puberdade e a terapia.[29] Doses mais elevadas geralmente associam-se à deficiência de gonadotrofina e puberdade tardia.
Puberdade precoce independente de gonadotrofinas (PPIG) ou incongruente
O desenvolvimento puberal incongruente sugere uma causa periférica, o que significa que a secreção de esteroides sexuais é autônoma e independente do gerador hipotalâmico de pulso do GnRH. Os meninos apresentam virilização (desenvolvimento peniano e escrotal) aumentada e testículos incomumente pequenos. As meninas podem ter crescimento avançado de pelos pubianos e axilares antes do desenvolvimento das mamas.
Pode haver uma história de hiperplasia adrenal congênita (HAC) diagnosticada desde o nascimento ou tardiamente. A criança pode já estar sendo tratada com terapia com hidrocortisona e/ou fludrocortisona. Pacientes do sexo masculino com HAC por deficiência de 21-hidroxilase podem apresentar PPIG se subtratados por longos períodos. O quadro clínico da HAC por deficiência de 21-hidroxilase, em pacientes do sexo feminino, inclui sinais de virilização (por exemplo, pelos pubianos e axilares, clitoromegalia) causados por excesso de androgênio, mas ausência de desenvolvimento das mamas.
A testotoxicose (também chamada de PPIG masculina) está associada a diversas mutações de ativação constitutiva no receptor do hormônio luteinizante (LH).[43][44] Ela também está associada à maturação prematura de células germinativas e de Leydig. A doença tem herança autossômica dominante e se manifesta apenas em pacientes do sexo masculino. A história familiar pode auxiliar na identificação de um paciente acometido.
Pode haver história de deformidade óssea ou outro tipo de hiperfuncionamento das glândulas endócrinas decorrente da síndrome de McCune-Albright (SMA). Esse distúrbio é multissistêmico, caracterizado pela tríade clássica da PPIG, máculas hiperpigmentadas ou manchas de cor café-com-leite com bordas irregulares e distúrbio ósseo com progressão lenta (displasia fibrosa poliostótica).[47][48][49] Os sintomas de outros tipos de envolvimento endócrino incluem tireotoxicose (hiperplasia nodular da tireoide), síndrome de Cushing (múltiplos nódulos hiperplásicos adrenais) gigantismo ou acromegalia (adenoma hipofisário e excesso de hormônio do crescimento) e galactorreia (decorrente de hiperprolactinemia). A precocidade sexual é rara nos meninos com SMA.
A exposição prolongada a esteroides sexuais na PPIG tem um efeito direto de maturação sobre o hipotálamo e pode acelerar o início da puberdade mediada centralmente, ou puberdade dependente de GnRH (PPC).
Exame
É necessário registrar, com precisão, as medidas atuais e prévias de altura e peso. Medições precisas, por meio de gráficos de crescimento correlacionando a idade e o sexo, são obrigatórias. Deve-se usar de cautela ao calcular a altura e o peso com base na idade cronológica real da criança. O crescimento está fortemente relacionado ao potencial genético. A altura média dos pais, ou altura ideal, é calculada da seguinte forma:
Menina = ([altura da mãe em cm + altura do pai em cm]/2) - 7 cm.
Menino = ([altura da mãe em cm + altura do pai em cm]/2) + 7 cm.
A velocidade do crescimento determina a mudança da altura com o decorrer do tempo. Ela é calculada como a diferença de altura em duas ocasiões diferentes anualizada ao longo de um ano. A altura, delineada com consistência ao longo de determinado percentil no gráfico de crescimento, reflete uma velocidade normal de crescimento. Percentis cruzados em direção crescente refletem uma velocidade de crescimento acelerada.
O exame puberal dos pacientes com PPC é congruente com o desenvolvimento puberal normal. Em meninos com PPIG, a virilização é causada por concentrações elevadas de testosterona. O aumento dos testículos, porém, está ausente ou presente apenas do início ao meio da puberdade, sendo menor que o esperado em relação ao estágio do crescimento peniano. O aumento dos testículos é moderado e simétrico na testotoxicose, mas assimétrico na presença de tumores de células de Leydig. Nas pacientes do sexo feminino, as mamas podem ser pouco ou não desenvolvidas, apesar da presença de pelos pubianos ou axilares e/ou menstruação.
A presença de características dismórficas pode revelar síndromes multissistêmicas, como anomalias na linha média da face, na holoprosencefalia, e displasia septo-ótica. A assimetria da face pode ser observada na SMA.
O exame físico da pele pode auxiliar na identificação de manchas de cor café-com-leite presentes na neurofibromatose (bordas regulares) e na SMA (bordas irregulares). Também pode haver comprometimento da pele de outras formas na neurofibromatose do tipo 1 (NF1), como neurofibromas plexiformes ou sardas nas áreas intertriginosas ou axilares.
Um exame detalhado dos olhos deve sempre ser realizado, inclusive avaliação do campo visual e fundoscopia. Anomalias visuais incluem nódulos de Lisch na neurofibromatose do tipo 1; outros deficits visuais causados por lesão cerebral, tumores ou infecções; ou hipoplasia do nervo óptico na displasia septo-ótica. Deficits motores focais podem estar presentes, sendo causados por tumores intracranianos, traumatismo cranioencefálico prévio, hidrocefalia, meningite ou encefalite.[Figure caption and citation for the preceding image starts]: Paciente do sexo masculino com desenvolvimento puberal congruenteDo acervo do Dr. A. Mehta; usado com permissão [Citation ends].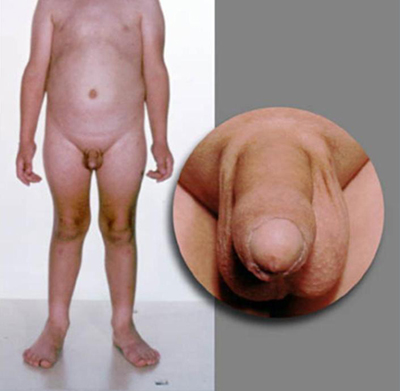 [Figure caption and citation for the preceding image starts]: Paciente do sexo masculino com hiperplasia adrenal congênita e desenvolvimento puberal incongruenteDo acervo do Dr. A. Mehta; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Paciente do sexo masculino com hiperplasia adrenal congênita e desenvolvimento puberal incongruenteDo acervo do Dr. A. Mehta; usado com permissão [Citation ends].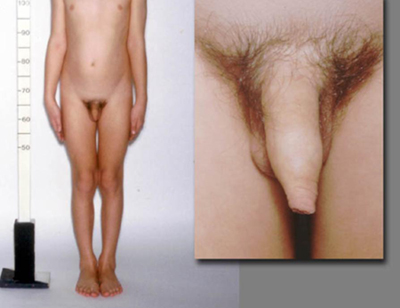 [Figure caption and citation for the preceding image starts]: Pacientes do sexo feminino com puberdade precoce independente de gonadotrofinas (PPIG) e máculas de cor café-com-leite hiperpigmentadas na síndrome de McCune-AlbrightDo acervo do Dr. A. Mehta; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Pacientes do sexo feminino com puberdade precoce independente de gonadotrofinas (PPIG) e máculas de cor café-com-leite hiperpigmentadas na síndrome de McCune-AlbrightDo acervo do Dr. A. Mehta; usado com permissão [Citation ends].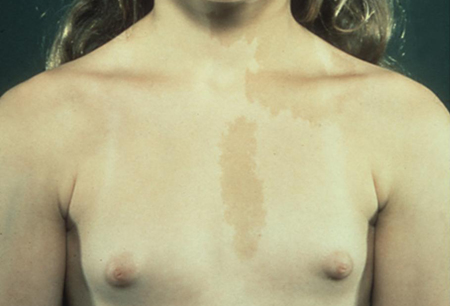 [Figure caption and citation for the preceding image starts]: Sardas axilares na neurofibromatose do tipo 1Do acervo do Dr. A. Mehta; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Sardas axilares na neurofibromatose do tipo 1Do acervo do Dr. A. Mehta; usado com permissão [Citation ends].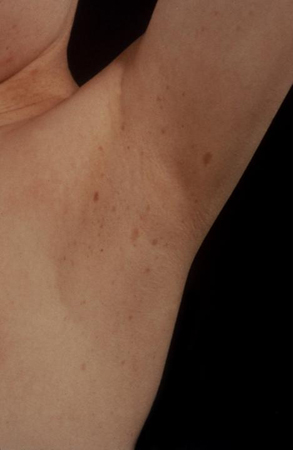
Investigações iniciais
A puberdade precoce idiopática é responsável pela maioria dos casos em meninas, mas poucos casos em meninos, e é um diagnóstico de exclusão. As investigações iniciais devem incluir os elementos a seguir.
Uma radiografia do punho/da mão não dominante (geralmente, o[a] esquerdo[a]) para estimar a idade óssea. A aparência radiográfica de centros epifisários representativos é comparada aos padrões adequados à idade e ao sexo já publicados. O método mais comumente utilizado é o de Greulich e Pyle, ou um relatório automatizado de idade óssea, como o BoneXpert.[50] A idade óssea é geralmente avançada em 1-3 anos em pacientes com puberdade precoce. A idade óssea também pode auxiliar na predição da faixa estimada de altura adulta e sua relação com a altura média dos pais; deve-se ter cautela nessa interpretação, pois os padrões atuais foram validados apenas em crianças normais, e não em crianças com puberdade precoce.
O diagnóstico bioquímico de PPC baseia-se em concentrações séricas de gonadotrofina puberal, tanto em níveis basais quanto após a estimulação. Antes do início da puberdade, geralmente o hormônio folículo-estimulante (FSH) é a gonadotrofina predominante; durante e após a puberdade, as concentrações de hormônio luteinizante (LH) são maiores que as de FSH. A concentração de LH basal é muito mais sensível que a concentração de FSH basal. Nos casos de PPC, a concentração de LH basal geralmente é de ≥0.3 UI/L. Um LH basal elevado tem alta sensibilidade e especificidade para o diagnóstico de puberdade precoce em meninos, mas é menos sensível nas meninas. Assim, em meninas, a medição do LH basal pode ser adequada para confirmar, mas não para refutar, o diagnóstico de PPC.[40]
O teste de GnRH é usado nos casos menos definidos. Isso envolve a medição dos níveis de LH e FSH basais e novamente a 20 e a 60 minutos após a administração de GnRH. Uma resposta puberal é considerada com concentração sérica de LH após estimulação de ≥5 UI/L.[51] Análogos do GnRH também foram usados para a investigação das concentrações de pico de LH e FSH após a estimulação, se o GnRH recombinante não estiver disponível.[52]
Uma medição elevada de estrogênio e testosterona séricos em meninas e meninos, respectivamente, pode ajudar a confirmar o início da puberdade.
Uma ultrassonografia pélvica pode auxiliar no diagnóstico de puberdade precoce nas meninas. O útero pode ter formato e tamanho pré, peri ou pós-puberal, dependendo do estágio da puberdade. O eco endometrial reflete um efeito do estrogênio, enquanto a presença de folículos nos ovários reflete a estimulação por gonadotrofina. O espessamento endometrial sugere que as concentrações puberais de estrogênio tenham sido atingidas, e um endométrio de cerca de 6-8 mm implica uma menarca iminente. A precocidade sexual em meninas com SMA é causada por múltiplos cistos foliculares e luteinizados dos ovários com funcionamento autônomo, com um cisto solitário maior ocasional. Uma ultrassonografia da pelve também auxiliará na identificação de tumores gonadais secretores de estrogênio.
Exames posteriores
Investigações e manejo adicionais dependerão dos sintomas, padrão de desenvolvimento sexual, sexo e resultados da medição de gonadotrofina.
DPC
Uma ressonância nuclear magnética (RNM) do cérebro ajuda a identificar tumores, presença de hidrocefalia, anomalias estruturais do eixo hipotálamo-hipofisário e defeitos na linha média cerebral. A aparência característica do hamartoma é uma massa séssil ou pedunculada, geralmente ligada ao hipotálamo posterior, entre o túber cinéreo e os corpos mamilares.[53] Há um consenso de que é necessário realizar uma RNM cranioencefálica em todos os meninos e nas meninas com início da puberdade antes dos 6 anos, mas estudos constataram que o risco de encontrar um tumor ou outra lesão grave é muito baixo (<1%) nas meninas com início entre os 6 e 8 anos de idade. Por isso, muitos aconselham não realizar exames de imagem de forma rotineira nestas meninas.[54]
A presença da PPC em certas situações, como pós-cirurgia para craniofaringioma, após radioterapia ou em pacientes com displasia septo-ótica e holoprosencefalia, justificará uma avaliação hormonal completa da hipófise em busca de anomalias (geralmente deficiências) de outros hormônios da hipófise anterior e posterior.
Amostras minutadas de repouso (overnight) de gonadotrofinas podem demonstrar pulsatilidade. É realizado principalmente no âmbito da pesquisa.
PPIG
A 17-hidroxiprogesterona (17-OHP) sérica e outros androgênios (androstenediona, sulfato de desidroepiandrosterona) para diagnosticar HAC por deficiência de 21-hidroxilase ou de outros tipos. Um perfil urinário de esteroides e um teste de estímulo com o hormônio adrenocorticotrófico podem auxiliar na identificação de defeitos na síntese de esteroides adrenais.
Se houver suspeita de tumor adrenal em pacientes com virilização, será indicada uma tomografia computadorizada (ou RNM) das glândulas adrenais. O uso da ultrassonografia das glândulas adrenais é limitado.
Dependendo da sintomatologia da síndrome de McCune-Albright, outras investigações podem abranger: RNM das adrenais para verificar a existência de múltiplos nódulos hiperplásicos adrenais causadores de síndrome de Cushing, cintilografia da tireoide para hiperplasia nodular com tireotoxicose ou RNM cranioencefálica, na presença de gigantismo ou galactorreia, para descartar um adenoma hipofisário. Uma cintilografia óssea e radiografia de esqueleto, para identificar as lesões ósseas da displasia fibrosa poliostótica, também são indicadas.
Outros exames a serem considerados:
Deve-se realizar um teste genético nos pacientes com suspeita de neurofibromatose do tipo 1, SMA ou testotoxicose familiar. Mutações com perda de função em MKRN3 ou DLK1, ou mutações com ganho de função em KISS1R, um receptor acoplado à proteína G que é um ligante de kisspeptina, podem causar PPC.[31]
Testes de função tireoidiana para descartar hipotireoidismo primário, uma causa rara de puberdade precoce. Estes são principalmente úteis nos casos em que os sintomas são sugestivos de hipotireoidismo e quando a velocidade de crescimento diminui em vez de aumentar.[Figure caption and citation for the preceding image starts]: Investigações em pacientes com puberdade precoceDo acervo do Dr. A. Mehta; usado com permissão [Citation ends].
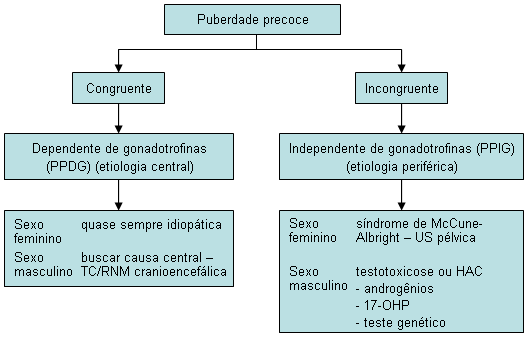
O uso deste conteúdo está sujeito ao nosso aviso legal