Etiologia
As causas podem ser divididas em centrais (dependentes de gonadotrofinas), em que ocorre a ativação prematura do eixo hipotálamo-hipófise-gonadal; e decorrentes de ativação prematura dos ovários, testículos ou glândulas adrenais, independentemente da secreção de gonadotrofinas (puberdade precoce independente de gonadotrofinas [PPIG]).
Puberdade precoce central (PPC)
A PPC idiopática é a causa mais comum nas meninas (97% em meninas de 6-8 anos e 75% em meninas <6 anos).[23] Em meninos, a incidência relatada de PPC idiopática é mais variável, de 60% a cerca de 90%.[24][25][26]
Neoplasias do cérebro, como gliomas do nervo óptico (por exemplo, em associação à neurofibromatose),craniofaringiomas ou hamartomas.[27][28]Os hamartomas do túber cinéreo são tumores congênitos compostos por uma massa heterotópica com presença de neurônios secretores de hormônio liberador de gonadotrofina (GnRH), estão comumente associados à PPC e geralmente ocorrem antes dos 3 anos de idade, especialmente em pacientes do sexo masculino. Os outros tumores incluem astrocitomas, ependimomas e tumores pineais.
Radioterapia craniana.[29]
Quadros neurológicos incapacitantes, como hidrocefalia, paralisia cerebral, e pós-infecção, como meningite ou encefalite.[30]
Traumatismo cranioencefálico pós-traumático.[30]
Mutações com ganho de função no KISS1R, um receptor acoplado à proteína G que é um ligante da kisspeptina, podem causar PPC, embora essas mutações sejam encontradas muito raramente.[31] A interação entre o KISS1R e a kisspeptina é necessária para a função do GnRH. Particularmente na PPC familiar, é mais comum que mutações no gene MKRN3 sejam a causa. O MKRN3 é um gene impresso cuja função é suprimir o eixo hipotálamo-hipofisário-gonadal antes da puberdade.[32] Mutações no DLK1, um segundo gene impresso, são outra causa genética rara de PPC.[33]
Anomalias na linha média do prosencéfalo, como holoprosencefalia ou displasia septo-ótica.[34]
Associação com adoção de crianças e abuso sexual.[35][36][37]
Puberdade precoce independente de gonadotrofinas (PPIG)
Causas ovarianas: cistos foliculares do ovário, tumores de células granulosas, tumores de células de Leydig e gonadoblastoma.
Causas testiculares: tumores de células de Leydig e um defeito na função do receptor do hormônio luteinizante (LH) (testotoxicose ou PPIG familiar). Este é causado por uma mutação de ativação no gene do receptor de LH.
Causas adrenais: a hiperplasia adrenal congênita (HAC) por deficiência da 21-hidroxilase e, menos frequentemente, por deficiência da 11-hidroxilase, em pacientes do sexo masculino resulta na PPIG. O quadro clínico da HAC, em pacientes do sexo feminino, inclui sinais de virilização (por exemplo, pelos pubianos e axilares e clitoromegalia) e ausência de desenvolvimento das mamas. Outras causas adrenais incluem síndrome de Cushing e tumor adrenal virilizante. A exposição prolongada a esteroides sexuais tem efeito de maturação direto no hipotálamo e pode acelerar o início da PPC.
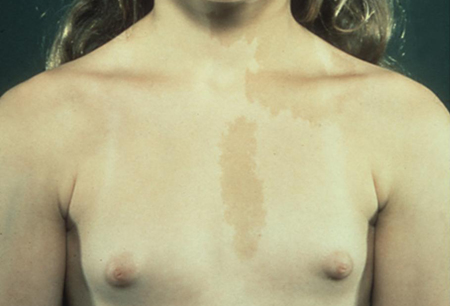
A síndrome de McCune-Albright (SMA) é uma condição esporádica causada por uma mutação de sentido incorreto e ativação somática. Essa mutação ocorre no gene codificador da subunidade alfa da proteína G, que estimula a produção da adenosina monofosfato cíclico (AMPc). Ela resulta na tríade clássica da PPIG, manchas de cor café-com-leite e displasias fibrosas dos ossos. A puberdade precoce decorrente de SMA é muito mais comum em meninas que em meninos. O hiperfuncionamento autônomo geralmente envolve os ovários, mas há também o comprometimento endócrino, que abrange a tireoide (tireotoxicose), as glândulas adrenais (síndrome de Cushing), a hipófise (gigantismo/acromegalia ou hiperprolactinemia) e as glândulas paratireoides (hiperparatireoidismo).[Figure caption and citation for the preceding image starts]: Pacientes do sexo feminino com puberdade precoce independente de gonadotrofinas (PPIG) e máculas de cor café-com-leite hiperpigmentadas na síndrome de McCune-AlbrightDo acervo do Dr. A. Mehta; usado com permissão [Citation ends].
A exposição a hormônios exógenos, como os presentes em pílulas contraceptivas ou géis de testosterona, pode ser responsável pelo desenvolvimento puberal precoce em alguns pacientes. Agentes estrogênicos em cosméticos e produtos alimentares também foram implicados como causas da uma idade puberal precoce; "epidemias" de telarca (desenvolvimento isolado das mamas) precoce em algumas regiões podem estar associadas à exposição ambiental a estrogênios.[22]
Tumores de células germinativas secretores de gonadotrofina coriônica humana são uma causa rara somente em homens.[38] Eles podem ocorrer nas gônadas, cérebro (geralmente na região pineal), fígado, retroperitônio e mediastino posterior.
Fisiopatologia
Um aumento noturno da amplitude e pulsatilidade da secreção do hormônio liberador de gonadotropina (GnRH) do hipotálamo é a primeira alteração evidente da puberdade.[39] A liberação de GnRH é o determinante predominante da entrada na puberdade e de sua progressão. Ela tem um período de quiescência aproximado dos 2 aos 8 ou 9 anos de idade. A função normal do GnRH depende da interação entre inclusões neuronais e gliais inibitórias (por exemplo, ácido gama-aminobutírico) e excitatórias (por exemplo, kisspeptina, glutamato).[40]
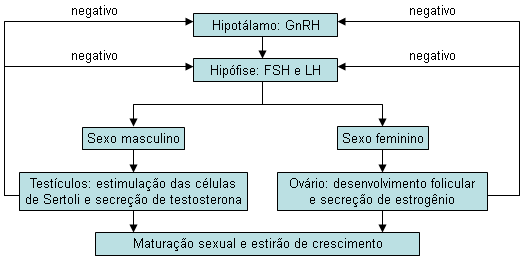
O GnRH hipotalâmico, por sua vez, estimula a secreção dos hormônios hipofisários: hormônio folículo-estimulante (FSH) e hormônio luteinizante (LH). Em pacientes do sexo masculino, o LH age nas células de Leydig produzindo testosterona; e o FSH, nas células de Sertoli atuando na espermatogênese. Em pacientes do sexo feminino, uma interação complexa entre o LH e o FSH nas células tecais e granulosas resulta no desenvolvimento folicular, com a produção de estrogênio e ovulação.
Na puberdade precoce centralmente mediada, com a ativação prematura do eixo hipotálamo-hipófise-gonadal, as gonadotrofinas séricas são elevadas (puberdade precoce dependente de gonadotrofinas). O padrão da alteração endócrina é igual ao da puberdade normal (ou seja, é congruente).
Na puberdade precoce decorrente de outras causas (adrenal, testicular, ovariana ou hormônios exógenos), a secreção de esteroides sexuais é autônoma e independente do pulso do GnRH hipotalâmico. Há perda da regulação de retroalimentação normal, e as concentrações de esteroides sexuais são elevadas, geralmente com níveis baixos ou suprimidos de gonadotrofinas. Isso é chamado de puberdade precoce independente de gonadotrofinas (PPIG). O desenvolvimento puberal não segue o padrão da puberdade normal (ou seja, é incongruente). A exposição prolongada a esteroides sexuais tem efeito de maturação direto no hipotálamo e pode acelerar o início da puberdade mediada centralmente.[Figure caption and citation for the preceding image starts]: Circuito de retroalimentação do eixo hipotálamo-hipófise-gônadas. GnRH, hormônio liberador de gonadotrofina; FSH, hormônio folículo-estimulante; LH, hormônio luteinizanteDo acervo do Dr. A. Mehta; usado com permissão [Citation ends].
Em média, a puberdade leva aproximadamente de 2 a 5 anos para terminar e proporciona um incremento no crescimento de 25 cm em meninas e 30 cm em meninos. O estrogênio, seja do ovário ou aromatizado a partir da testosterona testicular, é o fator que atua como mediador da resposta intensificada do hormônio do crescimento durante a puberdade.[41][42] A secreção prematura de esteroides gonadais em crianças resulta em estatura alta na infância, causada por uma taxa de crescimento linear acelerada, e estatura normal ou baixa na vida adulta, em decorrência da fusão precoce das placas epifisárias.
Classificação
Classificação etiológica
Puberdade precoce central (PPC)
Na PPC (puberdade precoce dependente de gonadotrofinas), o eixo hipotálamo-hipófise-gonadal é ativado prematuramente.
O padrão da alteração endócrina é igual ao da puberdade normal (ou seja, o desenvolvimento puberal é congruente).
Puberdade precoce independente de gonadotrofinas (PPIG)
A secreção de esteroides sexuais (estrogênio ou testosterona) é autônoma e independente do pulso central hipotalâmico do hormônio liberador de gonadotrofina (GnRH).
Há perda da regulação de retroalimentação normal, e as concentrações de esteroides sexuais são geralmente elevadas com níveis baixos de gonadotrofinas.
O desenvolvimento puberal não segue o padrão da puberdade normal (ou seja, é incongruente).
A exposição prolongada a esteroides sexuais tem efeito de maturação direto sobre o hipotálamo e pode acelerar o início da PPC.
O uso deste conteúdo está sujeito ao nosso aviso legal