Nipocalimabe aprovado pela FDA para tratamento de miastenia gravis generalizada
O nipocalimabe, um anticorpo monoclonal antagonista dos receptores Fc neonatais (FcRn), foi aprovado pela Food and Drug Administration (FDA) dos EUA para o tratamento de miastenia gravis generalizada em adultos e crianças ≥12 anos que são positivos para anticorpos antirreceptor de acetilcolina (AChR) ou antitirosina quinase músculo específica (MuSK). A aprovação segue a designação de revisão prioritária da FDA e fornece uma opção de tratamento alternativa para oferecer controle sustentado da doença para uma ampla gama de pacientes com sintomas incômodos causados pela miastenia gravis.
A aprovação foi baseada nos resultados do Vivacity-MG3, um estudo de fase 3 com pacientes com miastenia gravis generalizada inadequadamente controlada com a terapia padrão. O nipocalimabe adicionado ao padrão de cuidados foi associado a reduções duradouras nos anticorpos IgG e AChR circulantes totais e melhoras nos desfechos relatados pelos pacientes, com um bom perfil de segurança.
Resumo
Definição
História e exame físico
Principais fatores diagnósticos
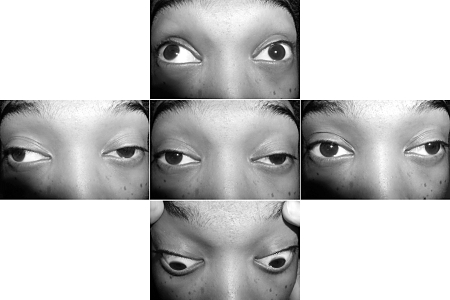
- fatigabilidade da força muscular
- ptose
- diplopia
- disfagia
- disartria
- paresia facial
- fraqueza muscular proximal
- dispneia
Fatores de risco
- história familiar de distúrbios autoimunes
- marcadores genéticos
- terapia dirigida ao câncer
Investigações diagnósticas
Primeiras investigações a serem solicitadas
- análise de anticorpo sérico antirreceptor da acetilcolina (AchR)
- anticorpos antitirosina quinase músculo-específica (MuSK)
- testes seriados de função pulmonar
Investigações a serem consideradas
- testes de anticorpos antirreceptor de músculo estriado
- estimulação nervosa repetitiva
- eletromiografia (EMG) de fibra única
- tomografia computadorizada (TC) do tórax
Algoritmo de tratamento
Colaboradores
Autores
David P. Richman, MD
Distinguished Professor
Professor of Neurology
University of California - Davis
Davis
CA
Declarações
DPR declares that he has no competing interests.
Agradecimentos
Dr David Richman would like to gratefully acknowledge Dr Robert Lisak, Dr Andrea Corse, and Dr Ami Mankodi, previous contributors to this topic.
Declarações
AC and AM declare that they have no competing interests. RPL is a Data and Safety Monitoring Board Member for the COUR myasthenia gravis clinical trial. RPL is a site principal investigator for clinical trials and a co-author for the clinical trial reports for myasthenia gravis therapies for Alexion, Argenx, and UCB Ra. RPL's institution receives payment for the time spent on these clinical trials. RPL has received book royalties from Oxford University Press and Blackstone, and has carried out consultancy work for Avilar.
Revisores
Vern C. Juel, MD
Associate Professor of Medicine (Neurology)
Duke University
Durham
NC
Declarações
VCJ declares that he has no competing interests.
Créditos aos pareceristas
Os tópicos do BMJ Best Practice são constantemente atualizados, seguindo os desenvolvimentos das evidências e das diretrizes. Os pareceristas aqui listados revisaram o conteúdo pelo menos uma vez durante a história do tópico.
Declarações
As afiliações e declarações dos pareceristas referem--se ao momento da revisão.
Referências
Principais artigos
Narayanaswami P, Sanders DB, Wolfe G, et al. International consensus guidance for management of myasthenia gravis: 2020 update. Neurology. 2021 Jan 19;96(3):114-22.Texto completo Resumo
Skeie GO, Apostolski S, Evoli A, et al. Guidelines for treatment of autoimmune neuromuscular transmission disorders. Eur J Neurol. 2010 Jul;17(7):893-902.Texto completo Resumo
Gronseth GS, Barohn R, Narayanaswami P. Practice advisory: thymectomy for myasthenia gravis (practice parameter update). Report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology. Neurology. 2020 Apr 21;94(16):705-9.Texto completo Resumo
Elovaara I, Apostolski S, van Doorn P, et al. EFNS guidelines for the use of intravenous immunoglobulin in treatment of neurological diseases: EFNS task force on the use of intravenous immunoglobulin in treatment of neurological diseases. Eur J Neurol. 2008 Sep;15(9):893-908.Texto completo Resumo
Artigos de referência
Uma lista completa das fontes referenciadas neste tópico está disponível aqui.
O uso deste conteúdo está sujeito ao nosso aviso legal