Recomendações
Principais recomendações
Discuta sobre o paciente imediatamente com um serviço vascular regional para considerar a transferência para reparo cirúrgico urgente se houver suspeita de aneurisma da aorta abdominal (AAA) roto ou sintomático e se a ultrassonografia aórtica à beira do leito confirmar a presença de um AAA ou não for diagnóstica ou não estiver disponível.[42] Não atrase o diagnóstico e o manejo de um AAA roto enquanto aguarda os resultados do exame de imagem.[70]
Se o paciente tiver um AAA roto, inicie a ressuscitação hipotensiva (hipotensão permissiva) se ele estiver consciente.[2][70]
A European Society for Vascular Surgery recomenda ter como alvo uma pressão arterial sistólica (PAS) de 70-90 mmHg.[2] Na prática, essa PAS alvo é uma boa abordagem se o reparo cirúrgico definitivo for iminente.
No entanto, o Royal College of Emergency Medicine recomenda uma PAS alvo mais alta, de 90-120 mmHg, que pode ser usada pela equipe do pronto-socorro para garantir uma perfusão adequada enquanto se aguardam instruções do serviço vascular regional.[70]
Use sangue e hemoderivados, se disponíveis, com uma proporção sugerida de plasma fresco congelado/eritrócitos próxima de 1:1.[2][77]
Se o paciente tiver um AAA sintomático e não roto, deve-se considerar um reparo cirúrgico urgente independentemente do diâmetro do AAA, pois o desenvolvimento de nova dor ou agravamento da dor pode indicar expansão do AAA e ruptura iminente.[8][42][101]
Se o paciente tiver sido aceito por um serviço vascular regional, certifique-se de que ele saia da unidade de encaminhamento em até 30 minutos após a decisão de transferência.[42][70]
Quando o paciente estiver estável e o reparo cirúrgico urgente, se indicado, tiver sido priorizado, a etiologia infecciosa ou inflamatória deve ser abordada.
Se o paciente tiver suspeita de aneurisma infeccioso, o diagnóstico precoce, o tratamento imediato com antibióticos e o reparo cirúrgico urgente são essenciais para melhorar os desfechos.[2]
A aortite inflamatória (causada, por exemplo, pela arterite de Takayasu ou arterite de células gigantes) é tratada com corticosteroide em altas doses e cirurgia.[8][102]
Se o paciente tiver um achado incidental de um AAA assintomático (fora do programa de rastreamento), encaminhe-o para um serviço vascular regional para considerar a possibilidade de reparo cirúrgico eletivo ou o manejo conservador.[42]
No Reino Unido, certifique-se de que o paciente seja atendido:[42]
Dentro de 2 semanas após o diagnóstico, se o AAA medir ≥5.5 cm
Dentro de 12 semanas após o diagnóstico, se o AAA medir 3.0 a 5.4 cm.
A decisão de prosseguir com o reparo cirúrgico é baseada no tamanho do AAA, bem como na saúde geral e nas preferências do paciente.[2][42] Pacientes com um AAA que mede ≥5.5 cm ou tenha >4.0 cm e crescimento rápido (>1 cm em 1 ano) geralmente devem ser submetidos a reparo cirúrgico.[2][42]
Lembre-se de que o limiar para encaminhamento e reparo cirúrgico, com base no tamanho do AAA, pode variar em diferentes países.[2][42]
Se o paciente não atingir o limiar para reparo cirúrgico, ele deverá receber manejo conservador, que envolve modificação dos fatores de risco e vigilância com ultrassonografia aórtica.[2][42]
O abandono do hábito de fumar é fundamental para o manejo; o tabagismo é o fator de risco mais importante para desenvolvimento, expansão e ruptura do AAA.[2][42]
cuidados de suporte iniciais
Se o paciente tiver suspeita de AAA roto, obtenha ajuda imediata de um colega sênior e discuta sobre o paciente com um serviço vascular regional para considerar a transferência para reparo cirúrgico urgente se:[42]
O AAA é confirmado na ultrassonografia aórtica à beira do leito
ou
A ultrassonografia aórtica à beira do leito não estiver imediatamente disponível ou não for diagnóstica, mas ainda houver suspeita de AAA.
Não atrase o diagnóstico e o manejo de um AAA roto enquanto aguarda os resultados do exame de imagem.[70]
Se o paciente tiver sido aceito por um serviço vascular regional, certifique-se de que ele saia da unidade de encaminhamento em até 30 minutos após a decisão de transferência.[42][70]
Inicie medidas imediatas de ressuscitação enquanto aguarda a transferência. Elas incluem:
Oxigênio suplementar
Acesso venoso periférico de grande calibre
Cateter arterial; cateter urinário
Ressuscitação hipotensiva (hipotensão permissiva) se o paciente estiver consciente.[2]
A European Society for Vascular Surgery recomenda ter como alvo uma pressão arterial sistólica (PAS) de 70-90 mmHg no pré-operatório, restringindo a ressuscitação fluídica.[2] Na prática, essa PAS alvo é uma boa abordagem se o reparo cirúrgico definitivo for iminente.
No entanto, o Royal College of Emergency Medicine recomenda uma PAS alvo mais alta, de 90-120 mmHg, que pode ser usada pela equipe do pronto-socorro para garantir uma perfusão adequada enquanto se aguardam instruções do serviço vascular regional.[70]
Se disponível, use sangue e hemoderivados com uma proporção sugerida de plasma fresco congelado/eritrócitos próxima de 1:1.[2][77]
Como inserir um tubo traqueal em adulto usando um laringoscópio.
Como usar um aparato reanimador manual autoinflável para fornecer suporte ventilatório a adultos. Vídeo de demonstração da técnica de duas pessoas.
Mais informações: hipotensão permissiva
A hipotensão permissiva é recomendada para pacientes conscientes com suspeita de AAA roto. No entanto, não há evidências diretas de ensaios clínicos randomizados e controlados (ECRCs) para essa abordagem. Portanto, as recomendações são baseadas na opinião de especialistas e feitas por consenso, e os limiares da pressão arterial sistólica (PAS) ainda não são bem estabelecidos.
Não existe uma definição padrão para hipotensão permissiva. Portanto, não há também nenhum consenso sobre como alcançá-la e os parâmetros alvo usados para monitorá-la.[42]
A European Society for Vascular Surgery recomenda almejar uma PA alvo de 70-90 mmHg.[2]
Na prática, essa PAS alvo é uma boa abordagem se o reparo cirúrgico definitivo for iminente.
No entanto, o Royal College of Emergency Medicine recomenda uma PAS alvo mais alta, de 90-120 mmHg, que pode ser usada pela equipe do pronto-socorro para garantir uma perfusão adequada enquanto se aguardam instruções do serviço vascular regional.[70]
Uma revisão Cochrane sobre hipotensão (permissiva) controlada em comparação com uma estratégia de ressuscitação normotensa para pessoas com AAA roto (data de pesquisa de agosto de 2017) não encontrou nenhum ECRC que atendesse aos critérios de inclusão.[107]
A revisão Cochrane observou que um ECRC em uma população indireta de pacientes adultos com trauma, com choque hemorrágico, constatou redução da mortalidade e menos necessidade de sangue e fluidos na hipotensão permissiva em comparação com uma estratégia de ressuscitação convencional.[108]
No entanto, os autores da revisão observaram que talvez não seja possível generalizar essa constatação, pois pessoas com AAA roto eram geralmente mais velhas e mais propensas a apresentar doença aterosclerótica coronariana e renal e, portanto, corriam maior risco de infarto do miocárdio e insuficiência renal se submetidas a baixos níveis de PAS, em comparação com pessoas mais jovens com trauma.
Evidências indiretas que respaldam a necessidade de cautela em pacientes com AAA roto foram relatadas na revisão Cochrane do estudo IMPROVE, um ECRC multicêntrico (N=613) que compara o reparo endovascular com o reparo aberto do aneurisma. Constatou-se que, em pessoas com AAA roto e PAS pré-operatória registrada menor que 70 mmHg, a mortalidade em 30 dias foi maior (51.0%) em comparação com pessoas com PAS acima de 70 mmHg (34.1%).[109]
O National Institute for Health and Care Excellence (NICE) baseou na revisão Cochrane sua análise de evidências da diretriz de 2020 para hipotensão permissiva durante a transferência de pessoas com AAA roto para serviços vasculares regionais.[42] Como não havia evidências diretas de ECRCs, o comitê de diretrizes fez uma recomendação consensual de modo a: “considerar uma abordagem restritiva à ressuscitação volêmica (hipotensão permissiva) para pessoas com suspeita de AAA roto ou sintomático durante uma transferência de emergência para um serviço vascular regional”. Não foi fornecida nenhuma meta de PAS.
Apesar de observar a diferença demográfica nas populações, o comitê decidiu que, devido ao sangramento profuso em ambas as populações, a justificativa para o uso de ressuscitação fluídica restritiva em pacientes com trauma era aplicável a pessoas com AAA roto.
O comitê considerou os possíveis danos associados ao uso excessivo de ressuscitação fluídica (por exemplo, diluição dos fatores de coagulação, hipocalcemia e redução da temperatura corporal), juntamente com os possíveis benefícios de uma estratégia de ressuscitação com hipotensão permissiva (por exemplo, melhor coagulação e redução do tamanho dos hematomas).
É preciso considerar fatores e circunstâncias individuais do paciente, como a distância até os serviços vasculares regionais. O comitê, portanto, concordou que especialistas vasculares devem participar da decisão de iniciar estratégias de ressuscitação com hipotensão permissiva, mas que, caso contrário, provavelmente haveria pouco impacto nos custos e recursos.
[Figure caption and citation for the preceding image starts]: Aneurisma da aorta abdominal: tomografia computadorizada (TC) de um aneurisma da aorta abdominal rotoUniversity of Michigan, mais especificamente os casos do Dr. Upchurch, representando os Departamentos de Cirurgia vascular e Radiologia [Citation ends].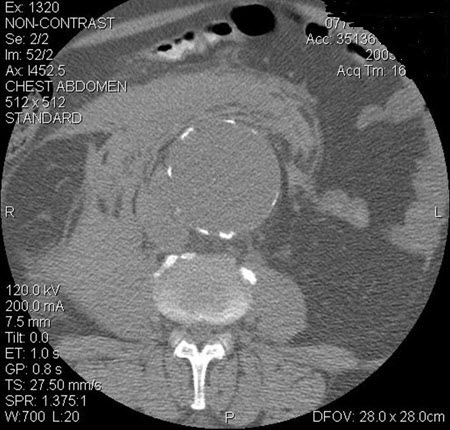
reparo cirúrgico urgente
A opinião de um especialista de um serviço vascular regional deve respaldar a decisão de transferir o paciente e a adequação dele para reparo cirúrgico urgente.[2][70]
Nenhum sintoma, sinal ou fator de risco relacionado ao paciente, ou ferramenta de avaliação de risco do paciente (escore), deve ser usado para determinar se o reparo cirúrgico é adequado para o paciente.[42]
No entanto, é improvável que certos pacientes (como aqueles em parada cardíaca e/ou com perda persistente da consciência) sobrevivam ao reparo cirúrgico.[2][42]
Se a cirurgia for considerada adequada, o reparo endovascular do aneurisma (EVAR) ou o reparo cirúrgico aberto poderão ser realizados.[2][42] Certifique-se de que o paciente receba cuidados perioperatórios adequados - consulte Reparo cirúrgico abaixo para obter mais informações.
Mais informações: mortalidade por AAA roto
Em pacientes com AAA roto confirmado, a mortalidade em 3 anos foi menor entre aqueles randomizados para o reparo endovascular de aneurisma (EVAR) do que na estratégia de reparo aberto (48% versus 56%; razão de riscos de 0.57, IC de 95% 0.36 a 0.90).[110] A diferença entre os grupos de tratamento não foi mais evidente após 7 anos de acompanhamento (razão de riscos de 0.92, IC de 95% 0.75 a 1.13). As taxas de nova intervenção não foram significativamente diferentes entre os grupos randomizados em 3 anos (razão de riscos de 1.02, IC de 95% 0.79 a 1.32).[110] Existem algumas evidências que sugerem que a estratégia endovascular para reparo do AAA roto pode reduzir a mortalidade mais efetivamente em mulheres do que em homens.[110][111]
Uma revisão sistemática e uma metanálise constataram que as taxas de mortalidade em 30 dias e 1 ano após o reparo de um AAA roto em pacientes com idade ≥80 anos foram semelhantes às de pacientes de outras idades, com um benefício significativo de sobrevida com o EVAR em relação ao reparo aberto.[112]
Há evidências que sugerem que o modo de anestesia para reparo cirúrgico do AAA afeta os desfechos.[113] O ensaio clínico randomizado e controlado multicêntrico IMPROVE detectou uma redução significativa da mortalidade em 30 dias em pacientes que receberam EVAR apenas sob anestesia local em comparação com a anestesia geral (razão de chances [RC] ajustada 0.27, IC de 95% 0.1 a 0.7).[109] Esses achados foram replicados em uma metanálise separada que comparou o modo de anestesia para reparo endovascular do AAA roto.[114] Dados do National Vascular Registry do Reino Unido (9783 pacientes que receberam um EVAR infrarrenal padrão eletivo; anestesia geral, n=7069; anestesia regional, n=2347; anestesia local, n=367) mostraram uma menor taxa de mortalidade em 30 dias após a anestesia regional em comparação com a anestesia geral.[115]
No entanto, uma revisão sistemática subsequente não mostrou nenhum benefício de mortalidade com a anestesia local, mas demonstrou estadias hospitalares mais curtas.[116] O estudo internacional multicêntrico Endurant Stent Graft Natural Selection Global Post-Market Registry (ENGAGE) examinou os resultados de 1231 pacientes submetidos ao EVAR sob anestesia geral (62% dos pacientes), regional (27%) e local (11%).[117] O tipo de anestesia não teve nenhuma influência na mortalidade ou morbidade perioperatória, mas o uso de anestesia local ou regional durante o EVAR pareceu ser benéfico na redução do tempo do procedimento, da necessidade de internação na UTI e da duração da internação pós-operatória.[117] Em 2024, a European Society for Vascular Surgery emitiu uma recomendação branda que favorecia a anestesia local em detrimento da anestesia geral em contextos eletivos, com base na possível redução do tempo do procedimento, internações na UTI e permanência hospitalar pós-operatória.[2][118][119][120]
Se o reparo cirúrgico for considerado inadequado, tome as decisões de tratamento e monitoramento com a equipe multidisciplinar como parte de um plano individualizado de cuidados no final da vida.[121] Envolva o paciente e/ou cuidadores, sempre que possível.[121]
Discuta urgentemente com um serviço vascular regional sobre qualquer paciente com um AAA sintomático e não roto.[42][70]
O desenvolvimento de dor nova ou agravamento pode sinalizar a expansão do aneurisma e ruptura iminente.
O reparo cirúrgico urgente é indicado independentemente do diâmetro do AAA.[8][42][77][101]
O EVAR é amplamente utilizado no manejo de pacientes com AAA sintomático.[122][123]
Em algumas circunstâncias, a intervenção pode ser protelada por várias horas para otimizar as condições e garantir o sucesso do reparo; estes pacientes devem ser monitorados de perto na UTI.[77]
Certifique-se de que o paciente receba cuidados perioperatórios adequados - consulte Reparo cirúrgico abaixo para obter mais informações.
Mais informações: EVAR versus reparo aberto de AAA sintomático
O manejo do AAA sintomático, mas não roto, é uma área de debate, sendo que as organizações responsáveis pelas diretrizes fazem recomendações diferentes. O reparo endovascular do aneurisma (EVAR) pode ser preferível ao reparo aberto se o paciente tiver anatomia adequada.[2]No entanto, o reparo aberto pode ser melhor para pacientes com expectativa de vida superior a 10 anos.[2][42]
Em 2024, a European Society for Vascular Surgery (ESVS) publicou diretrizes de prática clínica atualizadas sobre o manejo do AAA.[2] Sobre a questão do EVAR versus o reparo aberto, a ESVS recomenda uma estratégia que prioriza o EVAR na maioria dos cenários.
No entanto, a ESVS afirma que é razoável considerar o reparo aberto como primeira estratégia em pacientes mais jovens e adequados, com uma longa expectativa de vida >10-15 anos, pois há indícios de possível aumento da taxa de complicações após 8-10 anos com dispositivos de EVAR de gerações anteriores, e a durabilidade dos dispositivos atuais é incerta.[2]
A diretriz observa que o EVAR não pode substituir totalmente o reparo cirúrgico aberto, pois este continuará sendo a opção de tratamento preferida para alguns pacientes.
No entanto, a orientação do National Institute for Health and Care Excellence (NICE) do Reino Unido, publicada em 2020, recomenda o reparo aberto para a maioria dos pacientes com AAA não roto, inclusive os sintomáticos, salvo se contraindicado em decorrência de uma patologia abdominal concomitante, risco anestésico e/ou comorbidades clínicas. As razões para isso foram:[42]
Uma preferência por dados coletados de ensaios clínicos randomizados e controlados (ECRCs): em particular, o estudo EVAR-1 (N=1252) que comparou pacientes com AAA não roto submetidos ao EVAR versus cirurgia aberta[124]
A mortalidade precoce (0-6 meses) (total e relacionada ao aneurisma) foi menor no grupo do EVAR (razão de riscos [RR] ajustada à mortalidade total 0.61, IC de 95% 0.37 a 1.02; RR ajustada à mortalidade relacionada ao aneurisma 0.47, IC de 95% 0.23 a 0.93); no entanto, em >8 anos, o reparo aberto apresentou uma mortalidade significativamente menor (RR ajustada à mortalidade total 1.25, IC de 95% 1.00 a 1.56); RR ajustada à mortalidade relacionada ao aneurisma 5.82, IC de 95% 1.64 a 20.65). Essa diferença se deveu principalmente à ruptura secundária do saco aneurismático no grupo do EVAR.
Modelagem de custo-efetividade
Os desfechos (como estadias hospitalares mais curtas e menores taxas de mortalidade perioperatória) melhoraram ao longo do tempo para o reparo aberto, bem como para o EVAR
Potencial de perda de experiência com o reparo aberto se o EVAR se tornar a principal estratégia de reparo.
Foram levantadas questões sobre as recomendações do NICE, inclusive sobre a época do estudo EVAR-1 (a inscrição foi de 1999-2004), o que significa que os resultados podem não ser aplicáveis às técnicas atuais e que, na diretriz do NICE, foram usados dados específicos do Reino Unido para fins de custo-efetividade.[125]
Em geral, há poucas evidências específicas para o subgrupo de pacientes com AAA sintomático não roto. É também importante notar que o estudo EVAR-1 não mencionou quantos dos pacientes incluídos eram sintomáticos nem realizou nenhuma análise de subgrupos para essa população.[124]
Outros grandes ECRCs em pacientes com AAA não roto (OVER, DREAM) também constataram benefícios iniciais de sobrevida com o EVAR que diminuíram com o tempo, mas ambos excluíram especificamente pacientes sintomáticos.[126][127]
Em estudos observacionais, a taxa de mortalidade em curto prazo por todas as causas não diferiu entre o EVAR e o reparo aberto do AAA sintomático.[122][123][128]
Dados do Programa Nacional de Melhora da Qualidade Cirúrgica do American College of Surgeons de 2011-2013 sugerem que o risco de mortalidade em 30 dias após o reparo do AAA sintomático foi aproximadamente o dobro do risco após o reparo do AAA assintomático, independentemente da abordagem cirúrgica (RC 2.1, IC de 95% 1.3 a 3.5).[124]
Pacientes sintomáticos submetidos ao EVAR tiveram menos probabilidade do que pacientes assintomáticos de ter uma tentativa percutânea de acesso. Além disso, o tempo de operação deles foi mais longo, com maior necessidade de um EVAR complexo e maior risco de eventos adversos graves após o EVAR.
Para pacientes com AAA roto, há um consenso geral de que o EVAR é a abordagem preferida na maioria dos pacientes (embora, em relação a isso, o NICE faça uma recomendação mais branda do que a ESVS).[2][42]
Lembre-se de que o limiar para encaminhamento e consideração do reparo cirúrgico para um AAA assintomático pode variar em diferentes países. Verifique o protocolo local.
Encaminhamento
Providencie encaminhamento para um serviço vascular regional para qualquer paciente com AAA assintomático (que seja detectado fora de um programa de rastreamento). Após o diagnóstico, certifique-se de que eles sejam reavaliados:[42]
Dentro de 2 semanas se o AAA medir ≥5.5 cm
Dentro de 12 semanas, se o AAA medir 3.0 a 5.4 cm.
Reparo cirúrgico eletivo versus tratamento conservador
Discuta os riscos e benefícios do reparo cirúrgico eletivo versus o tratamento conservador (com vigilância por ultrassonografia) com o paciente com base na saúde dele atual e prevista para o futuro.[42] Para o AAA detectado como achado incidental, o tratamento conservador é preferível ao reparo até que o risco teórico de ruptura exceda o risco estimado de mortalidade operatória.[2][3][42][103]
As decisões de tratamento devem ser tomadas em conjunto com o paciente e levar em consideração fatores como:[2][42]
Tamanho e morfologia do aneurisma. Geralmente, o reparo cirúrgico deve ser considerado para AAA assintomático se ele medir:[42]
A idade, a expectativa de vida, a adequação para a cirurgia e quaisquer comorbidades do paciente[42]
A avaliação deve incluir uma anamnese e exame clínico, avaliação funcional, hemograma completo e eletrólitos (inclusive avaliação da função renal) e ECG. Testes adicionais, tais como ecocardiografia estática, testes de função pulmonar e teste ergométrico, podem ser considerados com base nas circunstâncias individuais do paciente.[2][42]
O risco de ruptura do AAA se não for reparado[42]
Os benefícios e riscos de curto e longo prazo, inclusive desvantagens do reparo, como permanência no hospital, riscos da operação, período de recuperação, possível necessidade de outros procedimentos e necessidade de consultas para realização de exames de imagem para fins de vigilância[42]
As incertezas em torno das estimativas de risco para AAAs ≥5.5 cm[42]
Em pacientes com uma causa genética subjacente ou doenças do tecido conjuntivo, o diâmetro limite para considerar o reparo deve ser individualizado, dependendo de:[2]
Características anatômicas
Genética subjacente: o risco de ruptura é maior em diâmetros aórticos menores em algumas condições, e o reparo cirúrgico é mais desafiador em certas doenças devido ao aumento da fragilidade e à anatomia da parede arterial.[2]
Encaminhe para o especialista apropriado qualquer paciente que atinja o limite para reparo cirúrgico, mas inicialmente não esteja apto para cirurgia, a fim de otimizar o estado de preparo e comorbidades do paciente, antes de reconsiderar o reparo cirúrgico.[2] Isso pode incluir um paciente com:[2]
Doença cardiovascular ativa (por exemplo, angina instável, insuficiência cardíaca descompensada, valvopatia grave, arritmia significativa)
Capacidade funcional ruim (por exemplo, incapaz de subir dois lances de escada, subir um aclive, realizar tarefas domésticas pesadas [esfregar o chão ou mover os móveis] ou cortar a grama)
Fatores de risco clínicos significativos (por exemplo, DPOC preexistente, declínio recente da função respiratória, história de doença cerebrovascular sintomática, comprometimento renal grave [TFGe <30 mL/min/1.73 m2]).
Se o paciente for candidato ao reparo cirúrgico, certifique-se de que ele receba manejo perioperatório adequado. Consulte Reparo cirúrgico abaixo para obter mais informações.
Mais informações: mortalidade por reparo cirúrgico eletivo
Os dados sugerem que, em pacientes com AAAs maiores (variando de 5.0 a 5.5 cm) submetidos a reparo eletivo, o EVAR é equivalente ao reparo aberto em termos de sobrevida global em longo prazo, embora a taxa de intervenções secundárias seja maior para o EVAR.[126][129] O EVAR reduz a mortalidade relacionada ao AAA (mas não a sobrevida global em longo prazo) em pacientes com um AAA grande (≥5.5 cm) que não são adequados para reparo aberto.[130] Após o reparo, aneurismas da aorta abdominal maiores parecem estar associados a uma pior sobrevida tardia do que aneurismas menores (razão de risco combinada 1.14 por aumento de 1 cm no diâmetro do aneurisma, IC de 95% 1.09 a 1.18; acompanhamento de 12.0 a 91.2 meses).[131] A associação é mais pronunciada com o EVAR do que com o reparo aberto.
Monitoramento
Se o paciente não tiver atingido o limiar para considerar o reparo cirúrgico:[2][42]
Ofereça vigilância com ultrassonografia aórtica.
Verifique o protocolo local para obter orientação sobre a frequência da vigilância, pois ela pode variar em diferentes países.[2][8][42]
No Reino Unido, o National Institute for Health and Care Excellence (NICE) recomenda os seguintes intervalos de vigilância:[42]
Anualmente, se o AAA medir 3.0 a 4.4 cm
A cada 3 meses, se o AAA medir 4.5 a 5.4 cm.
Ofereça informações, apoio e intervenções para a prevenção secundária de doenças cardiovasculares.[2][42]
Encaminhe todos os pacientes para um serviço de abandono do tabagismo. Isso é fundamental, pois o tabagismo é o fator de risco mais importante para o desenvolvimento, expansão e ruptura do AAA.[2] Consulte Abandono do hábito de fumar.
Todos os pacientes com AAA devem receber terapia antiagregante plaquetária, a menos que seja contraindicada. A European Society of Cardiology (ESC) afirma que o tratamento com um único agente antiplaquetário (aspirina ou clopidogrel) pode ser razoável.[132] A anticoagulação pode ser considerada em casos de trombo intraluminal ou aneurisma oclusivo, em vista do papel do trombo mural na progressão aneurismática.[132]
A European Society of Cardiology recomenda que todos os pacientes com doença vascular periférica sintomática comecem também a tomar agentes hipolipemiantes, se a o colesterol da lipoproteína de baixa densidade (LDL) for >2.5 mmol/L (>97 mg/dL), e anti-hipertensivos, se a pressão arterial sistólica for >140 mmHg, a menos que sejam contraindicados.[133][134]
Outras considerações incluem:
Estratégias voltadas para um estilo de vida saudável, inclusive controle de peso, dieta, nutrição e exercícios. Consulte Obesidade em adultos.
Manejo de outras comorbidades, como diabetes. Consulte Diabetes do tipo 2 em adultos.
Mais informações: uso de anti-hipertensivos para reduzir a taxa de expansão do AAA
O tratamento de curto prazo com anti-hipertensivos (como betabloqueadores e inibidores da ECA) não parece reduzir a taxa de expansão do AAA.[3][135][136][137] Estudos em que pacientes com AAAs pequenos foram randomizados para receberem propranolol e outros betabloqueadores com a intenção de reduzir a taxa de expansão do aneurisma não demonstraram efeitos protetores significativos.[137][138] O propranolol foi pouco tolerado nestes estudos.[138] Revisões sistemáticas e metanálises de estudos sobre medicamentos anti-hipertensivos no AAA não demonstraram nenhuma diferença significativa na taxa de crescimento do AAA ou na incidência de eventos clínicos.[64][135]
Mais informações: vigilância
Para um AAA pequeno assintomático, a vigilância é preferível ao reparo até que o risco teórico de ruptura seja superior ao risco estimado de mortalidade operatória.[3][42][103]
A cirurgia precoce para o tratamento de AAA menores não reduz a mortalidade por todas as causas ou específica para AAA.[3][139] Uma revisão sistemática (4 ensaios, 3314 participantes) encontrou evidências de alta qualidade que demonstram que o reparo imediato de um AAA pequeno (4.0 cm a 5.5 cm) não melhorou a sobrevida em longo prazo em comparação com a vigilância (RR ajustada 0.88, IC de 95% 0.75 a 1.02, acompanhamento médio de 10 anos).[139] A falta de benefício atribuível à cirurgia imediata foi consistente independentemente da idade do paciente, diâmetro do aneurisma pequeno e se o reparo foi endovascular ou aberto.[139]
O encaminhamento cirúrgico de AAAs menores é geralmente reservado para casos de crescimento rápido, ou uma vez que o diâmetro limiar para reparo do aneurisma é atingido por ultrassonografia.[2][3]
As recomendações de intervalos de vigilância variam.[2][8][42]
Uma revisão sistemática e metanálise de dados individuais de pacientes concluiu que intervalos de vigilância de 2 anos para AAA de 3.0 a 4.4 cm e 6 meses para AAA de 4.5 a 5.4 cm são seguros e custo-efetivos.[96]
A análise das taxas de crescimento e ruptura do aneurisma da aorta abdominal indicou que, para manter o risco de ruptura do aneurisma da aorta abdominal <1%, é necessário um intervalo de 8.5 anos de vigilância para homens com aneurisma da aorta abdominal com diâmetro inicial de 3.0 cm.[96] O respectivo intervalo de vigilância estimado para homens com aneurismas, cujo diâmetro inicial é de 5.0 cm, foi de 17 meses.
Apesar de apresentar taxas de crescimento semelhantes para aneurismas pequenos, as taxas de ruptura foram quatro vezes maiores nas mulheres em comparação com os homens.[96] Os programas e os critérios de vigilância para considerar a cirurgia poderão ser personalizados para mulheres com AAA detectada oportunisticamente.
Indicações
O reparo cirúrgico urgente é indicado para qualquer paciente com AAA roto ou sintomático.[2][42][101]
O reparo cirúrgico eletivo deve ser considerado para um AAA assintomático que meça:[2][42]
≥5.5 cm
ou
>4.0 cm e crescer rapidamente (>1 cm em 1 ano).
Manejo perioperatório
Certifique-se de que o paciente esteja otimizado para a cirurgia e receba profilaxia com antibióticos e para tromboembolismo venoso e analgesia adequada. Deve-se considerar transfusão de sangue, com monitoramento adequado do paciente, dependendo do tipo de cirurgia.
Otimização para cirurgia
Se o paciente tiver um AAA sintomático não roto, certifique-se de que ele seja monitorado cuidadosamente na UTI com controle rigoroso da pressão arterial.[2][77] O paciente deve ser considerado para reparo cirúrgico urgente adiado, preferencialmente em condições de reparo eletivo.[2]
Se o paciente tiver um AAA assintomático:
Ofereça ao paciente informações, apoio e intervenções para a prevenção secundária de doenças cardiovasculares.[42] O reparo eletivo em pacientes assintomáticos permite a avaliação pré-operatória, a estratificação do risco cardíaco e a otimização clínica de outras comorbidades. O controle dos fatores de risco cardiovascular modificáveis no pré-operatório melhora a sobrevida de longo prazo após o reparo do AAA.[140] Considere:
Encaminhamento para um serviço de abandono do tabagismo.[42] Consulte Abandono do hábito de fumar.
Estratégias voltadas para um estilo de vida saudável, inclusive controle de peso, dieta, nutrição e exercícios.[42] Consulte Obesidade em adultos.
Todos os pacientes com AAA devem receber terapia antiagregante plaquetária, a menos que seja contraindicada. A European Society of Cardiology (ESC) afirma que o tratamento com um único agente antiplaquetário (aspirina ou clopidogrel) pode ser razoável.[132] A anticoagulação pode ser considerada em casos de trombo intraluminal ou aneurisma oclusivo, em vista do papel do trombo mural na progressão aneurismática.[132]
Otimização dos medicamentos do paciente.[42]
Se o paciente já estiver recebendo terapia antiplaquetária ou anticoagulante, discuta o caso com um cirurgião vascular. Em geral:
Continue a monoterapia antiplaquetária com aspirina ou um inibidor de P2Y 12 (por exemplo, clopidogrel) durante o período perioperatório após o reparo aberto e endovascular do AAA.[2]
Na maioria dos pacientes, evite continuar a terapia antiagregante plaquetária dupla por causa do risco de sangramento grave.[2] No entanto, pode-se considerar a continuação em certos pacientes de alto risco, inclusive aqueles submetidos à revascularização coronária intervencionista antes do reparo do AAA, pois eles correm o risco de trombose no stent.[2]
Descontinue a anticoagulação antes da cirurgia por, pelo menos:[2]
5 dias para varfarina
2 dias para anticoagulantes orais diretos (AODs).
Não inicie nenhum betabloqueador antes do reparo do AAA.[2][42] No entanto, continue com o betabloqueador se o paciente já estiver tomando a dose adequada.[2]
Modificação lipídica.[42]
Inicie uma estatina pelo menos 4 semanas antes da cirurgia eletiva de AAA, se possível, para reduzir a morbidade e mortalidade cardiovascular; continue indefinidamente.[2][60][141][142] Consulte Hipercolesterolemia e Hipertrigliceridemia.
O uso de estatina perioperatório reduz os eventos cardiovasculares durante a cirurgia não cardíaca.[143]
Manejo do diabetes.[42] Consulte Diabetes do tipo 2 em adultos.
Manejo da hipertensão.[42] Consulte Hipertensão essencial.
Mais informações: treinamento físico pré-operatório
O treinamento pré-operatório reduziu as complicações cardíacas pós-cirúrgicas em um pequeno ensaio clínico randomizado e controlado com pacientes submetidos a reparo de AAA aberto ou endovascular.[144] Outra metanálise de ensaios clínicos randomizados e controlados (ECRCs) mostrou que o treinamento físico pré-operatório era geralmente seguro para pacientes com AAA, mas concluiu serem necessárias mais pesquisas para esclarecer a segurança entre pacientes com um AAA grande.[145] Uma revisão Cochrane e uma revisão sistemática separada da pré-reabilitação (treinamento físico) antes da cirurgia de AAA não mostraram nenhum benefício no desfecho.[146][147] Embora o treinamento físico pré-operatório possa ser benéfico para pacientes submetidos ao reparo de AAA, são necessárias investigações adicionais, com ECRCs, para que, só depois, ele possa ser recomendado de forma mais ampla.[148]
Profilaxia antibiótica
Administre antibióticos profiláticos ao paciente se ele estiver sendo submetido a EVAR ou reparo cirúrgico aberto para cobrir organismos Gram-positivos e Gram-negativos (ou seja, Staphylococcus aureus, Staphylococcus epidermidis e bacilos Gram-negativos entéricos) e prevenir a infecção do enxerto.[2]
Verifique os esquemas de antibioticoterapia no protocolo local; a cobertura com antibióticos de amplo espectro deve ser adaptada ao quadro clínico e às culturas do paciente.
Analgesia
Certifique-se de que o paciente obtenha alívio adequado da dor; as opções incluem analgesia epidural, analgesia controlada pelo paciente e colocação de cateteres para infusão contínua de agentes anestésicos locais na ferida.[2]
Profilaxia do tromboembolismo venoso (TEV)
Administre profilaxia do tromboembolismo venoso a todos os pacientes submetidos a reparo cirúrgico do AAA.[77][149]
Considere a profilaxia farmacológica do tromboembolismo venoso com heparina de baixo peso molecular (HBPM) por, no mínimo, 7 dias, para um paciente submetido a EVAR ou reparo cirúrgico aberto se o risco de tromboembolismo venoso superar o risco de sangramento.[149]
Se a profilaxia farmacológica do tromboembolismo venoso for contraindicada, considere a profilaxia mecânica do tromboembolismo venoso com meias antiembolia (de compressão) ou compressão pneumática intermitente. Continue usando até que o paciente não apresente mais redução significativa da mobilidade em relação à mobilidade normal ou prevista.[149]
Em caso de um AAA roto, o paciente correrá maior risco de sangramento importante, mas também correrá alto risco de tromboembolismo venoso. Portanto:[2]
Considere o uso de profilaxia mecânica com compressão pneumática intermitente até que o risco de sangramento importante diminua.[2]
Uma vez que o risco de sangramento importante tenha diminuído (geralmente dentro de 24-48 horas após a cirurgia, a menos que haja sinais de sangramento contínuo ou de uma coagulopatia clinicamente significativa), inicie a profilaxia farmacológica com HBPM ou heparina não fracionada.[2]
Continue a profilaxia farmacológica durante toda a permanência hospitalar e, também, após a alta em certos pacientes, com base nos fatores de risco individuais e no nível de mobilidade.[2]
A European Society for Vascular Surgery também recomenda considerar a administração intraoperatória de heparina uma vez que o sangramento provocado pela ruptura tenha sido controlado.[2]
Transfusão sanguínea
Salvamento celular ou um dispositivo de ultrafiltração é recomendado se grande sangramento for previsto ou o risco de transmissão de doenças do banco de sangue for considerado alto.[77] O resgate intraoperatório de células e a retransfusão devem ser considerados durante o reparo aberto do AAA.[2]
A transfusão de sangue é recomendada se o nível de hemoglobina intraoperatório for <100 g/L na presença de sangramento contínuo.[77] Considar o uso de plasma fresco congelado e plaquetas e concentrado de eritrócitos na razão de 1:1:1.[77][150]
Monitoramento
Todos os pacientes com AAA submetidos a reparo cirúrgico aberto e pacientes de alto risco submetidos a reparo endovascular devem ter monitoramento pós-operatório precoce em uma unidade de terapia intensiva ou de alta dependência de cuidados.[2]
Cateteres de artéria pulmonar não devem ser utilizados rotineiramente em cirurgias da aorta, a menos que haja um alto risco de um distúrbio hemodinâmico importante.[77] Acesso venoso central é recomendado para todos os pacientes submetidos ao reparo aberto de aneurisma.[77]
O fato de evitar a hipotermia durante o reparo aberto e o EVAR pode reduzir o tempo de hospitalização, a permanência na UTI e as taxas de disfunção dos órgãos.[151]
Reparo endovascular do aneuriama (EVAR)
O EVAR oferece maiores benefícios do que o reparo cirúrgico aberto em caso de AAA roto infrarrenal na maioria dos pacientes, particularmente para homens com mais de 70 anos e mulheres de qualquer idade.[2][42] Os benefícios do EVAR incluem menor mortalidade perioperatória e menos tempo de permanência hospitalar em geral (e cuidados intensivos, em particular).[42][103] No entanto, o reparo cirúrgico aberto pode proporcionar uma melhor relação risco/benefício para homens com menos de 70 anos.[42] Em pacientes jovens com suspeita de doenças do tecido conjuntivo e um AAA, o reparo cirúrgico aberto é recomendado como primeira opção.[2] Se tolerada, deve-se considerar anestesia local para pacientes submetidos ao EVAR.[2][42]
O EVAR envolve a colocação endoluminal transfemoral de uma endoprótese coberta dentro da aorta, isolando assim a parede do aneurisma de pressões sistêmicas, evitando a ruptura e permitindo o encolhimento do saco. O endoenxerto pode ser implantado por via percutânea com dispositivos comuns ou depois de expor as artérias femorais cirurgicamente. Uma revisão Cochrane não constatou nenhuma diferença entre as técnicas após um acompanhamento curto (de 6 meses), exceto pelo fato de que a abordagem percutânea pode ser mais rápida.[152]
[  ]
As técnicas para procedimentos complexos de EVAR estão evoluindo e incluem EVAR fenestrado/ramificado (consulte abaixo) e manejo com enxertos de chaminé.[2] Dados de longo prazo para a durabilidade de dispositivos de baixo perfil estão faltando.
]
As técnicas para procedimentos complexos de EVAR estão evoluindo e incluem EVAR fenestrado/ramificado (consulte abaixo) e manejo com enxertos de chaminé.[2] Dados de longo prazo para a durabilidade de dispositivos de baixo perfil estão faltando.
[Figure caption and citation for the preceding image starts]: Vários enxertos de endoprótese endovascular usados para o reparo de aneurisma endovascular (EVAR)University of Michigan, mais especificamente os casos do Dr. Upchurch, representando os Departamentos de Cirurgia vascular e Radiologia [Citation ends].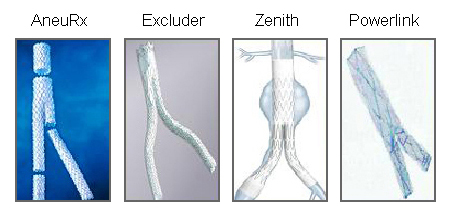 [Figure caption and citation for the preceding image starts]: Reparo endovascular do aneuriama (EVAR)University of Michigan, mais especificamente os casos do Dr. Upchurch, representando os Departamentos de Cirurgia vascular e Radiologia [Citation ends].
[Figure caption and citation for the preceding image starts]: Reparo endovascular do aneuriama (EVAR)University of Michigan, mais especificamente os casos do Dr. Upchurch, representando os Departamentos de Cirurgia vascular e Radiologia [Citation ends].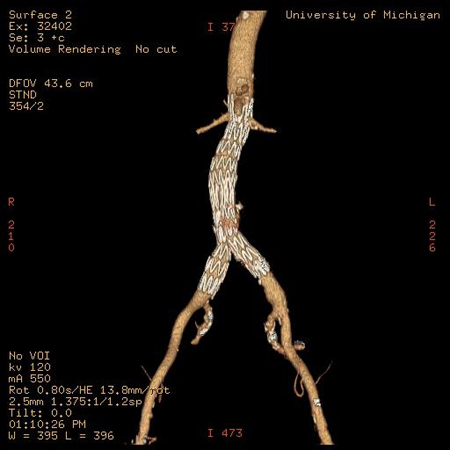
A avaliação da adequação do EVAR deve ser feita através de angiotomografia com cortes de 0.5 mm. É essencial que o operador esteja familiarizado com as instruções específicas de uso da endoprótese a ser usada.
Complicações do EVAR podem incluir vazamento (endoleak), oclusão do enxerto e migração do enxerto com a expansão do colo aórtico.[2] Normalmente, essas complicações são detectadas na realização de uma angiografia ou em exames de imagem pós-operatórios, embora estudos sugiram que a angiotomografia intraoperatória possa ser um método mais sensível de detectar complicações do EVAR.[153] Uma revisão sistemática relatou dilatação do colo aórtico em 24.6% dos EVARs (9439 homens incluídos), o que causou maiores taxas de vazamento (endoleak) tipo I, migração do enxerto e reintervenção.[154]
Como adjuvante do EVAR, a oclusão da artéria ilíaca interna (AII) unilateral ou bilateral pode ser aceitável em certas situações anatômicas para pacientes de alto risco para o reparo cirúrgico aberto. A claudicação dos glúteos ocorrerá em 27.9% dos pacientes após a oclusão da AII, embora isso remita em 48% dos casos após uma média de 21.8 meses. É menos provável que ela ocorra após uma oclusão unilateral (RC de 0.57, IC de 95% 0.36 a 0.91). A disfunção erétil ocorreu em 10% a 14% dos homens após uma oclusão da AII.[77][155]
Técnicas de revascularização da artéria ilíaca interna, que envolvem dispositivos especiais para a ramificação ilíaca, têm alto índice de sucesso técnico (até 97.5%) e estão associadas a baixa morbidade (por exemplo, taxa de claudicação das nádegas de 2.15% a 4.1%).[156][157] Há uma falta de dados de ensaios clínicos randomizados e controlados que comparem a oclusão da artéria ilíaca interna com a revascularização da artéria interna.[158] Em pacientes com neoplasia intra-abdominal síncrona, o EVAR reduz a mortalidade e o atraso entre o tratamento das duas patologias, apesar do risco significativo de eventos trombóticos.[159][160]
Recomenda-se vigilância anual e vitalícia com ultrassonografia ou TC após reparo endovascular de AAAs para detectar complicações tardias e identificar falha tardia do dispositivo e progressão da doença.[2][77]
Reparo por via aberta
Deve-se considerar o reparo aberto em pacientes com AAA roto se o EVAR não for adequado.[42] É provável que ele proporcione uma melhor relação risco/benefício em homens com menos de 70 anos de idade.[42]
Geralmente, o reparo aberto é transperitoneal, mas pode ser retroperitoneal.[2] Quando se obtém o controle da aorta proximal e distal, o aneurisma é aberto, as artérias do ramo com retorno do sangue são ligadas, e um enxerto protético é suturado da aorta proximal normal até a aorta distal normal (ou segmentos ilíacos). Quando o fluxo é restaurado para as artérias ilíacas, o saco aneurismático se fecha sobre o enxerto.[161] Deve ser considerada uma abordagem retroperitoneal para os pacientes com aneurisma que se estende para o segmento da aorta justarrenal e/ou visceral, ou na presença de um aneurisma inflamatório, rim em forma de ferradura ou abdome hostil.[77][162][163]
Enxertos de tubos retos são recomendados para o reparo na ausência de doença significativa das artérias ilíacas.[77] A anastomose proximal aórtica deve ser realizada o mais próximo possível das artérias renais.[77] Recomenda-se que todas as partes de um enxerto aórtico sejam excluídas do contato direto com o conteúdo intestinal da cavidade peritoneal.[77] O reimplante de uma artéria mesentérica inferior (AMI) patente deve ser considerado em circunstâncias que sugiram um risco elevado de isquemia do cólon (ou seja, doença celíaca ou doença oclusiva arterial mesentérica superior associadas, artéria mesentérica sinuosa e alargada, história prévia de ressecção do cólon, incapacidade de preservar a perfusão hipogástrica, sangramento significativo ou hipotensão intraoperatória, baixo retorno do sangue na AMI quando o enxerto está aberto, baixo fluxo no Doppler nos vasos do cólon ou se o cólon estiver com aparência isquêmica).[2][77][164]
As complicações do reparo aberto incluem eventos cardíacos e pulmonares, isquemia mesentérica, insuficiência renal, sangramentos, infecções da ferida operatória e do enxerto, isquemia da medula espinhal/paraplegia, embolização de membro/isquemia do membro e complicações tardias com o enxerto (como fístula aortoentérica e pseudoaneurisma da aorta).[165]
EVAR fenestrado (FEVAR) e endopróteses ramificadas (bEVAR)
Para pacientes com AAA complexo e risco cirúrgico padrão, o reparo aberto ou EVAR deve ser considerado com base na aptidão, anatomia e preferência do paciente. Para pacientes com AAA complexo e alto risco cirúrgico, o EVAR com tecnologias fenestradas e ramificadas deve ser considerado como terapia de primeira linha. O FEVAR e endoenxertos ramificados se tornaram o tratamento de primeira escolha para AAAs complexos na maioria dos centros de alto volume.[2] Esses procedimentos são alternativas viáveis ao reparo aberto do AAA justarrenal e suprarrenal, ou para aqueles com AAA em que um pescoço curto ou doente impede o reparo convencional.[2] Os endoenxertos FEVAR possuem orifícios que correspondem à posição das artérias ramificadas dentro da aorta e permitem o reparo endovascular de aneurismas complexos. Uma análise combinada de 7 estudos retrospectivos (incluindo 772 pacientes) sugeriu mortalidade favorável e taxas alvo de patência dos vasos viscerais (8.0% e 95.4% em 1 ano, respectivamente), embora outra metanálise (7061 pacientes) não sugira nenhuma diferença de mortalidade com o FEVAR, mas um possível aumento do risco de reintervenção; o procedimento é realizado rotineiramente em alguns centros.[166][167][168] Dispositivos ramificados com ramos internos ou externos envolvem uma cobertura aórtica mais extensa em comparação com dispositivos fenestrados.[2] A European Society for Vascular Surgery afirma que eles devem ser reservados a aneurismas da aorta toracoabdominal do tipo 4 (que envolvem toda a aorta abdominal, desde o nível do diafragma até a bifurcação aórtica).[2]
Escolha de reparo eletivo
As diretrizes recomendam uma abordagem individualizada para a escolha cirúrgica.[2][8][42][77][169] Os fatores que influenciarão a decisão incluem: determinantes anatômicos (por exemplo, diâmetro do aneurisma, comprimento do pescoço, diâmetro do pescoço); expectativa de vida, sexo e comorbidades; e risco perioperatório.[2][42][77][170] O EVAR deve ser considerado em pacientes não indicados para cirurgia aberta que:[42][77][139]
Apresentem alto risco perioperatório (como patologia abdominal concomitante ou riscos anestésicos e/ou comorbidades que seriam uma contraindicação ao reparo cirúrgico aberto) e
Tenham uma anatomia congruente com os respectivos critérios de elegibilidade do fabricante para enxerto de stent conforme determinado nas instruções de uso, e
São capazes de satisfazer o regime de vigilância obrigatório após a cirurgia.
Pacientes com menor risco perioperatório e anatomia favorável também podem ser candidatos ao EVAR.[171][172] Deve-se levar em consideração a segurança e a durabilidade do reparo (necessidade de nova intervenção).
O reparo aberto pode ser a opção preferida em pacientes que:
Apresentem menor risco perioperatório, e
São relativamente jovens.
No Reino Unido, 61% dos casos de aneurisma da aorta abdominal eletivo infrarrenal e 89% dos aneurismas da aorta abdominal complexos foram tratados com EVAR durante 2018-2020.[173]
Quando o paciente estiver estável e o reparo cirúrgico urgente, se indicado, tiver sido priorizado, a etiologia infecciosa ou inflamatória deve ser abordada.
AAA infeccioso
Se o paciente tiver suspeita de aneurisma infeccioso, o diagnóstico precoce, o tratamento imediato com antibióticos e o reparo cirúrgico urgente são essenciais para melhorar os desfechos.[2] O reparo cirúrgico aberto tem sido tradicionalmente considerado a opção preferida para aneurismas infecciosos, embora dados mais recentes sugiram que o EVAR pode estar associado a desfechos iguais ou superiores.[2][8][174] O desbridamento extensivo é muitas vezes necessário. Há um alto risco de complicações infecciosas secundárias, podendo ser necessária uma cirurgia adicional para novas lesões infecciosas.
Culturas intraoperatórias devem ser realizadas para orientar de maneira precisa a antibioticoterapia subsequente; no entanto, muitas vezes são administrados antibióticos empíricos, pois hemoculturas periféricas e culturas de amostras cirúrgicas são negativas em uma grande proporção de pacientes.[8] A antibioticoterapia prolongada (de 4-6 semanas de duração até por toda a vida) pode ser indicada dependendo do patógeno específico, do tipo de reparo operatório e do estado imunológico do paciente.[2][8]
AAA inflamatório
A aortite inflamatória (causada, por exemplo, pela arterite de Takayasu ou arterite de células gigantes) é tratada com corticosteroide em altas doses e cirurgia.[8][102] Como o manejo ideal de pacientes com aortite inflamatória permanece incerto, esses pacientes devem ser tratados e acompanhados rigorosamente por uma equipe multidisciplinar.[2] O tamoxifeno tem sido usado de forma isolada ou em combinação com corticosteroides na aortite inflamatória.[2][175][176] No entanto, a superioridade da terapia combinada, em comparação com os corticosteroides isoladamente, permanece não comprovada.[177]
O tratamento cirúrgico do AAA inflamatório representa um desafio diferente para os cirurgiões, em comparação com os AAAs degenerativos padrão, devido ao aumento do risco de lesões iatrogênicas no intestino, veia cava, veia ilíaca e lesões ureterais durante a reparação por técnica aberta, e a maior resposta inflamatória à implantação das endopróteses.[2] A colocação de endoprótese pré-operatória pode ser necessária para liberar uma hidronefrose e auxiliar na identificação do ureter durante a cirurgia.[2][175] Evidências de alto nível que comparem o reparo por via aberta ao EVAR não estão disponíveis.[175][178] Ainda não está claro se o EVAR isolado tem algum efeito benéfico sobre a hidronefrose, e a fibrose retroperitoneal parece remitir de maneira mais lenta, em comparação com o reparo por via aberta.[175]
O uso deste conteúdo está sujeito ao nosso aviso legal