Íleo paralítico
- Visão geral
- Teoria
- Diagnóstico
- Tratamento
- ACOMPANHAMENTO
- Recursos
Algoritmo de tratamento
Observe que as formulações/vias e doses podem diferir entre nomes e marcas de medicamentos, formulários de medicamentos ou localidades. As recomendações de tratamento são específicas para os grupos de pacientes:ver aviso legal
íleo paralítico pós-operatório
jejum e hidratação intravenosa
Todos os pacientes com íleo paralítico devem permanecer em jejum e requerem hidratação intravenosa.
A escolha inicial da solução intravenosa dependerá do estado de hidratação inicial do paciente e da presença de comorbidades.
Um paciente significativamente hipovolêmico pode se beneficiar de uma dose em bolus de vários litros de soro fisiológico.
Após essa hidratação inicial, a solução intravenosa de manutenção deverá ser fisiológica e fornecer alguma quantidade de glicose.
Essa taxa deve ser adaptada ao débito urinário e à hemodinâmica do paciente.
Durante esse período, os eletrólitos devem ser monitorados e repostos, se necessário.
redução da analgesia por opioides ± substituição com analgesia não opioide
Tratamento recomendado para TODOS os pacientes no grupo de pacientes selecionado
Foi mostrado que os analgésicos opioides retardam a motilidade intestinal.[3]Wattchow D, Heitmann P, Smolilo D, et al. Postoperative ileus-an ongoing conundrum. Neurogastroenterol Motil. 2021 May;33(5):e14046. http://www.ncbi.nlm.nih.gov/pubmed/33252179?tool=bestpractice.com
Foi mostrado que a diminuição do uso de analgésicos opioides administrados sistemicamente ajuda a prevenir o surgimento de íleo paralítico pós-operatório.[28]Gustafsson UO, Scott MJ, Hubner M, et al. Guidelines for perioperative care in elective colorectal surgery: Enhanced Recovery After Surgery (ERAS(®)) Society recommendations: 2018. World J Surg. 2019 Mar;43(3):659-95. https://link.springer.com/article/10.1007/s00268-018-4844-y http://www.ncbi.nlm.nih.gov/pubmed/30426190?tool=bestpractice.com A analgesia por opioides controlada pelo paciente reduz a quantidade total de opioide administrado em comparação com a administração de analgésicos de forma intermitente durante o dia por um enfermeiro.[33]Chan KC, Cheng YJ, Huang GT, et al. The effect of IVPCA morphine on post-hysterectomy bowel function. Acta Anaesthesiol Sin. 2002 Jun;40(2):61-4. http://www.ncbi.nlm.nih.gov/pubmed/12194392?tool=bestpractice.com
Entre os adjuvantes úteis para o controle da dor, incluem-se os anti-inflamatórios não esteroidais (AINEs), como o cetorolaco, e outros analgésicos não opioides, como o paracetamol.[38]Schlachta CM, Burpee SE, Fernandez C, et al. Optimizing recovery after laparoscopic colon surgery (ORAL-CS): effect of intravenous ketorolac on length of hospital stay. Surg Endosc. 2007 Dec;21(12):2212-9. http://www.ncbi.nlm.nih.gov/pubmed/17440782?tool=bestpractice.com [39]Chen JY, Wu GJ, Mok MS, et al. Effect of adding ketorolac to intravenous morphine patient-controlled analgesia on bowel function in colorectal surgery patients: a prospective, randomized, double-blind study. Acta Anaesthesiol Scand. 2005 Apr;49(4):546-51. http://www.ncbi.nlm.nih.gov/pubmed/15777304?tool=bestpractice.com [40]McNicol ED, Ferguson MC, Schumann R. Single-dose intravenous ketorolac for acute postoperative pain in adults. Cochrane Database Syst Rev. 2021 May 17;5(5):CD013263. https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD013263.pub2/full http://www.ncbi.nlm.nih.gov/pubmed/33998669?tool=bestpractice.com [41]Bell S, Rennie T, Marwick CA, et al. Effects of peri-operative nonsteroidal anti-inflammatory drugs on post-operative kidney function for adults with normal kidney function. Cochrane Database Syst Rev. 2018 Nov 29;11(11):CD011274. https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD011274.pub2/full http://www.ncbi.nlm.nih.gov/pubmed/30488949?tool=bestpractice.com [42]Chen JY, Ko TL, Wen YR, et al. Opioid-sparing effects of ketorolac and its correlation with the recovery of postoperative bowel function in colorectal surgery patients: a prospective randomized double-blinded study. Clin J Pain. 2009 Jul-Aug;25(6):485-9. http://www.ncbi.nlm.nih.gov/pubmed/19542795?tool=bestpractice.com [84]Blank JJ, Berger NG, Dux JP, et al. The impact of intravenous acetaminophen on pain after abdominal surgery: a meta-analysis. J Surg Res. 2018 Jul;227:234-45. http://www.ncbi.nlm.nih.gov/pubmed/29804858?tool=bestpractice.com [85]Chou R, Gordon DB, de Leon-Casasola OA, et al. Management of postoperative pain: a clinical practice guideline from the American Pain Society, the American Society of Regional Anesthesia and Pain Medicine, and the American Society of Anesthesiologists' Committee on Regional Anesthesia, Executive Committee, and Administrative Council. J Pain. 2016 Feb;17(2):131-57. https://www.doi.org/10.1016/j.jpain.2015.12.008 http://www.ncbi.nlm.nih.gov/pubmed/26827847?tool=bestpractice.com
A administração de um anestésico local por via epidural constitui outra alternativa à analgesia por opioides.[3]Wattchow D, Heitmann P, Smolilo D, et al. Postoperative ileus-an ongoing conundrum. Neurogastroenterol Motil. 2021 May;33(5):e14046. http://www.ncbi.nlm.nih.gov/pubmed/33252179?tool=bestpractice.com [34]Senagore AJ, Delaney CP, Mekhail N, et al. Randomized clinical trial comparing epidural anaesthesia and patient-controlled analgesia after laparoscopic segmental colectomy. Br J Surg. 2003 Oct;90(10):1195-9. http://www.ncbi.nlm.nih.gov/pubmed/14515286?tool=bestpractice.com [35]Marret E, Remy C, Bonnet F. Meta-analysis of epidural analgesia versus parenteral opioid analgesia after colorectal surgery. Br J Surg. 2007 Jun;94(6):665-73. https://onlinelibrary.wiley.com/doi/full/10.1002/bjs.5825 http://www.ncbi.nlm.nih.gov/pubmed/17514701?tool=bestpractice.com [36]Gendall KA, Kennedy RR, Watson AJ, et al. The effect of epidural analgesia on postoperative outcome after colorectal surgery. Colorectal Dis. 2007 Sep;9(7):584-98;discussion 598-600. http://www.ncbi.nlm.nih.gov/pubmed/17506795?tool=bestpractice.com [37]Carli F, Trudel JL, Belliveau P. The effect of intraoperative thoracic epidural anesthesia and postoperative analgesia on bowel function after colorectal surgery: a prospective, randomized trial. Dis Colon Rectum. 2001 Aug;44(8):1083-9. http://www.ncbi.nlm.nih.gov/pubmed/11535845?tool=bestpractice.com [53]Guay J, Nishimori M, Kopp SL. Epidural local anesthetics versus opioid-based analgesic regimens for postoperative gastrointestinal paralysis, vomiting, and pain after abdominal surgery: a Cochrane review. Anesth Analg. 2016 Dec;123(6):1591-602. https://journals.lww.com/anesthesia-analgesia/fulltext/2016/12000/epidural_local_anesthetics_versus_opioid_based.33.aspx http://www.ncbi.nlm.nih.gov/pubmed/27870743?tool=bestpractice.com
Para obter mais informações sobre medidas perioperatórias para prevenir o íleo paralítico pós-operatório, consulte Prevenção.
Opções primárias
paracetamol: <51 kg de peso corporal: 15 mg/kg por via intravenosa a cada 4-6 horas quando necessário, máximo de 60 mg/kg/dia; ≥51 kg de peso corporal: 1000 mg por via intravenosa a cada 4-6 horas quando necessário, máximo de 4000 mg/dia (3000 mg/dia se houver fatores de risco para hepatotoxicidade)
ou
cetorolaco: adultos <65 anos de idade e/ou ≥50 kg: 30 mg por via intramuscular/intravenosa a cada 6 horas quando necessário, máximo de 120 mg/dia; adultos ≥65 anos de idade e/ou <50 kg: 15 mg por via intramuscular/intravenosa a cada 6 horas quando necessário, máximo de 60 mg/dia
descompressão nasogástrica
Tratamento recomendado para TODOS os pacientes no grupo de pacientes selecionado
A sonda nasogástrica deve ser colocada de forma que a sua extremidade fique no estômago, fixada e conectada à sucção.
Deve-se medir o débito gástrico, e o volume perdido deve ser reposto com solução salina fisiológica intravenosa.
A decisão de remover a sonda nasogástrica é baseada no débito medido ao longo do tempo e na resolução clinica do íleo paralítico. O paciente é avaliado quanto a ausência de cólicas e a distensão abdominal, diminuição do débito através da sonda nasogástrica e eliminação de fezes e flatos com o objetivo de se remover a sonda nasogástrica. Pode ser necessário reinserir a sonda nasogástrica, caso o paciente apresente novamente evidências de íleo paralítico continuado, com distensão abdominal e vômitos.
No entanto, estudos recentes mostraram que a descompressão nasogástrica rotineira é desnecessária e pode ser prejudicial. Portanto, o uso rotineiro deixou de ser recomendado, e a descompressão nasogástrica é reservada para uso seletivo.[86]Verma R, Nelson RL. Prophylactic nasogastric decompression after abdominal surgery. Cochrane Database Syst Rev. 2007 Jul 18;2007(3):CD004929. https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD004929.pub3/full http://www.ncbi.nlm.nih.gov/pubmed/17636780?tool=bestpractice.com
Frequentemente é realizada descompressão orogástrica no período intraoperatório, mas a sonda é removida ao se concluir a cirurgia.[28]Gustafsson UO, Scott MJ, Hubner M, et al. Guidelines for perioperative care in elective colorectal surgery: Enhanced Recovery After Surgery (ERAS(®)) Society recommendations: 2018. World J Surg. 2019 Mar;43(3):659-95. https://link.springer.com/article/10.1007/s00268-018-4844-y http://www.ncbi.nlm.nih.gov/pubmed/30426190?tool=bestpractice.com
causa não cirúrgica
jejum e hidratação intravenosa
Todos os pacientes com íleo paralítico devem permanecer em jejum e requerem hidratação intravenosa.
A escolha inicial da solução intravenosa dependerá do estado de hidratação inicial do paciente e da presença de comorbidades.
Um paciente significativamente hipovolêmico pode se beneficiar de uma dose em bolus de vários litros de soro fisiológico.
Após essa hidratação inicial, a solução intravenosa de manutenção deverá ser fisiológica e fornecer alguma quantidade de glicose.
Os fluidos devem ser inicialmente administrados a uma taxa de manutenção que depende do peso corporal. Essa taxa deve ser adaptada ao débito urinário e à hemodinâmica do paciente.
Em pacientes que recebem tratamento farmacológico que pode exacerbar o íleo paralítico (por exemplo, opiáceos, anticolinérgicos), a descontinuação ou a redução desses medicamentos ajuda a remitir o íleo paralítico.
Anormalidades eletrolíticas (hipocalemia, hipocloremia, alcalose e hipermagnesemia) podem ser uma consequência do íleo paralítico ou um fator de exacerbação. Durante esse período, os eletrólitos devem ser monitorados e repostos, se necessário.
tratamento das afecções subjacentes
Tratamento recomendado para TODOS os pacientes no grupo de pacientes selecionado
As afecções subjacentes, como sepse, infecções intra-abdominais ou outras doenças sistêmicas, devem ser tratadas.
As doenças sistêmicas associadas à hipomotilidade intestinal incluem diabetes mellitus, doença de Chagas, esclerodermia e doenças neurológicas.
O uso crônico de opioides contribui para o íleo paralítico, mas a interrupção ou redução do uso desses medicamentos deve ser manejada com cuidado nesses pacientes devido ao risco de sintomas de abstinência.[88]American Society of Addiction Medicine. The ASAM national practice guideline for the treatment of opioid use disorder: 2020 focused update. J Addict Med. 2020 Mar/Apr;14(2s suppl 1):1-91. https://www.doi.org/10.1097/ADM.0000000000000633 http://www.ncbi.nlm.nih.gov/pubmed/32511106?tool=bestpractice.com [89]Müller-Lissner S, Bassotti G, Coffin B, et al. Opioid-induced constipation and bowel dysfunction: a clinical guideline. Pain Med. 2017 Oct 1;18(10):1837-63. https://pmc.ncbi.nlm.nih.gov/articles/PMC5914368 http://www.ncbi.nlm.nih.gov/pubmed/28034973?tool=bestpractice.com
descompressão nasogástrica
Tratamento adicional recomendado para ALGUNS pacientes no grupo de pacientes selecionado
A sonda nasogástrica deve ser colocada de forma que a sua extremidade fique no estômago e permaneça fixada e conectada à sucção.
Deve-se medir o débito gástrico, e o volume perdido deve ser reposto com solução salina fisiológica intravenosa.
A decisão de remover a sonda nasogástrica é baseada no débito medido ao longo do tempo e na resolução clinica do íleo paralítico. O paciente é avaliado quanto a ausência de cólicas e a distensão abdominal, diminuição do débito através da sonda nasogástrica e eliminação de fezes e flatos com o objetivo de se remover a sonda nasogástrica. Pode ser necessário reinserir a sonda nasogástrica, caso o paciente apresente novamente evidências de íleo paralítico continuado, com distensão abdominal e vômitos.
No entanto, estudos recentes mostraram que a descompressão nasogástrica rotineira é desnecessária e pode ser prejudicial. Portanto, o uso rotineiro deixou de ser recomendado, e a descompressão nasogástrica é reservada para uso seletivo.[86]Verma R, Nelson RL. Prophylactic nasogastric decompression after abdominal surgery. Cochrane Database Syst Rev. 2007 Jul 18;2007(3):CD004929. https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD004929.pub3/full http://www.ncbi.nlm.nih.gov/pubmed/17636780?tool=bestpractice.com
íleo paralítico que dure mais de 3 dias ou que prolongue a recuperação pós-operatória
nutrição parenteral
Esses pacientes podem ficar em jejum por várias semanas.
A nutrição parenteral é recomendada para pacientes que não fazem ingestão oral por mais de 7 dias.[3]Wattchow D, Heitmann P, Smolilo D, et al. Postoperative ileus-an ongoing conundrum. Neurogastroenterol Motil. 2021 May;33(5):e14046. http://www.ncbi.nlm.nih.gov/pubmed/33252179?tool=bestpractice.com [78]Gero D, Gié O, Hübner M, et al. Postoperative ileus: in search of an international consensus on definition, diagnosis, and treatment. Langenbecks Arch Surg. 2017 Feb;402(1):149-58. http://www.ncbi.nlm.nih.gov/pubmed/27488952?tool=bestpractice.com No entanto, a nutrição parenteral é benéfica em pacientes que permaneçam em repouso intestinal durante mais de 14 dias ou que apresentem desnutrição subjacente.[87]Sandstrom R, Drott C, Hyltander A, et al. The effect of postoperative intravenous feeding (TPN) on outcome following major surgery evaluated in a randomized study. Ann Surg. 1993 Feb;217(2):185-95. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1242758 http://www.ncbi.nlm.nih.gov/pubmed/8439216?tool=bestpractice.com Deve-se verificar os eletrólitos diariamente para se identificar eventuais anormalidades eletrolíticas associadas a alimentação intravenosa pós-operatória e ao estado de jejum.
Os benefícios de se iniciar a nutrição parenteral antes de transcorridos 7 dias são menores que os riscos associados à nutrição parenteral e ao acesso venoso central.
Na maioria dos pacientes, o estado de "inanição" pós-operatório não está associado a um aumento da morbidade ou da mortalidade.
A inserção de uma linha venosa central está associada a um risco elevado de lesão iatrogênica nos vasos próximos, pneumotórax, trombose venosa profunda (TVP) e bacteremia associada a linha central.[Figure caption and citation for the preceding image starts]: Tomografia computadorizada (TC) mostrando estômago significativamente dilatadoDo acervo pessoal da Dra. Paula I. Denoya [Citation ends].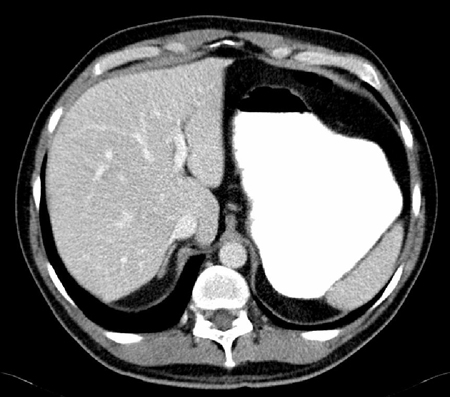 [Figure caption and citation for the preceding image starts]: Sonda nasogástricaDo acervo pessoal da Dra. Paula I. Denoya [Citation ends].
[Figure caption and citation for the preceding image starts]: Sonda nasogástricaDo acervo pessoal da Dra. Paula I. Denoya [Citation ends].

Escolha um grupo de pacientes para ver nossas recomendações
Observe que as formulações/vias e doses podem diferir entre nomes e marcas de medicamentos, formulários de medicamentos ou localidades. As recomendações de tratamento são específicas para os grupos de pacientes. Ver aviso legal
O uso deste conteúdo está sujeito ao nosso aviso legal