Abordagem
A maioria dos casos de aspergilose invasiva (AI) ocorre em pacientes com deficiência imunológica subjacente. Deve-se prestar muita atenção ao estado imunológico do paciente. Os pacientes em alto risco de AI são aqueles com neutropenia grave prolongada (>10 dias) e os receptores de células-tronco alogênicas com doença do enxerto contra o hospedeiro (DECH) aguda ou crônica.
A AI também deve ser considerada em:
Receptores de transplante de órgão sólido (especialmente em receptores de pulmão e/ou coração)
Pacientes com doença granulomatosa crônica
Pacientes submetidos a corticosteroides em altas doses ou medicamentos imunossupressores
Pacientes com diabetes mellitus mal controlado
Pacientes com distúrbios de imunodeficiência primários.
A falta de características clínicas específicas impede o diagnóstico. O diagnóstico precoce é fundamental para reduzir a mortalidade e a morbidade. No paciente de alto risco com sinais e sintomas clínicos suspeitos de AI, uma tomografia computadorizada (TC) de alta resolução/ressonância nuclear magnética (RNM), biomarcadores (por exemplo, beta-D-glicano sérico, galactomanana de Aspergillus), exame de escarro, exame do líquido de lavagem broncoalveolar (LBA) e biópsia tecidual para histopatologia e cultura de micro-organismos são úteis no diagnóstico.
Os testes moleculares, como o teste de reação em cadeia da polimerase do líquido da LBA e/ou amostra de tecido, são úteis no diagnóstico precoce de AI.[66]
[  ]
]
A aspergilose pulmonar crônica (APC) deve ser considerada em pacientes com doença pulmonar crônica e radiografias mostrando as lesões de massa intracavitárias. Esses achados geralmente são incidentais em uma radiografia torácica de rotina ou na avaliação de hemoptise. As diretrizes sugerem que o diagnóstico de APC requer exames de imagem, evidência direta de infecção por Aspergillus ou uma resposta imunológica ao Aspergillus e exclusão de outros diagnósticos, com a doença presente há pelo menos 3 meses.[2][3] Consulte Critérios diagnósticos.
Manifestações clínicas
A aspergilose pulmonar invasiva apresenta-se com febre, tosse não produtiva leve a moderada e dor torácica pleurítica. Dor torácica pleurítica em um paciente neutropênico ou em um receptor de células-tronco com DECH deve levantar forte suspeita de AI. Hemoptise pode estar presente e sugerir a presença de uma lesão pulmonar erodindo para um vaso sanguíneo adjacente. Pode ocorrer hemoptise catastrófica, especialmente com a recuperação de neutrófilos após a quimioterapia. Dispneia pode estar presente, sugerindo um comprometimento pulmonar extenso e pode ser observada com a rejeição do pulmão transplantado.
A sinusite invasiva pode se apresentar com cefaleia, congestão, dor facial com ou sem drenagem dos seios nasais ou sensibilidade dos seios nasais. Pode ocorrer envolvimento concomitante dos seios nasais e dos pulmões.
A extensão da sinusite para o olho/cérebro pode causar proptose, paralisia de nervos cranianos, estado mental alterado e convulsões.
O comprometimento da pele não é incomum na AI. Um ou vários nódulos distintos, levemente sensíveis à palpação, eritematosos, de tamanhos diferentes, com um centro necrótico e muitas vezes ulcerado (ectima gangrenoso) são mais frequentemente observados em pacientes imunocomprometidos. Eles podem ocorrer na doença disseminada ou como invasão local após trauma. Ocasionalmente, queimaduras ou feridas cirúrgicas podem ser infectadas por Aspergillus.
Os sintomas da APC incluem tosse crônica, dispneia, desconforto torácico, perda de peso e mal-estar.[4] O aspergiloma simples é muitas vezes assintomático. Ele pode se apresentar como uma hemoptise leve autolimitada; porém, pode ocorrer hemoptise grave em uma minoria de casos.
Exames por imagem
AI pulmonar
A radiografia torácica pode revelar nódulos, condensação ou frequentemente infiltrados inespecíficos. Muitas vezes a radiografia torácica não revela nenhuma anormalidade. Se o índice de suspeita for alto, deve-se obter uma TC do tórax.
A TC de alta resolução do tórax é o método radiológico preferencial, já que é útil para detectar lesões iniciais sugestivas de aspergilose pulmonar. A imagem pode mostrar um ou vários nódulos espalhados em um ou nos dois pulmões, geralmente na periferia dos campos pulmonares. Nódulos menores (<1 cm), opacidades em vidro fosco e consolidação são características inespecíficas e não sugerem necessariamente AI.[67] A presença de macronódulos (1 cm ou mais) em um paciente de alto risco é extremamente sugestiva de AI e pode ser observada em outras doenças inclusive outras infecções fúngicas invasivas, tuberculose, nocardiose e infecções bacterianas.[67] No paciente leucêmico com neutropenia, a doença em estágio inicial é caracterizada por uma opacidade que corresponde a hemorragia/edema ao redor dos nódulos ("sinal de halo").[68] Com a melhora clínica (por exemplo, reversão da imunodeficiência subjacente), o sinal de halo pode desaparecer. O "sinal do crescente aéreo" pode ser observado em vez disso. É indicativo de uma lesão necrótica se contraindo do tecido pulmonar viável, criando uma cavidade na qual o ar fica preso. O sinal de halo é característico de doença inicial e por isso é útil no diagnóstico precoce, enquanto que o sinal do crescente aéreo indique que a doença está presente há >6 a 7 dias. A terapia iniciada em pacientes com o sinal de halo está associada a um melhor desfecho.[69] Durante a terapia, as lesões nodulares inicialmente aumentam, sugerindo que o processo poderia estar se agravando. No entanto, após cerca de 7 dias de terapia, as TCs mostram uma melhora. Macronódulos pulmonares, o sinal de halo e o sinal do crescente aéreo foram melhor estudados em pacientes com AI e neoplasia hematológica ou transplante de células-tronco. Características radiológicas não são tão bem evidenciadas em outras situações com AI.[Figure caption and citation for the preceding image starts]: Sinal de "halo" em aspergilose pulmonar inicialDo acervo do Dr. P. Chandrasekar; usado com permissão [Citation ends].
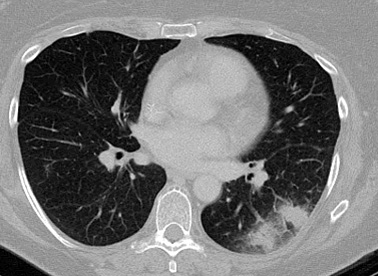 [Figure caption and citation for the preceding image starts]: Sinal do "crescente aéreo" em aspergilose pulmonar avançadaDo acervo do Dr. P. Chandrasekar; usado com permissão [Citation ends].
[Figure caption and citation for the preceding image starts]: Sinal do "crescente aéreo" em aspergilose pulmonar avançadaDo acervo do Dr. P. Chandrasekar; usado com permissão [Citation ends].
Aspergilose invasiva em outros locais (por exemplo, pele, cérebro, seios nasais)
A AI suspeita em outros locais como seios nasais e cérebro também pode ser avaliada com TC ou RNM. Radiografias dos seios nasais não são úteis. TC é a modalidade de imagem preferencial.[67][68] Com sinusite, além da opacidade/massa dentro da cavidade sinusal, a erosão óssea das paredes circundantes do seio é altamente sugestiva de uma infecção agressiva. Na doença cerebral, podem-se observar lesões com efeito de massa com edema circundante, abscessos e hemorragia.
APC
A radiografia torácica pode revelar uma ou mais cavidades pulmonares com ou sem aspergiloma, infiltrados, nódulos, espessamento pleural, lesão parenquimatosa e fibrose.[3][4][70] A radiografia é o método de imagem inicial, mas a TC pode fornecer melhor definição e localização dos achados.[3]
Aspergiloma
Lesões isoladas no lóbulo superior são os achados mais comuns na radiografia torácica. Lesões múltiplas raramente são observadas. Uma massa intracavitária móvel no lóbulo superior com crescente aéreo na periferia (sinal de Monod) é altamente sugestiva de aspergiloma. Radiografias simples geralmente são adequadas. Ocasionalmente, é necessária uma TC do tórax. Nas radiografias, uma alteração na posição da bola fúngica pode ser observada com uma alteração na posição do paciente.[71] Radiografias torácicas periódicas são adequadas para o acompanhamento de aspergiloma assintomático.
Sorologia/lavagem broncoalveolar (LBA)
Aspergilose invasiva
O diagnóstico de AI continua a apresentar um desafio devido ao quadro clínico inespecífico da AI, baixa sensibilidade da microscopia e cultura de amostras do trato respiratório inferior, e à dificuldade de obter tecido para histopatologia em pacientes em estado crítico. Consequentemente, biomarcadores como o beta-D-glicano sérico e o antígeno galactomanana (GM) de Aspergillus foram avaliados, principalmente em receptores de células-tronco e pacientes leucêmicos com neutropenia.[72][73][74]
Antígeno GM
O antígeno GM é um componente polissacarídeo da parede celular da espécie Aspergillus que é liberado na circulação sistêmica durante o crescimento fúngico no tecido.
Existe um método de ensaio de imunoadsorção enzimática (ELISA) duplo sanduíche para detecção de GM (índice de densidade óptica de 0.5 ou superior em 2 ocasiões é positivo).[75][76]
A combinação de um paciente de alto risco com achados clínicos e radiológicos sugestivos (TC) e um GM sérico positivo pode ser considerada adequada para um diagnóstico de AI "provável", evitando assim procedimentos invasivos como biópsia tecidual (de pulmão).[77][78]
A sensibilidade e especificidade do GM sérico em série é de 67% a 100% em pacientes com leucemia aguda e de 86% a 98% em receptores de células-tronco, respectivamente.[76][77]
O monitoramento sérico do GM detectou AI entre 6 e 14 dias antes dos achados radiográficos.[79]
São observados resultados falso-positivos com outros fungos, como espécies Histoplasma, Blastomyces, Geotrichum e Penicillium, e bactérias (por exemplo, Bifidobacterium).[72][80] O uso de antibióticos betalactâmicos como piperacilina/tazobactam e amoxicilina/ácido clavulânico pode mostrar resultados falso-positivos.[81] Na presença de medicamentos ativos contra bolores usados como profilaxia ou terapia, a sensibilidade do ensaio de GM é reduzida. A sensibilidade pode ser menor em pacientes não neutropênicos, possivelmente devido a uma menor carga fúngica.
O uso combinado do ensaio do antígeno GM sérico e TC do tórax melhora a detecção de AI pulmonar, permitindo um início mais rápido da terapia.[78] Os dados sugerem que as medições do antígeno GM no líquido de LBA são mais sensíveis do que o GM sérico e têm um melhor valor preditivo, e o teste do antígeno GM em LBA agora se tornou um método aceito para diagnóstico.[82][83] A medição do antígeno GM do líquido de LBA de índice de densidade óptica de 1.5 ou superior parece ser um forte preditor de AI em pacientes imunocomprometidos (especificidade >90%).[84]
(1,3)-beta-D-glicano sérico
O (1,3)-beta-D-glicano é um componente da parede celular de vários fungos (à exceção de Zygomycetes e Cryptococcus) e um método sorológico para diagnóstico de fungos invasivos.[73][74]
O teste é uma variação do ensaio Limulus usado para detectar endotoxinas. A presença de glicano sérico é inespecífica para Aspergillus e podem ocorrer resultados falso-positivos em virtude de tubos de coleta de sangue, gaze e filtros de membrana contaminados.
Uma revisão Cochrane encontrou grande variação na sensibilidade e especificidade de testes comercialmente disponíveis para (1,3)-beta-D-glicano sérico na detecção de infecções fúngicas invasivas selecionadas, incluindo aspergilose. A sensibilidade variou de 27% a 100% e a especificidade variou de 0% a 100%; portanto, a precisão do diagnóstico não pôde ser determinada.[85] [
 ]
]
Reação em cadeia da polimerase
O diagnóstico por reação em cadeia da polimerase, com base na amplificação de genes fúngicos específicos de Aspergillus (geralmente DNA ribossomal) no sangue e no líquido da LBA, tem se mostrado uma promessa considerável para o diagnóstico precoce. No líquido da LBA, dois resultados de teste de reação em cadeia da polimerase positivos têm um valor preditivo positivo mais alto para confirmar a AI.[66] [
 ]
O teste de reação em cadeia da polimerase em amostras histopatológicas também aumenta o rendimento diagnóstico.[66] Os resultados do teste com base na reação em cadeia da polimerase podem ser falsamente positivos por causa da presença ubíqua de conídios de Aspergillus. A combinação do teste por reação em cadeia da polimerase com outros métodos de diagnóstico não baseados em cultura e não invasivos (isto é, teste de GM sérico e ensaio de beta-D-glicano sérico) é uma área importante para o diagnóstico precoce da aspergilose invasiva.
]
O teste de reação em cadeia da polimerase em amostras histopatológicas também aumenta o rendimento diagnóstico.[66] Os resultados do teste com base na reação em cadeia da polimerase podem ser falsamente positivos por causa da presença ubíqua de conídios de Aspergillus. A combinação do teste por reação em cadeia da polimerase com outros métodos de diagnóstico não baseados em cultura e não invasivos (isto é, teste de GM sérico e ensaio de beta-D-glicano sérico) é uma área importante para o diagnóstico precoce da aspergilose invasiva.
APC
Em pacientes com exames de imagem e história sugestivos de APC, o diagnóstico pode ser confirmado com imunoglobulina G (IgG) sérica contra Aspergillus ou precipitinas, ou antígeno ou DNA de Aspergillus em fluidos respiratórios.[3]
Anticorpos contra Aspergillus
O teste de anticorpos IgG contra Aspergillus é o teste mais sensível para aspergilose pulmonar cavitária crônica (APCC).[2] Anticorpos IgG séricos contra Aspergillus ou precipitinas são positivos na maioria dos pacientes com APC.
Casos falso-negativos podem ser observados em pacientes submetidos a corticoterapia ou naqueles com aspergiloma decorrente de espécies diferentes do A fumigatus.[86]
Antígeno GM
Quando usado no diagnóstico de APC, deve-se utilizar o líquido de LBA (não soro). A especificidade e a sensibilidade são inferiores às dos testes de anticorpos contra Aspergillus.[3]
reação em cadeia da polimerase
Microbiologia
AI pulmonar
A tosse geralmente é improdutiva nesses pacientes. O escarro, quando disponível, em geral é negativo por coloração e cultura fúngica. Um achado positivo é altamente significativo em um paciente de alto risco (imunocomprometido).[11] Contudo, em um paciente de baixo risco (imunocompetente), Aspergillus no escarro pode apenas representar colonização que não requer intervenção adicional.[11][88]
Espécies Aspergillus crescem bem em meio padrão e podem ser identificadas a nível de espécie na maioria dos laboratórios. A cultura a partir de um local estéril é diagnóstico de AI. As hemoculturas geralmente são negativas mesmo em casos disseminados.
Os procedimentos de diagnóstico invasivos comumente usados são:
Broncoscopia com LBA e/ou biópsia
Aspiração transtorácica percutânea com agulha orientada por TC
Biópsia toracoscópica videoassistida.
A amostra obtida pode revelar hifas septadas angulares de ramificação dicotômica características e espécies Aspergillus em cultura. A confirmação por cultura é fundamental para distinguir o Aspergillus de outros fungos com características morfológicas semelhantes, como o Fusarium e o Scedosporium.[17] Resultados falso-negativos ocorrem com amostras obtidas de áreas não afetadas, com amostras inadequadas, e em pacientes já submetidos a terapia antifúngica. Por isso, a falta de cultura ou esfregaço fúngico positivos não descarta o diagnóstico de AI. Além disso, procedimentos invasivos podem não ser possíveis em pacientes em estado crítico ou naqueles com trombocitopenia.[Figure caption and citation for the preceding image starts]: Coloração de prata metenamina de Gomori (CGM) de tecido pulmonar mostrando hifas septadas de ramificação dicotômica de AspergillusDo acervo do Dr. P. Chandrasekar; usado com permissão [Citation ends].
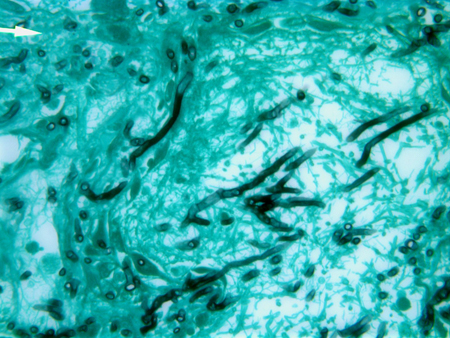
Aspergilose invasiva em outros locais (por exemplo, pele, cérebro, seios nasais)
As amostras teciduais apropriadas obtidas por biópsia devem ser submetidas a coloração (prata metenamina de Gomori) e cultura fúngica. A coloração de Gram para detectar bactérias não é apropriada para detecção fúngica. Os abrilhantadores ópticos que usam coloração branca são úteis para realçar elementos fúngicos.
APC
Microscopia direta ou cultura fúngica de amostras respiratórias podem identificar a presença de Aspergillus. No entanto, as taxas de positividade da cultura variam amplamente e os resultados devem ser interpretados com cautela.[3][89] Testar múltiplas amostras aumenta a probabilidade de uma cultura ou teste de microscopia positivos, mas a maioria dos pacientes apresenta culturas de escarro negativas.[2] Além disso, como os Aspergillus são onipresentes no ambiente, a sua presença no escarro não é necessariamente diagnóstica.[89]
Histopatologia
AI
A biópsia tecidual é o método de diagnóstico mais definitivo. Ela pode ser obtida por:
Aspiração transbrônquica com agulha guiada por TC (para lesões periféricas)
Biópsia por cirurgia toracoscópica videoassistida (CTVA)
Biópsia pulmonar a céu aberto.
A CTVA é o método preferencial, já que a biópsia é obtida por visualização direta e é menos invasiva comparada à biópsia pulmonar a céu aberto. A amostra obtida por uma abordagem transbrônquica ou guiada por TC geralmente é abaixo do ideal e pode estar associada a complicações como sangramento não controlado e pneumotórax. A trombocitopenia é comum na leucemia e em receptores de células-tronco, tornando os procedimentos invasivos arriscados. Em geral, não se pode realizar um procedimento de biópsia, em virtude de doença grave ou trombocitopenia refratária a transfusão plaquetária, fazendo com que os médicos optem pelo tratamento empírico.
Outros locais de biópsia podem incluir pele, tecido dos seios nasais, cérebro ou, raramente, ossos, coração, pericárdio ou órgãos abdominais.
As amostras obtidas por biópsia devem ser enviadas em soro fisiológico para cultura microbiológica e em formalina para patologia. Hifas estreitas, septadas, com ramificação em ângulo agudo, invasão do tecido e infiltrados inflamatórios circundantes com necrose são achados altamente sugestivos de AI.[17] Como o Aspergillus é angioinvasivo, o organismo frequentemente é encontrado na vasculatura, causando trombose, infarto do tecido e necrose coagulativa. Outros fungos como o Fusarium e o Scedosporium (Pseudoallescheria) podem ter características semelhantes, exigindo a confirmação por cultura do organismo.
APC
Em certos casos, o exame microscópico do tecido obtido por biópsia é necessário para o diagnóstico.
Na APCC, a biópsia pode mostrar células inflamatórias, fibrose, granulomas e hifas.[2] Se as hifas invadirem o parênquima pulmonar, será diagnosticada AI aguda ou subaguda.[3]
O exame do aspergiloma mostra micélios fúngicos, células inflamatórias, restos de tecido, fibrina e muco.[4]
Os nódulos de Aspergillus são diagnosticados após biópsia excisional, geralmente após suspeita de neoplasia maligna. Nódulos únicos completamente excisados podem não necessitar de tratamento adicional.[3][4]
[Figure caption and citation for the preceding image starts]: Algoritmo de diagnóstico para aspergilose invasiva suspeitaCriado pelos autores [Citation ends].
O uso deste conteúdo está sujeito ao nosso aviso legal