O tratamento é indicado quando os sintomas da menopausa interferem na qualidade de vida e nas atividades diárias de uma mulher. Os sintomas prevalentes devem ser esclarecidos, e as mudanças de estilo de vida e opções de terapia medicamentosa devem ser explicadas.
Deve-se administrar a terapia hormonal na dose mais baixa e pelo menor tempo possível, mantendo-se simultaneamente o benefício do alívio dos sintomas. Como não é possível prever a duração dos sintomas, não há uma duração máxima predeterminada para a terapia hormonal; todas as pacientes requerem uma decisão individualizada. A reavaliação deve ocorrer pelo menos uma vez ao ano.
Tratamento dos fogachos
Os fogachos podem ser tratados com abordagens farmacológicas (hormonais e não hormonais), não farmacológicas (estilo de vida e alternativas) ou uma combinação de ambas.
Mudanças de estilo de vida
Apesar das evidências limitadas, certas mudanças de estilo de vida podem melhorar a tolerância aos sintomas. As mulheres devem ser encorajadas a perder peso (se necessário) e a fazer mais exercícios.[11]Maas AHEM, Rosano G, Cifkova R, et al. Cardiovascular health after menopause transition, pregnancy disorders, and other gynaecologic conditions: a consensus document from European cardiologists, gynaecologists, and endocrinologists. Eur Heart J. 2021 Mar 7;42(10):967-84.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7947184
http://www.ncbi.nlm.nih.gov/pubmed/33495787?tool=bestpractice.com
Ambas as medidas têm benefícios cardiovasculares e de saúde óssea e podem melhorar o bem-estar geral, mas podem não ter nenhum impacto especificamente identificável nos fogachos nem melhorar a densidade óssea.[8]North American Menopause Society. Management of osteoporosis in postmenopausal women: the 2021 position statement of The North American Menopause Society. Menopause. 2021 Sep 1;28(9):973-97.
http://www.ncbi.nlm.nih.gov/pubmed/34448749?tool=bestpractice.com
Outras medidas de autocuidado incluem evitar alimentos apimentados, bebidas alcoólicas, cafeína, ambientes quentes e estresse. A ingestão de álcool e cafeína está associada ao agravamento dos sintomas vasomotores (SVM). Usar a técnica de sobreposição de roupas e ventiladores portáteis, beber água gelada e usar borrifadores de água pode ser útil. Uma revisão qualitativa de ensaios clínicos randomizados e controlados (ECRCs) e metanálises descobriram que a ioga é moderadamente efetiva em curto prazo para os sintomas psicológicos, mas não causa nenhum impacto sobre os sintomas somáticos, vasomotores ou urogenitais.[33]Cramer H, Lauche R, Langhorst J, et al. Effectiveness of yoga for menopausal symptoms: a systematic review and meta-analysis of randomized controlled trials. Evid Based Complement Alternat Med. 2012 Nov 7;2012:863905.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3524799
http://www.ncbi.nlm.nih.gov/pubmed/23304220?tool=bestpractice.com
Terapia combinada oral de estrogênio/progestina
A terapia hormonal para uma mulher com útero inclui um estrogênio e uma progestina para proteger contra hiperplasia endometrial e câncer.[17]The North American Menopause Society Advisory Panel. The 2022 hormone therapy position statement of The North American Menopause Society. Menopause. 2022 Jul 1;29(7):767-94.
http://www.ncbi.nlm.nih.gov/pubmed/35797481?tool=bestpractice.com
Estrogênios são o tratamento mais efetivo para os SVMs, reduzindo os fogachos em 80% a 90%.[34]American College of Obstetricians and Gynecologists. Practice bulletin no. 141: management of menopausal symptoms. Jan 2014 [internet publication].
https://www.acog.org/clinical/clinical-guidance/practice-bulletin/articles/2014/01/management-of-menopausal-symptoms
Esquemas combinados incluem:
O esquema combinado contínuo é indicado em mulheres que apresentam amenorreia há mais de 12 meses. É fácil de seguir e continua a amenorreia da menopausa. Se a mulher apresentar sangramento intermenstrual após os primeiros 6 meses de esquema combinado contínuo, será necessária uma avaliação endometrial (ultrassonografia pélvica com ou sem biópsia endometrial), devendo-se considerar a troca por um esquema sequencial para que ela possa ter um padrão de sangramento previsível.
Em um esquema sequencial, uma progestina é adicionada a um estrogênio nos últimos 10 a 14 dias do ciclo. A terapia hormonal (TH) sequencial pode ser preferível para mulheres na perimenopausa, mas pode também ser indicada para mulheres na pós-menopausa.[35]Hamoda H, Panay N, Peddar H, et al. The British Menopause Society & Women’s Health Concern 2020 recommendations on hormone replacement therapy in menopausal women. 2020 [internet publication].
https://thebms.org.uk/publications/consensus-statements/bms-whcs-2020-recommendations-on-hormone-replacement-therapy-in-menopausal-women
[36]Stuenkel CA, Davis SR, Gompel A, et al. Treatment of symptoms of the menopause: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2015 Nov;100(11):3975-4011.
https://academic.oup.com/jcem/article/100/11/3975/2836060
http://www.ncbi.nlm.nih.gov/pubmed/26444994?tool=bestpractice.com
Terapia hormonal apenas com estrogênio
As mulheres histerectomizadas podem usar estrogênio isolado se não apresentarem contraindicações para a terapia com estrogênio sistêmico.[17]The North American Menopause Society Advisory Panel. The 2022 hormone therapy position statement of The North American Menopause Society. Menopause. 2022 Jul 1;29(7):767-94.
http://www.ncbi.nlm.nih.gov/pubmed/35797481?tool=bestpractice.com
Administração de estrogênio transdérmico
Uma formulação de estrogênio transdérmico (geralmente estradiol) é preferível ao oral para mulheres que tiverem maior risco trombótico (inclusive índice de massa corporal >30), tomarem outros medicamentos, tiverem níveis limítrofes de triglicerídeos, risco de cálculo biliar ou dificuldade de aderir à tomada da pílula diária. Como não há nenhum efeito de primeira passagem, uma formulação de estrogênio transdérmico pode reduzir o risco de tromboembolismo, em comparação com o estrogênio oral, mas isso não foi estudado em um ECRC.[22]Vinogradova Y, Coupland C, Hippisley-Cox J. Use of hormone replacement therapy and risk of venous thromboembolism: nested case-control studies using the QResearch and CPRD databases. BMJ. 2019 Jan 9;364:k4810.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6326068
http://www.ncbi.nlm.nih.gov/pubmed/30626577?tool=bestpractice.com
[23]Cobin RH, Goodman NF; AACE Reproductive Endocrinology Scientific Committee. American Association of Clinical Endocrinologists and American College of Endocrinology position statement on menopause - 2017 update. Endocr Pract. 2017 Jul;23(7):869-80.
http://journals.aace.com/doi/full/10.4158/EP171828.PS
http://www.ncbi.nlm.nih.gov/pubmed/28703650?tool=bestpractice.com
Ele também pode apresentar uma menor incidência de náuseas. É provável que as complicações em longo prazo da formulação de estrogênio transdérmico sejam as mesmas do estrogênio oral, embora não tenham sido estudadas especificamente na Women's Health Initiative. De acordo com as recomendações do National Institute for Health and Care Excellence do Reino Unido, a formulação de estrogênio transdérmico em doses terapêuticas padrão não aumenta o risco de tromboembolismo venoso em comparação com o risco inicial da população, nem é provável aumentar o risco de AVC.[1]National Institute for Health and Care Excellence. Menopause: diagnosis and management. Dec 2019 [internet publication].
https://www.nice.org.uk/guidance/ng23
O estradiol transdérmico está disponível como adesivo, spray dosimetrado ou preparações de gel, todos aplicados sobre a pele. Um ECRC multicêntrico de 12 semanas demonstrou que, em comparação com o placebo, o gel de estradiol transdérmico reduziu significativamente a frequência e a gravidade dos fogachos na 4ª e 12ª semanas em mulheres na menopausa saudáveis com fogachos moderados a intensos.[37]Archer DF, Pickar JH, MacAllister DC, et al. Transdermal estradiol gel for the treatment of symptomatic postmenopausal women. Menopause. 2012 Jun;19(6):622-9.
http://www.ncbi.nlm.nih.gov/pubmed/22282101?tool=bestpractice.com
Cefaleia, infecção, mastalgia, náuseas e insônia foram os efeitos colaterais relatados com mais frequência. Uma metanálise em rede não constatou nenhuma diferença na eficácia entre o adesivo de estradiol transdérmico e o spray de estradiol transdérmico para sintomas vasomotores.[38]Kovács G, Zelei T, Vokó Z. Comparison of efficacy and local tolerability of estradiol metered-dose transdermal spray to estradiol patch in a network meta-analysis. Climacteric. 2016 Oct;19(5):488-95.
http://www.ncbi.nlm.nih.gov/pubmed/27593417?tool=bestpractice.com
Mulheres com útero intacto precisam de proteção com uma progestina. Na maioria dos países, existe uma combinação de estrogênio e progestina em um único adesivo transdérmico . Preparações transdérmicas combinadas e sequenciais pata TH geralmente também estão disponíveis.
Interrupção da terapia estrogênica
Há evidências insuficientes para recomendar um método de suspensão da terapia com estrogênio em vez de outro. Não há nenhuma idade padrão para a descontinuação da TH. Cada indivíduo deve ser avaliado regularmente (por exemplo, anualmente) para determinar a extensão dos benefícios da TH. Para mulheres que obtêm benefícios mínimos com a TH, pode-se discutir adequadamente a cessação do tratamento em qualquer idade.
Estrogênios conjugados com bazedoxifeno
O uso de estrogênios conjugados/bazedoxifeno (um modulador seletivo do receptor estrogênico) foi aprovado em alguns países para o tratamento dos SVMs e prevenção da osteoporose em mulheres com útero intacto.[8]North American Menopause Society. Management of osteoporosis in postmenopausal women: the 2021 position statement of The North American Menopause Society. Menopause. 2021 Sep 1;28(9):973-97.
http://www.ncbi.nlm.nih.gov/pubmed/34448749?tool=bestpractice.com
[39]Tella SH, Gallagher JC. Bazedoxifene + conjugated estrogens in HT for the prevention of osteoporosis and treatment of vasomotor symptoms associated with the menopause. Expert Opin Pharmacother. 2013 Dec;14(17):2407-20.
http://www.ncbi.nlm.nih.gov/pubmed/24093499?tool=bestpractice.com
Em comparação com estrogênios conjugados/medroxiprogesterona, mulheres tratadas com estrogênios conjugados/bazedoxifeno apresentaram bem menos eventos adversos. Mulheres que tomam estrogênios conjugados/bazedoxifeno não devem tomar progestina.
O bazedoxifeno tem efeito favorável (antiestrogênico) no tecido mamário.[40]Valera MC, Gourdy P, Trémollières F, et al. From the Women's Health Initiative to the combination of estrogen and selective estrogen receptor modulators to avoid progestin addition. Maturitas. 2015 Nov;82(3):274-7.
http://www.ncbi.nlm.nih.gov/pubmed/26261036?tool=bestpractice.com
São necessárias pesquisas adicionais.
Terapia de modulação hormonal bioidêntica
Preparações para terapia de modulação hormonal bioidêntica (TMHB) consistem simplesmente em estrogênio (com ou sem progestina) em forma manipulada personalizada. A terapia de modulação hormonal bioidêntica (TMHB) manipulada não regulamentada tem se apresentado como "natural" e mais segura que a TH convencional, mas essas alegações não são comprovadas.
Uma revisão sistemática concluiu que a TMHB é mais eficaz que o placebo no tratamento dos fogachos da menopausa moderados a intensos (evidências de qualidade baixa a moderada), mas com maior incidência de efeitos adversos.[41]Gaudard AM, Silva de Souza S, Puga ME, et al. Bioidentical hormones for women with vasomotor symptoms. Cochrane Database Syst Rev. 2016 Aug 1;(8):CD010407.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD010407.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/27479272?tool=bestpractice.com
Não há nenhum dado de segurança de longo prazo relativo a desfechos tais como infarto do miocárdio, AVC e câncer de mama.[41]Gaudard AM, Silva de Souza S, Puga ME, et al. Bioidentical hormones for women with vasomotor symptoms. Cochrane Database Syst Rev. 2016 Aug 1;(8):CD010407.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD010407.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/27479272?tool=bestpractice.com
Órgãos consultivos, tais como a North American Menopause Society, o American College of Obstetricians and Gynecologists, a US National Academies of Sciences e a British Menopause Society, geralmente não recomendam a terapia de estrogênio/progestina manipulada devido à falta de pureza e potência padronizadas com os riscos inerentes de dosagem excessiva ou deficiente.[17]The North American Menopause Society Advisory Panel. The 2022 hormone therapy position statement of The North American Menopause Society. Menopause. 2022 Jul 1;29(7):767-94.
http://www.ncbi.nlm.nih.gov/pubmed/35797481?tool=bestpractice.com
[35]Hamoda H, Panay N, Peddar H, et al. The British Menopause Society & Women’s Health Concern 2020 recommendations on hormone replacement therapy in menopausal women. 2020 [internet publication].
https://thebms.org.uk/publications/consensus-statements/bms-whcs-2020-recommendations-on-hormone-replacement-therapy-in-menopausal-women
[42]American College of Obstetricians and Gynecologists. ACOG clinical consensus no. 6: compounded bioidentical menopausal hormone therapy. Nov 2023 [internet publication].
https://www.acog.org/clinical/clinical-guidance/clinical-consensus/articles/2023/11/compounded-bioidentical-menopausal-hormone-therapy
[43]Stuenkel CA, Manson JE. Compounded bioidentical hormone therapy: the national academies weigh in. JAMA Intern Med. 2021 Mar 1;181(3):370-71.
http://www.ncbi.nlm.nih.gov/pubmed/33315055?tool=bestpractice.com
Da mesma forma, a American Association of Clinical Endocrinologists (AACE) e o American College of Endocrinology (ACE) não recomendam a TMHB devido à falta de benefícios comprovados e ao potencial de controle de qualidade inadequado.[23]Cobin RH, Goodman NF; AACE Reproductive Endocrinology Scientific Committee. American Association of Clinical Endocrinologists and American College of Endocrinology position statement on menopause - 2017 update. Endocr Pract. 2017 Jul;23(7):869-80.
http://journals.aace.com/doi/full/10.4158/EP171828.PS
http://www.ncbi.nlm.nih.gov/pubmed/28703650?tool=bestpractice.com
Para a maioria das mulheres, a TH licenciada (regulada) é uma terapia apropriada sem os riscos das preparações personalizadas.
Preparações reguladas que contenham estradiol e progesterona micronizada (um estrogênio semelhante e um progestogênio equivalente aos produzido pelos ovários) devem ser usadas, em detrimento de preparações manipuladas, por mulheres que cogitem o uso de preparações mais naturais. A declaração de posição da AACE/ACE de 2017 recomenda que, quando necessário o uso de progesterona, a progesterona micronizada é considerada a alternativa mais segura à progestina sintética.[23]Cobin RH, Goodman NF; AACE Reproductive Endocrinology Scientific Committee. American Association of Clinical Endocrinologists and American College of Endocrinology position statement on menopause - 2017 update. Endocr Pract. 2017 Jul;23(7):869-80.
http://journals.aace.com/doi/full/10.4158/EP171828.PS
http://www.ncbi.nlm.nih.gov/pubmed/28703650?tool=bestpractice.com
A progesterona micronizada pode ser administrada por via oral ou vaginal, mas a progesterona micronizada transdérmica não protege o endométrio.[44]Stute P, Neulen J, Wildt L. The impact of micronized progesterone on the endometrium: a systematic review. Climacteric. 2016 Aug;19(4):316-28.
https://www.tandfonline.com/doi/full/10.1080/13697137.2016.1187123
http://www.ncbi.nlm.nih.gov/pubmed/27277331?tool=bestpractice.com
Embora o creme de progesterona bioidêntica seja de venda livre, apenas um dos três ECRCs publicados demonstrou alguma eficácia em comparação com o placebo para redução dos sintomas vasomotores.[45]Whelan AM, Jurgens TM, Trinacty M. Bioidentical progesterone cream for menopause-related vasomotor symptoms: is it effective? Ann Pharmacother. 2013 Jan;47(1):112-6.
http://www.ncbi.nlm.nih.gov/pubmed/23249728?tool=bestpractice.com
Riscos da terapia hormonal
É importante fornecer informações sobre os benefícios e riscos da TH, para ajudar as mulheres a fazerem uma escolha consciente sobre qual tratamento, se houver, deve ser usado para os sintomas da menopausa.
Os riscos associados ao uso da TH variam entre mulheres, de acordo com a dose, duração, via de administração, idade no início da terapia e inclusão de um progestogênio no esquema. A relação risco/benefício da TH parece favorável para o manejo dos sintomas vasomotores e prevenção da perda óssea ou fraturas entre mulheres (sem contraindicações) abaixo dos 60 anos de idade ou em até 10 anos depois do início da menopausa.[8]North American Menopause Society. Management of osteoporosis in postmenopausal women: the 2021 position statement of The North American Menopause Society. Menopause. 2021 Sep 1;28(9):973-97.
http://www.ncbi.nlm.nih.gov/pubmed/34448749?tool=bestpractice.com
[17]The North American Menopause Society Advisory Panel. The 2022 hormone therapy position statement of The North American Menopause Society. Menopause. 2022 Jul 1;29(7):767-94.
http://www.ncbi.nlm.nih.gov/pubmed/35797481?tool=bestpractice.com
Durante 18 anos de acompanhamento, a mortalidade por todas as causas entre a coorte de mulheres menopausadas que receberam 5 a 7 anos de TH em dois ensaios da Women's Health Initiative não diferiu entre os grupos da TH e do placebo (27.1% versus 27.6%, respectivamente; razão de riscos [HR] 0.99, intervalo de confiança de 95% [IC] 0.94 a 1.03]).[46]Manson JE, Aragaki AK, Rossouw JE, et al. Menopausal hormone therapy and long-term all-cause and cause-specific mortality: the women's health initiative randomized trials. JAMA. 2017 Sep 12;318(10):927-38.
http://www.ncbi.nlm.nih.gov/pubmed/28898378?tool=bestpractice.com
Nem o estrogênio isolado (HR 0.94, IC de 95% 0.88 a 1.01) nem o estrogênio associado à progestina (HR 1.02, IC de 95% 0.96 a 1.08) foram associados a maior risco de mortalidade por todas as causas.[46]Manson JE, Aragaki AK, Rossouw JE, et al. Menopausal hormone therapy and long-term all-cause and cause-specific mortality: the women's health initiative randomized trials. JAMA. 2017 Sep 12;318(10):927-38.
http://www.ncbi.nlm.nih.gov/pubmed/28898378?tool=bestpractice.com
Cardiopatia, AVC e tromboembolismo venoso
A TH não é atualmente recomendada para a prevenção primária de doenças cardiovasculares.[17]The North American Menopause Society Advisory Panel. The 2022 hormone therapy position statement of The North American Menopause Society. Menopause. 2022 Jul 1;29(7):767-94.
http://www.ncbi.nlm.nih.gov/pubmed/35797481?tool=bestpractice.com
[18]Marjoribanks J, Farquhar C, Roberts H, et al. Long-term hormone therapy for perimenopausal and postmenopausal women. Cochrane Database Syst Rev. 2017 Jan 17;(1):CD004143.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD004143.pub5/full
http://www.ncbi.nlm.nih.gov/pubmed/28093732?tool=bestpractice.com
[19]American College of Obstetricians and Gynecologists. ACOG committee opinion no. 565: hormone therapy and heart disease. Jun 2013 [internet publication].
https://www.acog.org/clinical/clinical-guidance/committee-opinion/articles/2013/06/hormone-therapy-and-heart-disease
http://www.ncbi.nlm.nih.gov/pubmed/23812486?tool=bestpractice.com
[20]Kremer C, Gdovinova Z, Bejot Y, et al. European Stroke Organisation guidelines on stroke in women: Management of menopause, pregnancy and postpartum. Eur Stroke J. 2022 Jun;7(2):I-XIX.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9134774
http://www.ncbi.nlm.nih.gov/pubmed/35647308?tool=bestpractice.com
São necessárias mais pesquisas para avaliar o impacto do momento de início da TH sobre a mortalidade e o risco de doença coronariana.
[Figure caption and citation for the preceding image starts]: Taxas absolutas de doença coronariana para diferentes tipos de terapia hormonal (TH), em comparação com a ausência de TH (ou placebo), diferentes tempos de uso da TH e tempo desde a interrupção da TH para mulheres menopausadas.National Institute for Health and Care Excellence. Menopause: diagnosis and management. Dec 2019 [Citation ends].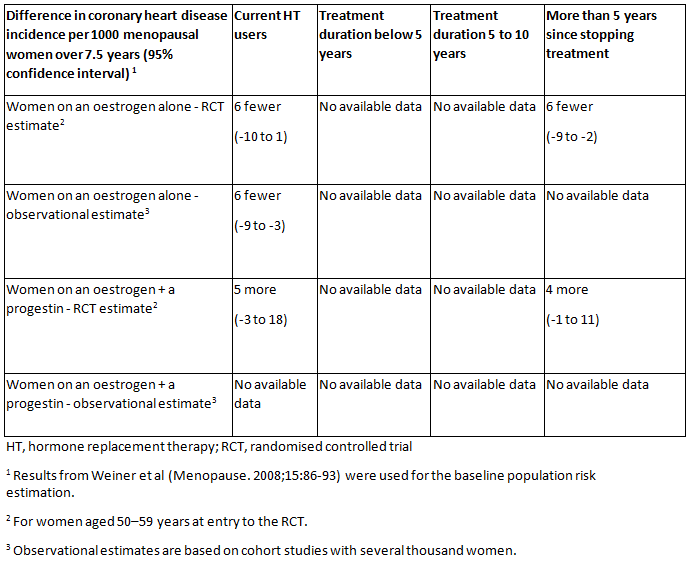
O risco de tromboembolismo venoso e AVC isquêmico aumenta na TH oral, mas o risco absoluto de AVC em mulheres abaixo dos 60 anos de idade é muito baixo.[1]National Institute for Health and Care Excellence. Menopause: diagnosis and management. Dec 2019 [internet publication].
https://www.nice.org.uk/guidance/ng23
[47]de Villiers TJ, Gass ML, Haines CJ, et al. Global consensus statement on menopausal hormone therapy. Climacteric. 2013 Apr;16(2):203-4.
http://www.tandfonline.com/doi/full/10.3109/13697137.2013.771520
http://www.ncbi.nlm.nih.gov/pubmed/23488524?tool=bestpractice.com
[48]de Villiers TJ, Hall JE, Pinkerton JV, et al. Revised global consensus statement on menopausal hormone therapy. Climacteric. 2016 Aug;19(4):313-5.
http://www.ncbi.nlm.nih.gov/pubmed/27322027?tool=bestpractice.com
Estudos observacionais e uma metanálise indicam que os estrogênios transdérmicos estão associados a menor risco de tromboembolismo venoso e AVC que os estrogênios orais.[1]National Institute for Health and Care Excellence. Menopause: diagnosis and management. Dec 2019 [internet publication].
https://www.nice.org.uk/guidance/ng23
[17]The North American Menopause Society Advisory Panel. The 2022 hormone therapy position statement of The North American Menopause Society. Menopause. 2022 Jul 1;29(7):767-94.
http://www.ncbi.nlm.nih.gov/pubmed/35797481?tool=bestpractice.com
[47]de Villiers TJ, Gass ML, Haines CJ, et al. Global consensus statement on menopausal hormone therapy. Climacteric. 2013 Apr;16(2):203-4.
http://www.tandfonline.com/doi/full/10.3109/13697137.2013.771520
http://www.ncbi.nlm.nih.gov/pubmed/23488524?tool=bestpractice.com
[48]de Villiers TJ, Hall JE, Pinkerton JV, et al. Revised global consensus statement on menopausal hormone therapy. Climacteric. 2016 Aug;19(4):313-5.
http://www.ncbi.nlm.nih.gov/pubmed/27322027?tool=bestpractice.com
Pacientes com alto risco de complicações cardiovasculares devem ser submetidas a uma avaliação rigorosa dos riscos e benefícios da TH e podem ser candidatas a um ensaio clínico ou à terapia não hormonal.[11]Maas AHEM, Rosano G, Cifkova R, et al. Cardiovascular health after menopause transition, pregnancy disorders, and other gynaecologic conditions: a consensus document from European cardiologists, gynaecologists, and endocrinologists. Eur Heart J. 2021 Mar 7;42(10):967-84.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7947184
http://www.ncbi.nlm.nih.gov/pubmed/33495787?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: Taxas absolutas de AVC para diferentes tipos de terapia hormonal (TH), em comparação com a ausência de TH (ou placebo), diferentes tempos de uso da TH e tempo desde a interrupção da TH para mulheres menopausadas.National Institute for Health and Care Excellence. Menopause: diagnosis and management. Dec 2019 [Citation ends].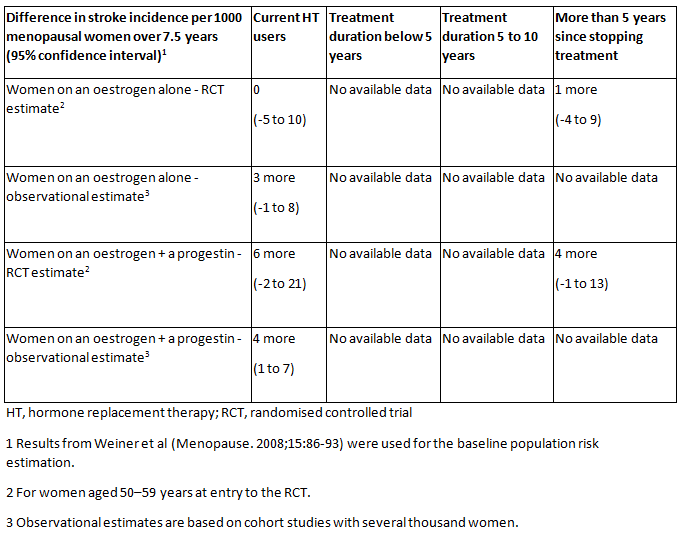
Câncer de mama e de ovário
A TH apenas com estrogênio está associada a pouca ou nenhuma alteração no risco de câncer de mama.[1]National Institute for Health and Care Excellence. Menopause: diagnosis and management. Dec 2019 [internet publication].
https://www.nice.org.uk/guidance/ng23
A prescrição de um estrogênio em combinação com uma progestina está associada a um pequeno aumento no risco de câncer de mama.[1]National Institute for Health and Care Excellence. Menopause: diagnosis and management. Dec 2019 [internet publication].
https://www.nice.org.uk/guidance/ng23
[47]de Villiers TJ, Gass ML, Haines CJ, et al. Global consensus statement on menopausal hormone therapy. Climacteric. 2013 Apr;16(2):203-4.
http://www.tandfonline.com/doi/full/10.3109/13697137.2013.771520
http://www.ncbi.nlm.nih.gov/pubmed/23488524?tool=bestpractice.com
[48]de Villiers TJ, Hall JE, Pinkerton JV, et al. Revised global consensus statement on menopausal hormone therapy. Climacteric. 2016 Aug;19(4):313-5.
http://www.ncbi.nlm.nih.gov/pubmed/27322027?tool=bestpractice.com
[Evidência C]f5f80ae3-be5c-4ddf-8bff-5c164c58e0a4guidelineCQuais são os efeitos da terapia de reposição hormonal (TRH) administrada para sintomas da menopausa sobre o risco de desenvolvimento de câncer de mama?[1]National Institute for Health and Care Excellence. Menopause: diagnosis and management. Dec 2019 [internet publication].
https://www.nice.org.uk/guidance/ng23
O aumento do risco está relacionado com a duração do tratamento e, provavelmente, regride após a interrupção do tratamento.[1]National Institute for Health and Care Excellence. Menopause: diagnosis and management. Dec 2019 [internet publication].
https://www.nice.org.uk/guidance/ng23
[47]de Villiers TJ, Gass ML, Haines CJ, et al. Global consensus statement on menopausal hormone therapy. Climacteric. 2013 Apr;16(2):203-4.
http://www.tandfonline.com/doi/full/10.3109/13697137.2013.771520
http://www.ncbi.nlm.nih.gov/pubmed/23488524?tool=bestpractice.com
[48]de Villiers TJ, Hall JE, Pinkerton JV, et al. Revised global consensus statement on menopausal hormone therapy. Climacteric. 2016 Aug;19(4):313-5.
http://www.ncbi.nlm.nih.gov/pubmed/27322027?tool=bestpractice.com
A Medicines and Healthcare Products Regulatory Agency do Reino Unido publicou uma tabela sobre o risco de câncer de mama para mulheres que recebem atualmente terapia hormonal e após o tratamento, da idade da menopausa até os 69 anos de idade.[49]Medicines and Healthcare products Regulatory Agency. Drug safety update. Hormone replacement therapy (HRT): further information on the known increased risk of breast cancer with HRT and its persistence after stopping. Aug 2019 [internet publication].
https://www.gov.uk/drug-safety-update/hormone-replacement-therapy-hrt-further-information-on-the-known-increased-risk-of-breast-cancer-with-hrt-and-its-persistence-after-stopping
[Figure caption and citation for the preceding image starts]: Resumo dos riscos e benefícios* da TRH durante o uso no presente e o uso no presente associado a pós-tratamento desde a idade da menopausa até os 69 anos de idade, por 1000 mulheres com 5 ou 10 anos de uso de TRH. Legenda: *O alívio dos sintomas da menopausa não está incluído nesta tabela, mas é um benefício importante da TRH e desempenhará um papel importante na decisão de prescrever a TRH. †Melhores estimativas baseadas nos riscos relativos do uso de TRH a partir dos 50 anos. Para o câncer de mama, isto inclui casos diagnosticados durante a utilização da TRH no presente diagnosticados após a utilização da TRH até aos 69 anos de idade; para os outros riscos, isto pressupõe não haver efeitos residuais após a interrupção do uso da TRH. § As evidências mais recentes sugerem que os produtos transdérmicos para TRH apresentam um risco menor de tromboembolismo venoso do que as preparações oraisMedicines and Healthcare Products Regulatory Agency. Terapia de reposição hormonal (TRH): informações adicionais sobre o aumento do risco de câncer de mama conhecido com TRH e sua persistência após a interrupção. Ago 2019 [publicação na internet]; usado com permissão [Citation ends].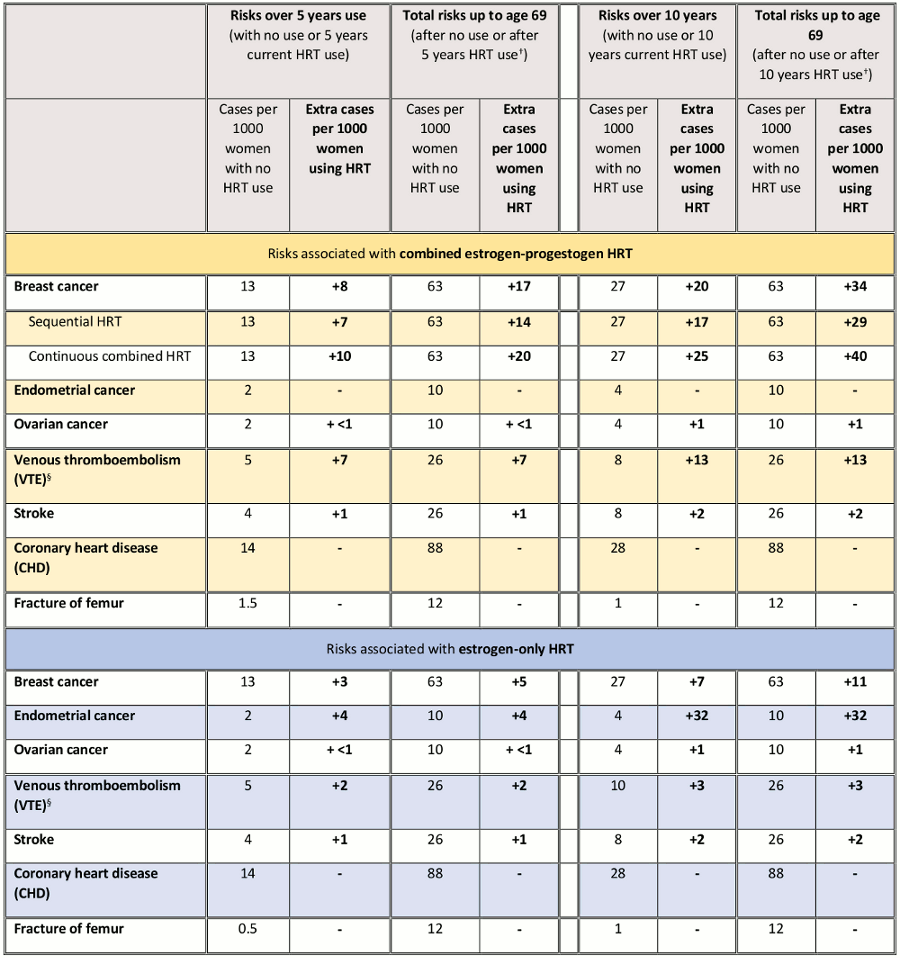
Há evidências que sugerem que a TH aumenta a densidade do tecido mamário.[1]National Institute for Health and Care Excellence. Menopause: diagnosis and management. Dec 2019 [internet publication].
https://www.nice.org.uk/guidance/ng23
Ela pode dificultar a detecção do tumor e fazer com que algumas mulheres sejam solicitadas a repetirem a mamografia e/ou a fazerem uma nova avaliação.
Uma metanálise de 52 estudos epidemiológicos analisou os riscos de câncer de ovário em 12,110 mulheres pós-menopausa, 55% das quais tinham usado TH por algum período.[50]Beral V, Gaitskell K, Hermon C, et al.; Collaborative Group On Epidemiological Studies Of Ovarian Cancer. Menopausal hormone use and ovarian cancer risk: individual participant meta-analysis of 52 epidemiological studies. Lancet. 2015 May 9;385(9980):1835-42.
http://www.ncbi.nlm.nih.gov/pubmed/25684585?tool=bestpractice.com
A metanálise sugeriu que 5 anos de uso de TH, começando na idade de 50 anos, resultaria em um câncer de ovário a mais por 1000 usuários.[50]Beral V, Gaitskell K, Hermon C, et al.; Collaborative Group On Epidemiological Studies Of Ovarian Cancer. Menopausal hormone use and ovarian cancer risk: individual participant meta-analysis of 52 epidemiological studies. Lancet. 2015 May 9;385(9980):1835-42.
http://www.ncbi.nlm.nih.gov/pubmed/25684585?tool=bestpractice.com
Uma metanálise de 2019 de estudos prospectivos constatou que o uso da TH por mais de 1 ano em mulheres menopausadas está associado ao aumento do risco de câncer de mama.[51]Collaborative Group on Hormonal Factors in Breast Cancer. Type and timing of menopausal hormone therapy and breast cancer risk: individual participant meta-analysis of the worldwide epidemiological evidence. Lancet. 2019 Aug 29;394(10204):1159-68.
www.doi.org/10.1016/S0140-6736(19)31709-X
http://www.ncbi.nlm.nih.gov/pubmed/31474332?tool=bestpractice.com
O risco aumentou com o uso prolongado da TH e persistiu após interromper a TH. O risco era maior com estrogênio e progestogênio combinados, comparados a estrogênio isolado, mas não houve aumento do risco com estrogênios vaginais tópicos. A orientação atual não mudou: a TH deve ser usada pelo menor período possível, e as pacientes devem estar atentas aos sinais de câncer de mama e devem realizar regularmente um rastreamento de câncer de mama.[49]Medicines and Healthcare products Regulatory Agency. Drug safety update. Hormone replacement therapy (HRT): further information on the known increased risk of breast cancer with HRT and its persistence after stopping. Aug 2019 [internet publication].
https://www.gov.uk/drug-safety-update/hormone-replacement-therapy-hrt-further-information-on-the-known-increased-risk-of-breast-cancer-with-hrt-and-its-persistence-after-stopping
[52]European Medicines Agency. Committee for Medicinal Products for Human Use (CHMP). Guideline on clinical investigation of medicinal products for hormone replacement therapy of oestrogen deficiency symptoms in postmenopausal women. Oct 2005 [internet publication].
https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-clinical-investigation-medicinal-products-hormone-replacement-therapy-oestrogen-deficiency_en.pdf
Os riscos e benefícios da TH devem ser discutidos com as pacientes durante uma tomada de decisão compartilhada antes de iniciar a TH.[1]National Institute for Health and Care Excellence. Menopause: diagnosis and management. Dec 2019 [internet publication].
https://www.nice.org.uk/guidance/ng23
[53]British Menopause Society. BMS response to Lancet paper on the link between different forms of HRT and breast cancer incidence. Aug 2019 [internet publication].
https://thebms.org.uk/2019/08/bms-response-to-lancet-paper-on-the-link-between-different-forms-of-hrt-and-breast-cancer-incidence
Medicamentos não hormonais para sintomas vasomotores
Uma revisão sistemática e metanálise de 43 ensaios de terapias não hormonais descobriu que a reposição de estrogênio era significativamente mais eficaz do que as alternativas não hormonais.[54]Nelson HD, Vesco KK, Haney E, et al. Nonhormonal therapies for menopausal hot flashes: systematic review and meta-analysis. JAMA. 2006 May 3;295(17):2057-71.
http://www.ncbi.nlm.nih.gov/pubmed/16670414?tool=bestpractice.com
No entanto, alternativas não hormonais podem beneficiar as mulheres que não podem tomar estrogênio devido a fatores de risco ou intolerância à TH.[55]The North American Menopause Society Advisory Panel. The 2023 nonhormone therapy position statement of The North American Menopause Society. Menopause. 2023 Jun 1;30(6):573-90.
http://www.ncbi.nlm.nih.gov/pubmed/37252752?tool=bestpractice.com
Inibidores seletivos de recaptação de serotonina (ISRSs) ou inibidores da recaptação de serotonina-noradrenalina (IRSNs)
ISRSs e IRSNs são efetivos para tratamento de SVMs em mulheres que não podem fazer uso da TH.[56]Freeman EW, Guthrie KA, Caan B, et al. Efficacy of escitalopram for hot flashes in healthy menopausal women: a randomized controlled trial. JAMA. 2011 Jan 19;305(3):267-74.
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3129746
http://www.ncbi.nlm.nih.gov/pubmed/21245182?tool=bestpractice.com
[57]American Academy of Family Physicians. ACOG releases clinical guidelines on management of menopausal symptoms. Am Fam Physician. 2014 Sep 1;90(5):338-40.
https://www.aafp.org/afp/2014/0901/p338.pdf
[58]Shams T, Firwana B, Habib F, et al. SSRIs for hot flashes: a systematic review and meta-analysis of randomized trials. J Gen Intern Med. 2014 Jan;29(1):204-13.
http://www.ncbi.nlm.nih.gov/pubmed/23888328?tool=bestpractice.com
Algumas evidências sugerem que o escitalopram pode ser mais eficaz que outros ISRSs para reduzir os fogachos.[58]Shams T, Firwana B, Habib F, et al. SSRIs for hot flashes: a systematic review and meta-analysis of randomized trials. J Gen Intern Med. 2014 Jan;29(1):204-13.
http://www.ncbi.nlm.nih.gov/pubmed/23888328?tool=bestpractice.com
Só a paroxetina é aprovada para o tratamento de SVMs moderados a graves associados à menopausa.[34]American College of Obstetricians and Gynecologists. Practice bulletin no. 141: management of menopausal symptoms. Jan 2014 [internet publication].
https://www.acog.org/clinical/clinical-guidance/practice-bulletin/articles/2014/01/management-of-menopausal-symptoms
[59]Orleans RJ, Li L, Kim MJ, et al. FDA approval of paroxetine for menopausal hot flushes. N Engl J Med. 2014 May 8;370(19):1777-9.
http://www.nejm.org/doi/full/10.1056/NEJMp1402080
http://www.ncbi.nlm.nih.gov/pubmed/24806158?tool=bestpractice.com
Em um ECRC, com duração de 8 semanas, realizado com 339 mulheres na perimenopausa e pós-menopausa, com SVMs incômodos, a venlafaxina (um IRSN) diminuiu a frequência dos sintomas em 1.8 a mais por dia, em comparação com o placebo (P=0.005).[60]Joffe H, Guthrie KA, LaCroix AZ, et al. Low-dose estradiol and the serotonin-norepinephrine reuptake inhibitor venlafaxine for vasomotor symptoms: a randomized clinical trial. JAMA Intern Med. 2014 Jul;174(7):1058-66.
http://archinte.jamanetwork.com/article.aspx?articleid=1876676
http://www.ncbi.nlm.nih.gov/pubmed/24861828?tool=bestpractice.com
O estradiol administrado em baixas doses foi, aparentemente, mais eficaz (2.3 menos SVMs por dia em comparação com o placebo), mas não foi comparado diretamente com a venlafaxina neste estudo.[60]Joffe H, Guthrie KA, LaCroix AZ, et al. Low-dose estradiol and the serotonin-norepinephrine reuptake inhibitor venlafaxine for vasomotor symptoms: a randomized clinical trial. JAMA Intern Med. 2014 Jul;174(7):1058-66.
http://archinte.jamanetwork.com/article.aspx?articleid=1876676
http://www.ncbi.nlm.nih.gov/pubmed/24861828?tool=bestpractice.com
A venlafaxina pode ser uma alternativa razoável para mulheres que não podem tomar estrogênio.
Em comparação com o placebo, a desvenlafaxina (um IRSN) reduziu a frequência e a intensidade de fogachos moderados a intensos, num período de 12 meses, em um ECRC que contou com a participação de 365 mulheres menopausadas com SVMs incômodos.[61]Pinkerton JV, Archer DF, Guico-Pabia CJ, et al. Maintenance of the efficacy of desvenlafaxine in menopausal vasomotor symptoms: a 1-year randomized controlled trial. Menopause. 2013 Jan;20(1):38-46.
http://www.ncbi.nlm.nih.gov/pubmed/23266839?tool=bestpractice.com
Após preocupações quanto à segurança da desvenlafaxina nesta população de pacientes, uma análise de segurança distinta não constatou nenhuma evidência de aumento no risco de eventos cardiovasculares, vasculares cerebrais ou hepáticos associados à desvenlafaxina (em comparação com o placebo) para o tratamento de SVMs ligados à menopausa.[62]Archer DF, Pinkerton JV, Guico-Pabia CJ, et al. Cardiovascular, cerebrovascular, and hepatic safety of desvenlafaxine for 1 year in women with vasomotor symptoms associated with menopause. Menopause. 2013 Jan;20(1):47-56.
http://www.ncbi.nlm.nih.gov/pubmed/23266840?tool=bestpractice.com
Gabapentina
Estudos indicam que a gabapentina é moderadamente eficaz para o tratamento dos fogachos.[36]Stuenkel CA, Davis SR, Gompel A, et al. Treatment of symptoms of the menopause: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2015 Nov;100(11):3975-4011.
https://academic.oup.com/jcem/article/100/11/3975/2836060
http://www.ncbi.nlm.nih.gov/pubmed/26444994?tool=bestpractice.com
[63]Hayes LP, Carroll DG, Kelley KW. Use of gabapentin for the management of natural or surgical menopausal hot flashes. Ann Pharmacother. 2011 Mar;45(3):388-94.
http://www.ncbi.nlm.nih.gov/pubmed/21343402?tool=bestpractice.com
No entanto, torpor, tontura e instabilidade são efeitos adversos comuns.[63]Hayes LP, Carroll DG, Kelley KW. Use of gabapentin for the management of natural or surgical menopausal hot flashes. Ann Pharmacother. 2011 Mar;45(3):388-94.
http://www.ncbi.nlm.nih.gov/pubmed/21343402?tool=bestpractice.com
A gabapentina pode causar letargia intolerável quando usada durante o dia.[36]Stuenkel CA, Davis SR, Gompel A, et al. Treatment of symptoms of the menopause: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2015 Nov;100(11):3975-4011.
https://academic.oup.com/jcem/article/100/11/3975/2836060
http://www.ncbi.nlm.nih.gov/pubmed/26444994?tool=bestpractice.com
Os efeitos colaterais podem ser mitigados com uma dosagem apenas à noite ou com o uso de um esquema de escalonamento das doses.
Clonidina
a clonidina, um agente anti-hipertensivo, reduz os fogachos, mas pode ser menos eficaz que os ISRSs/IRSNs e a gabapentina.[36]Stuenkel CA, Davis SR, Gompel A, et al. Treatment of symptoms of the menopause: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2015 Nov;100(11):3975-4011.
https://academic.oup.com/jcem/article/100/11/3975/2836060
http://www.ncbi.nlm.nih.gov/pubmed/26444994?tool=bestpractice.com
A hipotensão pode ser um efeito adverso limitador do tratamento.[64]Goldberg RM, Loprinzi CL, O'Fallon JR, et al. Transdermal clonidine for ameliorating tamoxifen-induced hot flashes. J Clin Oncol. 1994 Jan;12(1):155-8.
http://www.ncbi.nlm.nih.gov/pubmed/8270972?tool=bestpractice.com
Deve-se monitorar a pressão arterial durante a terapia e quanto à presença do efeito rebote após a descontinuação. Os adesivos transdérmicos proporcionam estabilidade nos níveis sanguíneos e são preferidos às preparações orais de clonidina.[36]Stuenkel CA, Davis SR, Gompel A, et al. Treatment of symptoms of the menopause: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2015 Nov;100(11):3975-4011.
https://academic.oup.com/jcem/article/100/11/3975/2836060
http://www.ncbi.nlm.nih.gov/pubmed/26444994?tool=bestpractice.com
Sintomas de atrofia urogenital
Preparações de estrogênio vaginal em de baixa dose podem ser consideradas em mulheres com sintomas de atrofia urogenital.[17]The North American Menopause Society Advisory Panel. The 2022 hormone therapy position statement of The North American Menopause Society. Menopause. 2022 Jul 1;29(7):767-94.
http://www.ncbi.nlm.nih.gov/pubmed/35797481?tool=bestpractice.com
Uma revisão de bancos de dados Medline e Cochrane demonstrou que o estrogênio vaginal é mais efetivo que o placebo para melhorar o ressecamento e diminuir a dispareunia, a urgência miccional e a polaciúria.[65]Rahn DD, Carberry C, Sanses TV, et al.; Society of Gynecologic Surgeons Systematic Review Group. Vaginal estrogen for genitourinary syndrome of menopause: a systematic review. Obstet Gynecol. 2014 Dec;124(6):1147-56.
http://www.ncbi.nlm.nih.gov/pubmed/25415166?tool=bestpractice.com
As taxas de infecções do trato urinário também diminuíram com o uso de estrogênio vaginal. Os níveis séricos de estradiol permaneceram normais na pós-menopausa, exceto para aquelas que usaram creme de estrogênio vaginal em altas doses.[65]Rahn DD, Carberry C, Sanses TV, et al.; Society of Gynecologic Surgeons Systematic Review Group. Vaginal estrogen for genitourinary syndrome of menopause: a systematic review. Obstet Gynecol. 2014 Dec;124(6):1147-56.
http://www.ncbi.nlm.nih.gov/pubmed/25415166?tool=bestpractice.com
Em mulheres sem história de câncer hormônio-dependente, pode-se continuar o tratamento com estrogênio vaginal para alívio dos sintomas, e não há evidências para recomendar o monitoramento endometrial.[30]North American Menopause Society. Management of symptomatic vulvovaginal atrophy: 2013 position statement of the North American Menopause Society. Menopause. 2013 Sep;20(9):888-902.
http://www.menopause.org/docs/default-source/2013/vva-position-statement.pdf?sfvrsn=0
http://www.ncbi.nlm.nih.gov/pubmed/23985562?tool=bestpractice.com
No estudo observacional da Women's Health Initiative, o risco de doenças cardiovasculares, câncer de mama invasivo e câncer de endométrio não diferiu entre mulheres que eram usuárias ou não de estrogênio vaginal.[66]Crandall CJ, Hovey KM, Andrews CA, et al. Breast cancer, endometrial cancer, and cardiovascular events in participants who used vaginal estrogen in the Women's Health Initiative Observational Study. Menopause. 2018 Jan;25(1):11-20.
http://www.ncbi.nlm.nih.gov/pubmed/28816933?tool=bestpractice.com
Estrogênios vaginais não exigem reposição com progestina.
Comprimidos de estradiol vaginal não promovem absorção sistêmica significativa e podem ser utilizados a longo prazo, se necessário. No entanto, em outubro de 2019, a European Medicines Agency recomendou limitar o uso de cremes vaginais com alta concentração de estradiol (contendo estradiol a 100 microgramas/g ou 0,01%) a um único período de tratamento de até 4 semanas. Isso ocorreu porque os níveis de estradiol no sangue estavam acima dos níveis normais em mulheres menopausadas e podiam resultar em efeitos adversos similares aos observados na TH (oral ou transdérmica) sistêmica (por exemplo, tromboembolismo venoso, AVC, câncer de endométrio, câncer de mama). Essa formulação não deve ser usada em pacientes já submetidos à TH.[67]European Medicines Agency. Four-week limit for use of high-strength estradiol creams. Press release. Oct 2019 [internet publication].
https://www.ema.europa.eu/en/news/four-week-limit-use-high-strength-estradiol-creams
Assim, pode ser preferível usar outras formulações de estrogênio vaginais (por exemplo, creme de estrogênio conjugado, anéis e comprimidos intravaginais de estradiol). Não há evidências que sugiram que uma preparação de estrogênio vaginal seja mais eficaz que qualquer outra.[68]Lethaby A, Ayeleke RO, Roberts H. Local oestrogen for vaginal atrophy in postmenopausal women. Cochrane Database Syst Rev. 2016 Aug 31;(8):CD001500.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001500.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/27577677?tool=bestpractice.com
O ospemifeno é um modulador seletivo de receptor estrogênico indicado para o tratamento da dispareunia em mulheres menopausadas. Em um ensaio de fase 3, o ospemifeno aumentou a porcentagem de células superficiais e reduziu a dispareunia, em comparação com o placebo.[69]Portman DJ, Bachmann GA, Simon JA. Ospemifene, a novel selective estrogen receptor modulator for treating dyspareunia associated with postmenopausal vulvar and vaginal atrophy. Menopause. 2013 Jun;20(6):623-30.
http://www.ncbi.nlm.nih.gov/pubmed/23361170?tool=bestpractice.com
Fogachos foram o evento adverso relatado com mais frequência (ospemifeno 7% x placebo 4%).[69]Portman DJ, Bachmann GA, Simon JA. Ospemifene, a novel selective estrogen receptor modulator for treating dyspareunia associated with postmenopausal vulvar and vaginal atrophy. Menopause. 2013 Jun;20(6):623-30.
http://www.ncbi.nlm.nih.gov/pubmed/23361170?tool=bestpractice.com
[70]Palacios S, Cancelo MJ. Clinical update on the use of ospemifene in the treatment of severe symptomatic vulvar and vaginal atrophy. Int J Womens Health. 2016 Oct 26;8:617-26.
https://www.dovepress.com/clinical-update-on-the-use-of-ospemifene-in-the-treatment-of-severe-sy-peer-reviewed-fulltext-article-IJWH
http://www.ncbi.nlm.nih.gov/pubmed/27822125?tool=bestpractice.com
Sobreviventes de câncer de mama e ginecológico
Recomendações de consenso sobre o manejo dos sintomas da menopausa após o câncer de mama incluem:[71]Santen RJ, Stuenkel CA, Davis SR, et al. Managing menopausal symptoms and associated clinical issues in breast cancer survivors. J Clin Endocrinol Metab. 2017 Oct 1;102(10):3647-61.
http://www.ncbi.nlm.nih.gov/pubmed/28934376?tool=bestpractice.com
[72]American College of Obstetricians and Gynecologists. Clinical consensus no. 2: treatment of urogenital symptoms in individuals with a history of estrogen-dependent breast cancer. Dec 2021 [internet publication].
https://www.acog.org/clinical/clinical-guidance/clinical-consensus/articles/2021/12/treatment-of-urogenital-symptoms-in-individuals-with-a-history-of-estrogen-dependent-breast-cancer
Em geral, evitar o tratamento com terapia hormonal sistêmica para menopausa ou estrogênio vaginal*
Implementar a modificação do estilo de vida (por exemplo, dieta saudável, atividades físicas regulares, abandono do hábito de fumar, perda de peso, limitar ou evitar o álcool, manter níveis adequados de vitamina D e cálcio)
Terapia farmacológica não hormonal, (por exemplo, inibidores seletivos de recaptação de serotonina/noradrenalina) e/ou terapia cognitivo-comportamental.
*Há dados que sugerem que a TH não aumenta o risco de recorrência em mulheres que não apresentam malignidade estrogênio-dependente.[73]Del Carmen MG, Rice LW. Management of menopausal symptoms in women with gynecologic cancers. Gynecol Oncol. 2017 Aug;146(2):427-35.
http://www.ncbi.nlm.nih.gov/pubmed/28625396?tool=bestpractice.com
[74]O'Donnell RL, Clement KM, Edmondson RJ. Hormone replacement therapy after treatment for a gynaecological malignancy. Curr Opin Obstet Gynecol. 2016 Feb;28(1):32-41.
http://www.ncbi.nlm.nih.gov/pubmed/26626038?tool=bestpractice.com
Uma revisão sugeriu que uso de TH no curto prazo pode melhorar os sintomas vasomotores e geniturinários da menopausa em pacientes com câncer ginecológico que não apresentem malignidade estrogênio-dependente.[73]Del Carmen MG, Rice LW. Management of menopausal symptoms in women with gynecologic cancers. Gynecol Oncol. 2017 Aug;146(2):427-35.
http://www.ncbi.nlm.nih.gov/pubmed/28625396?tool=bestpractice.com
O uso de estrogênios em mulheres com malignidade não estrogênio-dependente deve ser adaptado à situação da paciente.
O gel policarbófilo, um hidratante vaginal, também pode ser oferecido para sintomas da atrofia vaginal, inclusive ressecamento e dispareunia.[75]Goetsch MF, Lim JY, Caughey AB. Locating pain in breast cancer survivors experiencing dyspareunia: a randomized controlled trial. Obstet Gynecol. 2014 Jun;123(6):1231-6.
http://www.ncbi.nlm.nih.gov/pubmed/24807329?tool=bestpractice.com
[76]Reid R, Abramson BL, Blake J, et al. Managing menopause. J Obstet Gynaecol Can. 2014 Sep;36(9):830-3.
https://www.jogc.com/article/S1701-2163(15)30487-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/25222364?tool=bestpractice.com
Dispareunia é comum em sobreviventes de câncer de mama, por causa da atrofia e ressecamento decorrentes da falta de estrogênio. Em um pequeno ensaio, a lidocaína reduziu a sensibilidade no vestíbulo vulvar em sobreviventes do câncer de mama na pós-menopausa com dispareunia (dor coital mediana com escore 8 numa escala de 10 pontos), em comparação com o soro fisiológico.[75]Goetsch MF, Lim JY, Caughey AB. Locating pain in breast cancer survivors experiencing dyspareunia: a randomized controlled trial. Obstet Gynecol. 2014 Jun;123(6):1231-6.
http://www.ncbi.nlm.nih.gov/pubmed/24807329?tool=bestpractice.com
A desidroepiandrosterona intravaginal (DHEA) e o ospemifeno oral são aprovados para o tratamento da dispareunia, mas ainda não se estabeleceu a segurança após o câncer de mama.[71]Santen RJ, Stuenkel CA, Davis SR, et al. Managing menopausal symptoms and associated clinical issues in breast cancer survivors. J Clin Endocrinol Metab. 2017 Oct 1;102(10):3647-61.
http://www.ncbi.nlm.nih.gov/pubmed/28934376?tool=bestpractice.com
Libido reduzida
Mulheres com desejo sexual muito baixo e cansaço devem ser orientadas sobre a opção de suplementação de androgênios, sobretudo se um estrogênio, com ou sem uma progestina, não tiver sido eficaz.
A The Endocrine Society não recomenda o diagnóstico de deficiência de androgênios em mulheres menopausadas saudáveis por haver ausência de uma síndrome bem-definida e falta de dados que correlacionem o nível de androgênios com sinais ou sintomas específicos.[77]Wierman ME, Arlt W, Basson R, et al. Androgen therapy in women: a reappraisal: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2014 Oct;99(10):3489-510.
https://academic.oup.com/jcem/article/99/10/3489/2836272
http://www.ncbi.nlm.nih.gov/pubmed/25279570?tool=bestpractice.com
Consulte Disfunção sexual em mulheres.
Incontinência urinária de esforço
A reabilitação do assoalho pélvico pode ser útil para a incontinência urinária de esforço.[78]Dumoulin C, Cacciari LP, Hay‐Smith EJC. Pelvic floor muscle training versus no treatment, or inactive control treatments, for urinary incontinence in women. Cochrane Database Syst Rev. 2018 Oct 4;(10):CD005654.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD005654.pub4/full?highlightAbstract=floor%7Cpelvic
Em um estudo, 73.4% das mulheres menopausadas randomizadas para uma combinação de estriol intravaginal e reabilitação do assoalho pélvico por 6 meses apresentaram melhoria subjetiva na incontinência urinária por estresse em comparação com apenas 9.71% das mulheres do grupo de controle (somente estriol).[79]Capobianco G, Donolo E, Borghero G, et al. Effects of intravaginal estriol and pelvic floor rehabilitation on urogenital aging in postmenopausal women. Arch Gynecol Obstet. 2012 Feb;285(2):397-403.
http://www.ncbi.nlm.nih.gov/pubmed/21706345?tool=bestpractice.com
Os dois grupos relataram a melhora dos sinais e sintomas de atrofia urogenital.
Perturbação do sono e sintomas do humor
A dificuldade de dormir ou inquietação e despertares noturnos são problemas comuns durante a menopausa. Com frequência, a insônia é associada a fogachos (outros fatores, como depressão ou apneia do sono, também podem estar envolvidos). Mas não há estudos que demonstrem uma ligação fisiológica direta.
Algumas mulheres relatam melhora do sono quando fazem a TH.[17]The North American Menopause Society Advisory Panel. The 2022 hormone therapy position statement of The North American Menopause Society. Menopause. 2022 Jul 1;29(7):767-94.
http://www.ncbi.nlm.nih.gov/pubmed/35797481?tool=bestpractice.com
[80]Freedman RR. Pathophysiology and treatment of menopausal hot flashes. Semin Reprod Med. 2005 May;23(2):117-25.
http://www.ncbi.nlm.nih.gov/pubmed/15852197?tool=bestpractice.com
Em uma revisão sistemática de 11 estudos de qualidade variável, a progesterona melhorou os SVMs e a qualidade do sono.[81]Spark MJ, Willis J. Systematic review of progesterone use by midlife and menopausal women. Maturitas. 2012 Jul;72(3):192-202.
http://www.ncbi.nlm.nih.gov/pubmed/22541358?tool=bestpractice.com
Os dados sugerem que o uso da TH em curto prazo pode melhorar o humor e os sintomas depressivos durante a transição da menopausa e na menopausa precoce, mas os resultados do estudo são inconsistentes.[82]Gordon JL, Girdler SS. Hormone replacement therapy in the treatment of perimenopausal depression. Curr Psychiatry Rep. 2014 Dec;16(12):517.
http://www.ncbi.nlm.nih.gov/pubmed/25308388?tool=bestpractice.com
[83]Veerus P, Hovi SL, Sevón T, et al. The effect of hormone therapy on women's quality of life in the first year of the Estonian Postmenopausal Hormone Therapy trial. BMC Res Notes. 2012 Apr 3;5:176.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3349465
http://www.ncbi.nlm.nih.gov/pubmed/22472039?tool=bestpractice.com
Há evidências que sugerem que a terapia cognitivo-comportamental (TCC) pode ter um papel benéfico no manejo do humor deprimido e da ansiedade em mulheres com sintomas da menopausa após um tratamento de câncer de mama.[84]Mann E, Smith MJ, Hellier J, et al. Cognitive behavioural treatment for women who have menopausal symptoms after breast cancer treatment (MENOS 1): a randomised controlled trial. Lancet Oncol. 2012 Mar;13(3):309-18.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3314999
http://www.ncbi.nlm.nih.gov/pubmed/22340966?tool=bestpractice.com
Não existem evidências de alta qualidade relacionadas à TCC especificamente em mulheres com depressão associada à menopausa precoce, mas dado o baixo risco de danos e a forte base de evidências para tratar a depressão na população geral, ela é uma opção razoável nas mulheres que estão na perimenopausa com depressão.[85]Maki PM, Kornstein SG, Joffe H, et al; Board of Trustees for The North American Menopause Society (NAMS) and the Women and Mood Disorders Task Force of the National Network of Depression Centers. Guidelines for the evaluation and treatment of perimenopausal depression: summary and recommendations. Menopause. 2018 Oct;25(10):1069-85.
https://journals.lww.com/menopausejournal/Fulltext/2018/10000/Guidelines_for_the_evaluation_and_treatment_of.5.aspx
http://www.ncbi.nlm.nih.gov/pubmed/30179986?tool=bestpractice.com
Embora a TH ou outras alternativas possam melhorar os padrões de sono, deve-se fazer uma avaliação de outros fatores subjacentes que possam exigir tratamento direcionado. Transtornos de humor, notadamente a depressão, muitas vezes melhoram com a TH; contudo, os antidepressivos convencionais podem ser mais efetivos.[86]Cohen LS, Soares CN, Joffe H. Diagnosis and management of mood disorders during the menopausal transition. Am J Med. 2005 Dec 19;118(suppl 12B):93-7.
http://www.ncbi.nlm.nih.gov/pubmed/16414333?tool=bestpractice.com
Mulheres com sintomas de depressão grave devem ser encaminhadas para avaliação da saúde mental.
Fitoterapia ou terapias alternativas
Uma revisão Cochrane de 43 ECRCs que envolviam fitoestrogênios constatou haver um grande efeito placebo (de 1% a 59%) na maioria dos ensaios.[87]Lethaby A, Marjoribanks J, Kronenberg F, et al. Phytoestrogens for menopausal vasomotor symptoms. Cochrane Database Syst Rev. 2013 Dec 10;(12):CD001395.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001395.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/24323914?tool=bestpractice.com
Esta e outras revisões não constataram nenhuma evidência conclusiva de que os fitoestrogênios, inclusive as isoflavonas, sejam eficazes para o manejo dos SVMs na menopausa.[34]American College of Obstetricians and Gynecologists. Practice bulletin no. 141: management of menopausal symptoms. Jan 2014 [internet publication].
https://www.acog.org/clinical/clinical-guidance/practice-bulletin/articles/2014/01/management-of-menopausal-symptoms
[87]Lethaby A, Marjoribanks J, Kronenberg F, et al. Phytoestrogens for menopausal vasomotor symptoms. Cochrane Database Syst Rev. 2013 Dec 10;(12):CD001395.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001395.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/24323914?tool=bestpractice.com
[88]Sacks FM, Lichtenstein A, Van Horn L, et al; American Heart Association Nutrition Committee. Soy protein, isoflavones, and cardiovascular health: an American Heart Association Science Advisory for professionals from the Nutrition Committee. Circulation. 2006 Feb 21;113(7):1034-44.
http://circ.ahajournals.org/content/113/7/1034.long
http://www.ncbi.nlm.nih.gov/pubmed/16418439?tool=bestpractice.com
A acupuntura e a reflexologia não mostraram melhorar significativamente os SVMs em comparação com o placebo.[34]American College of Obstetricians and Gynecologists. Practice bulletin no. 141: management of menopausal symptoms. Jan 2014 [internet publication].
https://www.acog.org/clinical/clinical-guidance/practice-bulletin/articles/2014/01/management-of-menopausal-symptoms


