Abordagem
Diretriz confiável
ebpracticenet recomenda que você priorize as seguintes diretrizes locais:
Diagnostiek van dementie in de huisartsenpraktijkPublicada por: ACHG | Expertisecentrum Dementie VlaanderenÚltima publicação: 2020Diagnostic de la démence en médecine généralePublicada por: ACHG | Expertisecentrum Dementie VlaanderenÚltima publicação: 2020Ao avaliar um paciente com preocupações sobre perda de memória, as seguintes questões devem ser consideradas:
O paciente realmente tem perda de memória ou há outro problema cognitivo causando o distúrbio de memória?
Qual é a localização do problema de memória no cérebro?
Qual é o perfil temporal da perda de memória: agudo (segundos/minutos/horas), subagudo (dias/semanas) ou crônico (muitos meses a anos)?
Quais etiologias podem ser responsáveis pelo distúrbio de memória?
Perda de memória versus outro problema cognitivo
A primeira consideração é determinar se o paciente realmente tem perda de memória ou se há outro problema cognitivo.
Algum grau de perda de memória ocorre normalmente com o envelhecimento. O envelhecimento normal causa redução da capacidade de recuperação por um declínio na função do lobo frontal, mas sem interferir nas atividades da vida diária.[39] A perda de memória se torna particularmente preocupante quando afeta as funções ou atividades da vida diária.
Disfunções na memória podem resultar de lesões hipocampais (perda de memória de curto prazo, por exemplo, demência de Alzheimer), bem como de lesões na estrutura do cérebro envolvidas no armazenamento de longo prazo (por exemplo, demência semântica). Em muitos casos, a memória é codificada adequadamente no hipocampo, mas os pacientes têm dificuldade de recuperar a memória armazenada. Tipicamente, essa deficiência na recuperação se deve a problemas na função do lobo frontal, frequentemente causados por doença da substância branca.
É importante diferenciar entre distúrbios de consciência flutuantes e transitórios decorrentes de um delirium e um distúrbio de memória subjacente. Muitos medicamentos podem induzir confusão ou até mesmo delirium em idosos; por exemplo, quanto maior o número de medicamentos anticolinérgicos um paciente toma, maior o risco de hospitalização por confusão ou demência.[40]
A história, o exame físico e o teste psicológico podem ser úteis para distinguir entre um distúrbio de memória primário e um delirium ou comprometimento da memória.
A pseudodemência é um termo usado para descrever um deficit cognitivo derivado de um transtorno psiquiátrico primário, que mimetiza a demência e é reversível após o tratamento do diagnóstico primário.[41] Essas condições primárias incluem transtorno depressivo, transtorno bipolar e esquizofrenia. A pseudodemência pode resultar em um quadro clínico que sugere transtorno de memória com redução da concentração, perturbações do sono e comprometimento leve de lembranças tardias.[39] Geralmente, é usada uma escala de depressão geriátrica para ajudar a diferenciar entre a pseudodemência depressiva e outras formas de demência.[42] [ Escala de Depressão Geriátrica Opens in new window ] Os resultados da escala são combinados com outras informações sobre a história da pessoa e o funcionamento atual para auxiliar no diagnóstico.
Pacientes com problemas ou queixas sobre memória, que não se encaixam no diagnóstico de demência porque não são funcionalmente deficientes, geralmente são reconhecidos como tendo um comprometimento cognitivo leve (CCL). Por definição, os deficits em pacientes com CCL não são suficientemente graves para interferir em suas atividades normais da vida diária.
Localização do problema de memória
O próximo passo ao avaliar um paciente com perda de memória é determinar a localização da perda de memória. Tradicionalmente, a memória tem sido dividida nos seguintes sistemas de memória: memória episódica, memória de trabalho, memória semântica e memória procedural.[43] Estruturas cerebrais separadas são responsáveis por cada um desses tipos de memória.
Memória episódica: dura de minutos a anos, e localiza-se no hipocampo e nos circuitos límbicos.[43]
Memória de trabalho: um tipo de memória que dura segundos e envolve ensaio ativo da informação; depende da integridade do córtex pré-frontal e da memória ecoica no giro angular.[43]
Memória semântica: tipicamente, consiste em informações factuais (por exemplo, saber o que é determinado objeto e para que é usado, saber quem foi o primeiro Presidente dos EUA) e localiza-se nos lobos temporais inferolaterais.[43]
Memória procedural: relacionada a dirigir um carro ou andar de bicicleta, e envolve os gânglios da base, o cerebelo e a área motora suplementar.[43]
O tipo de deficiência de memória manifestada através da história, do exame físico e de testes neuropsicológicos podem dar uma indicação da localização do processo da doença.
Perfil temporal
A velocidade de progressão clínica da perda de memória é uma pista útil para entender a etiologia subjacente:
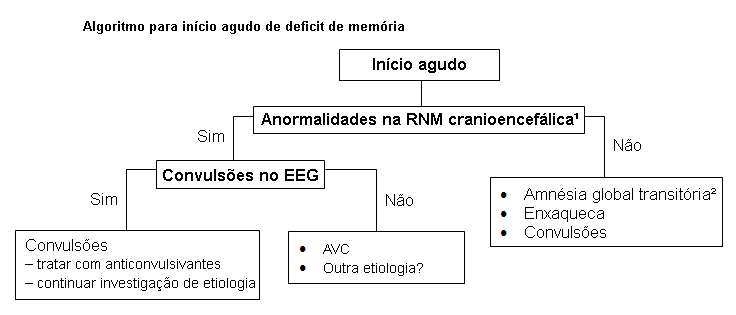
Sintomas agudos (isto é, de minutos a horas) sugerem acidente vascular cerebral (AVC) isquêmico, AVC hemorrágico, convulsões, enxaqueca ou amnésia global transitória.[Figure caption and citation for the preceding image starts]: Algoritmo de diagnóstico para início agudo de deficit de memória. 1: alterações nas intensidades dos sinais, lesões estruturais na ressonância nuclear magnética (RNM) cranioencefálica; 2: às vezes, intensidades maiores de sinal na imagem ponderada por difusão; EEG, eletroencefalograma; RM - ressonância nucelar magnéticaCriado por Mee-Ohk Kim, MD, PhD e Michael D. Geschwind, MD, PhD; usado com permissão [Citation ends].
Sintomas subagudos (isto é, dias a meses) ocorrem tipicamente em doenças infecciosas e inflamatórias, como encefalopatia límbica e síndrome de Wernicke-Korsakoff. Demência que evolui ao longo de semanas a meses ocorre na doença de Creutzfeldt-Jakob (DCJ) e na encefalopatia de Hashimoto.[Figure caption and citation for the preceding image starts]: Algoritmo de diagnóstico para início subagudo de deficit de memória. 1: lterações nas intensidades dos sinais, lesões estruturais na ressonância nuclear magnética (RNM) cranioencefálica; 3: RNM na doença de Creutzfeldt-Jacob (DCJ) mostra fitas corticais (hiperintensidade nos giros corticais) e/ou difusão restrita com núcleo profundo no mapa da imagem ponderada por difusão/coeficiente de difusão aparente (IPD/CDA); os biomarcadores do líquido cefalorraquidiano (LCR) podem estar elevados; CDA, coeficiente de difusão aparente; DCJ, doença de Creutzfeldt-Jacob; LCR, líquido cefalorraquidiano; IPD, imagem ponderada por difusão; HSV, vírus do herpes simples; RNM, ressonância nuclear magnética; ENE, enolase neurônio-específica.Criado por Mee-Ohk Kim, MD, PhD e Michael D. Geschwind, MD, PhD; usado com permissão [Citation ends].

Sintomas crônicos (>2 anos) sugerem um processo neurodegenerativo ou uma demência vascular. A perda de memória decorrente de doença vascular isquêmica de pequenos vasos geralmente é gradual e não por etapas.[Figure caption and citation for the preceding image starts]: Algoritmo de diagnóstico para início crônico de deficit de memória; vcDFT, variante comportamental da demência frontotemporal; DCB, degeneração corticobasal; FDG-PET, tomografia por emissão de pósitrons com fluordesoxiglucose; DFT, demência frontotemporal; PL, punção lombar; PIB-PET, B com composto Pittsburgh - tomografia por emissão de pósitrons; APNF, afasia progressiva não fluente; PSP, paralisia supranuclear progressivaCriado por Mee-Ohk Kim, MD, PhD e Michael D. Geschwind, MD, PhD; usado com permissão [Citation ends].

História
Uma história abrangente é o primeiro e mais importante passo para a investigação diagnóstica de perda de memória. Como muitos pacientes podem não estar cientes de seus deficits, informantes confiáveis que interagem com o paciente regularmente (idealmente todos os dias) são essenciais para traçar uma história completa. A história ajudará a delinear a evolução temporal, os sintomas iniciais e quaisquer sintomas patognomônicos que acompanhem a perda de memória.
Perguntas básicas de rastreamento por outros domínios cognitivos em associação com a memória (por exemplo, executivo, linguagem, visuoespacial, comportamento, humor, sistemas motor e autônomo) diferenciarão mais detalhadamente as possíveis causas da doença neurodegenerativa. Por fim, sintomas concomitantes que ocorrem em associação com a perda de memória devem ser examinados. Estes fatores podem ajudar a distinguir as várias causas de deficiência da memória.
Sintomas manifestos
A perda de memória episódica de curta duração (por exemplo, perguntas repetitivas, perda de pertences) é um sintoma precoce comum da demência de Alzheimer (DA).
A disfunção visuoespacial (por exemplo, ficar perdido em lugares familiares) ocorre na DA. A disfunção visuoespacial é um sintoma proeminente de demência com corpos de Lewy.
Problemas de linguagem: pacientes com DA inicial podem ter dificuldade para falar e para dar nomes aos objetos. Quando a doença está mais avançada, os pacientes podem desenvolver fala não fluente, paráfrases e transmissão de informações de forma inapropriada.
Alterações significativas na personalidade e no comportamento social ocorrem do início do ciclo da demência frontotemporal e da DCJ, mas ocorrem em um momento posterior do ciclo da DA. Também ocorrem alterações da personalidade na paralisia supranuclear progressiva (PSP), e ocorrem mudanças no comportamento na encefalopatia límbica.
As alterações cognitivas na demência vascular variam e dependem muito da região do cérebro afetada pela patologia vascular. Deficits de atenção, de processamento de informações e de função executiva são comuns.[44] Dificuldade de iniciar uma atividade, processamento cognitivo lento, dificuldade para solucionar problemas, perseverança e desinibição podem ocorrer na demência vascular.
A perda de memória de longo prazo é uma característica de estágios mais avançados da DA.
Podem ocorrer prosopagnosia e autoprosopagnosia na DA avançada.
Consciência: ocorre consciência flutuante na demência com corpos de Lewy. A consciência alterada pode ser uma característica da encefalopatia límbica. A alteração do nível de consciência de início rápido é uma característica da encefalopatia de Hashimoto. Episódios repetidos e estereotipados de alteração do nível de consciência caracterizam as convulsões complexas.
Alucinações: alucinações visuais complexas indicam demência com corpos de Lewy. Alucinações e delírios podem estar presentes na demência vascular. Também ocorrem alucinações na encefalopatia de Hashimoto.
Depressão, apatia e ansiedade são sintomas iniciais comuns na degeneração corticobasal. Os pacientes com DA podem apresentar sintomas de apatia e depressão em um momento mais precoce do ciclo da doença, antes que haja alterações da personalidade mais significativas. Pode ocorrer depressão em pacientes com demência vascular.
A degeneração corticobasal pode começar com sintomas cognitivos, incluindo afasia.[7]
Um infarto talâmico anterior pode resultar em sintomas crônicos de apatia ou perseveração e perda de memória.
Irritabilidade, apatia, sonolência, desconfiança, instabilidade emocional e confusão podem ocorrer na deficiência de vitamina B12.
Pacientes com demência semântica perdem o conhecimento sobre o que as coisas significam (semântica). Eles também podem apresentar uma incapacidade de reconhecer emoções na face de outras pessoas e de sentirem empatia.
Sintomas associados
Sintomas motores: ocorre atividade motora tônico-clônica generalizada na crise tônico-clônica generalizada. Dificuldade de olhar para baixo e rigidez no pescoço e no tronco ocorrem na PSP. Parkinsonismo (por exemplo, bradicinesia, rigidez, hipomimia, tremor, postura inclinada, distúrbio da marcha) é encontrado em uma variedade de doenças neurodegenerativas, incluindo demência com corpos de Lewy, DCJ, PSP e degeneração corticobasal.
Ocorrem anormalidades da marcha na hidrocefalia de pressão normal. Pacientes com demência vascular podem apresentar redução da marcha, marcha arrastada e pés presos ao chão ao começar a andar. A ataxia pode ser observada em muitas demências, incluindo DCJ, demência associada ao HIV, encefalopatia límbica (e vários distúrbios paraneoplásicos autoimunes), encefalopatia de Hashimoto, AVC isquêmico/demência vascular, deficiência de vitamina B12 e síndrome de Wernicke-Korsakoff.
Quedas: ocorrem quedas inexplicadas no início do ciclo da PSP.
Fraqueza facial e/ou nos membros, parestesia, dormência e dificuldade de fala podem ocorrer no AVC da circulação anterior. A encefalopatia de Hashimoto pode causar sintomas parecidos ao AVC.
Tontura pode ser uma característica de AVC de circulação posterior ou pode ocorrer após uma lesão cerebral traumática.
Perda da visão ou visão dupla podem ocorrer no AVC de circulação posterior.
Cefaleia: pode ocorrer cefaleia intensa de início súbito no AVC hemorrágico. Na enxaqueca, ocorrem episódios de cefaleia latejante unilateral, que podem ou não ser acompanhados por aura visual. A cefaleia pode ser sinal de pressão intracraniana elevada em pacientes com lesão de massa. A cefaleia também pode ocorrer após a lesão cerebral traumática.
Podem ocorrer náuseas e vômitos na enxaqueca e, raramente, na amnésia global transitória. Pacientes com pressão intracraniana elevada causada por lesão de massa podem relatar náuseas e vômitos.
Pode ocorrer fonofobia na enxaqueca e após a lesão cerebral traumática.
Pode ocorrer fotofobia na enxaqueca.
A perda de massa muscular e a fraqueza muscular sugerem esclerose lateral amiotrófica, que pode ocorrer com a demência frontotemporal.
Distúrbios do sono REM (por exemplo, movimentos bruscos ou complexos durante o sono) ocorrem na demência com corpos de Lewy.
Podem ocorrer convulsões na encefalopatia límbica e na encefalopatia de Hashimoto.
Ocorre disfagia na PSP.
A disartria é observada na PSP, na degeneração corticobasal, em distúrbios que afetam o cerebelo e no AVC.
A hipofonia (voz suave) ocorre na demência com corpos de Lewy e na PSP.
A incontinência urinária ocorre na hidrocefalia de pressão normal e pode ocorrer durante a convulsão.
Pode ocorrer fadiga no hipotireoidismo e após a lesão cerebral traumática.
Intolerância ao frio, ganho de peso e sintomas neuropsiquiátricos ocorrem por vezes no hipotireoidismo.
História médica pregressa
Hipertensão, diabetes, hipercolesterolemia, doença cardíaca isquêmica e/ou história de acidente vascular cerebral estão frequentemente presentes em pacientes com demência vascular ou acidente vascular cerebral isquêmico agudo. Um grande estudo de coorte revelou que a pressão arterial sistólica ≥130 mmHg aos 50 anos está associada à demência, e esse risco excessivo é independente de doença cardiovascular.[45]
Os fatores de risco para AVC hemorrágico incluem hipertensão, angiopatia amiloide, trombose do seio venoso, tumor hemorrágico e malformação arteriovenosa.
Geralmente, a demência frontotemporal está associada à esclerose lateral amiotrófica.
Os pacientes com tireoidite autoimune podem desenvolver encefalopatia de Hashimoto, que está associada a anticorpos antitireoglobulina ou antitireoperoxidase elevados.
Os pacientes com neurossífilis podem apresentar história distante de lesão genital ou erupção cutânea palmar.
Podem estar presentes fatores de risco para convulsão. Eles incluem: história prévia de traumatismo cranioencefálico, atraso no desenvolvimento, convulsões febris infantis, meningoencefalite prévia e lesões intraparenquimatosa com efeito de massa.
A síndrome de Wernicke-Korsakoff é decorrente da deficiência de tiamina, a qual pode ser causada pelos seguintes fatores: alcoolismo, cirurgia bariátrica ou desnutrição.
Pacientes com deficiência de vitamina B12 geralmente apresentam fatores de risco para deficiência (por exemplo, dieta vegana rigorosa sem suplementos vitamínicos, desnutrição, anemia perniciosa, cirurgia intestinal extensa, internação em instituições, anemia, atrofia gástrica).
Câncer de pulmão, de mama, colorretal e renal, e o melanoma podem metastizar para o cérebro.
História familiar
A história familiar de, pelo menos, três gerações é útil para identificar pacientes com possível aumento do risco de DA. Investigue especificamente sobre a idade de início dos sintomas neurológicos ou psiquiátricos, o tipo de demência e o método de diagnóstico, a idade atual dos familiares, a idade com que faleceram os parentes já falecidos (especialmente os familiares não afetados) e as causas da morte.[46] Aproximadamente de 10% a 15% dos casos de DCJ são hereditários.[47]
História de medicamentos
Medicamentos com propriedades anticolinérgicas podem exacerbar os sintomas de deficit de memória.[48] Muitos outros medicamentos podem afetar a cognição, inclusive benzodiazepínicos, opioides, antipsicóticos, corticosteroides, alguns anticonvulsivantes e alguns antidepressivos.[49]
Os pacientes podem ter a preocupação de um vínculo entre o uso de estatinas e o declínio cognitivo. No entanto, um grande estudo de coorte prospectivo, realizado na Austrália, não encontrou diferenças na taxa de redução da memória e cognição global ao longo de 6 anos entre usuários de estatina e indivíduos que nunca fizeram uso da substância.[50]
História social
Estabelecer o impacto que os sintomas estão tendo na vida diária do paciente é essencial. Os sintomas do paciente podem comprometer sua segurança, por exemplo, se ele se esquece de desligar os aparelhos da cozinha ou saem e não conseguem encontrar o caminho de casa. Informe-se sobre como lavar, alimentar, ir ao banheiro, fazer compras, cozinhar, administrar finanças, lembrar de compromissos e viajar.[51]
Pergunte se o paciente dirige um veículo. Em alguns países, como o Reino Unido, os pacientes devem informar às agências reguladoras sobre problemas graves de memória ou diagnóstico de demência.[52]
Os fatores de risco para vírus da imunodeficiência humana (HIV) positivo (uso de drogas intravenosas, sexo desprotegido, lesão por picada de agulha) podem estar presentes na demência associada ao HIV. Geralmente, os sintomas se desenvolvem por meses, embora possam ter um início rápido durante a soroconversão. Os pacientes podem ter flutuações na cognição ou apatia.
A amnésia global transitória frequentemente é precedida por estresse, atividade física excessiva ou um evento emocional, e remite espontaneamente em algumas horas.
Estresse, menstruação, privação de sono e certos alimentos podem desencadear enxaqueca.
História colateral
Relato de um informante confiável, familiarizado com o paciente, é uma parte valiosa da avaliação. Uma possível ferramenta é o Informant Questionnaire on Cognitive Decline in the Elderly (IQCODE), que é um questionário baseado no relato de informantes (por exemplo, familiares, amigos etc.) sobre alterações na função cognitiva dos idosos pelos quais esses informadores têm apreço. A sensibilidade e a especificidade do IQCODE para diagnosticar demência em cenário comunitário são de, aproximadamente, 80%.[53] Quando o Informant Questionnaire on Cognitive Decline in the Elderly (IQCODE) foi usado no ambiente hospitalar geral ou em clínicas de memória, a sensibilidade combinada foi de 0.91 (IC de 95% 0.86 a 0.94) e a especificidade foi de 0.66 (IC de 95% 0.56 a 0.75). Entretanto, o uso do teste em ambiente hospitalar geral forneceu uma precisão muito maior (sensibilidade de 0.95 [IC de 95% 0.88 a 0.98] frente a 0.90 [IC de 95% 0.83 a 0.94]; especificidade de 0.81 [IC de 95% 0.71 a 0.88] frente a 0.54 [IC de 95% 0.44 a 0.64]).[54]
Outras ferramentas baseadas em informantes para a detecção de demência e/ou delirium podem incluir o teste AD8 e o teste de Demência = (MC)².[55]
Exame neurológico
A segunda parte da investigação é o exame neurológico. Diferentes achados no exame neurológico podem ser úteis no diagnóstico diferencial do deficit de memória.
Estado mental
O comprometimento da capacidade de atenção e de alerta frequentemente é observado na demência com corpos de Lewy, mas também pode ser notado em outras doenças, como demência associada ao HIV, encefalopatia límbica, encefalopatia de Hashimoto, lesão cerebral traumática, hipotireoidismo, hidrocefalia de pressão normal e lesão cerebral hipóxica secundária à parada cardíaca.
Afasia (disfunção na linguagem) é observada em demência vascular, demência semântica, DCJ, PSP, degeneração corticobasal, demência associada ao HIV, AVC isquêmico/hemorrágico e lesão cerebral traumática.
Apraxia (perda da capacidade de realizar movimentos previamente aprendidos) é observada em DCJ, demência vascular, degeneração corticobasal e doença de Alzheimer.
Pacientes com demência frontotemporal geralmente apresentam mau comportamento.
Exame dos nervos cranianos
Papiledema pode ser observado em lesão cerebral traumática ou em qualquer processo que cause edema, como um tumor.
Pode ocorrer paralisia do sexto nervo craniano na pressão intracraniana elevada. O nervo é alongado durante seu longo percurso intracraniano.
Oftalmoplegia pode ser observada na PSP, na degeneração corticobasal, doenças mitocondriais ou na síndrome de Wernicke-Korsakoff.
A predominância de olhar inerte, com olhos arregalados, e sobrancelhas franzidas é característica de PSP.
Nistagmo é observado na síndrome de Wernicke-Korsakoff.
Comprometimento do acompanhamento visual suave é observado em demência associada ao HIV e outras doenças.
As pupilas se contraem à acomodação mas não ao brilho da luz. Pupilas de Argyll Robertson podem ser observadas em pacientes com neurossífilis. Hemianopsia homônima é observada em demência vascular, AVC, DCJ ou síndromes de atrofia cortical posterior (geralmente, em decorrência do Alzheimer ou da demência com corpos de Lewy).
A disartria é observada na PSP, na degeneração corticobasal, em distúrbios que afetam o cerebelo e no AVC.
A hipofonia (voz suave) ocorre na demência com corpos de Lewy e na PSP.
Exame motor
Mioclonia é observada em demência com corpos de Lewy, na DCJ, degeneração corticobasal, encefalopatia límbica, encefalopatia de Hashimoto e lesão hipóxica.
Hemiparesia ou hemiplegia e perda hemissensitiva são observadas com maior frequência na demência vascular (pacientes de AVC). Fraqueza focal ocorre em lesão cerebral traumáticas se a lesão resultante (hematoma) pinçar os tratos corticoespinhais. Sinais de AVC também podem ser observados em neurossífilis.
Parkinsonismo (por exemplo, bradicinesia, rigidez, hipomimia, tremor, postura inclinada, distúrbio da marcha) é encontrado em uma variedade de doenças neurodegenerativas, incluindo demência com corpos de Lewy, DCJ, PSP e degeneração corticobasal.
Distonia dos membros, movimentos em espelho e fenômeno de membro alienígena são observados na síndrome corticobasal, que geralmente resulta da degeneração corticobasal ou da doença de Alzheimer, e na DCJ.[7]
Exame sensitivo
Neuropatia periférica pode estar presente em hipotireoidismo e associada à síndrome de Wernicke-Korsakoff.
Dormência ou perda sensitiva podem ser observadas em pacientes de AVC.
Pacientes com deficiência de vitamina B12 podem apresentar sintomas predominantes de redução de vibração e de propriocepção na coluna dorsal posterior, em associação com as queixas cognitivas. Dormência nos membros inferiores também pode ser observada.
Deficits sensoriais corticais (por exemplo, astereognosia, agrafestesia, extinção de estimulação simultânea dupla) são observados em degeneração corticobasal, síndrome corticobasal e DA avançada.
Reflexos
Sinais de liberação frontal (por exemplo, preensão palmar, reflexo palmomentoniano, reflexo de busca) são completamente inespecíficos para qualquer doença em particular, mas são observados em encefalopatias em geral; apenas o reflexo de preensão palmar localiza as lesões nos lobos frontais.
Retardo do relaxamento dos reflexos tendinosos profundos é observado em hipotireoidismo.
Reflexos tendinosos aumentados, reflexos de preensão/sucção e um sinal de Babinski positivo podem ser observados na demência associada ao HIV.
Hiporreflexia e um sinal de Babinski positivo podem ser observados na deficiência de vitamina B12.
Hiper-reflexia unilateral e um sinal de Babinski positivo podem ocorrer em um AVC.
Marcha
A ataxia pode ser observada em muitas demências, incluindo DCJ, demência associada ao HIV, encefalopatia límbica (e vários distúrbios paraneoplásicos autoimunes), encefalopatia de Hashimoto, AVC isquêmico/demência vascular, deficiência de vitamina B12 e síndrome de Wernicke-Korsakoff.
Bradicinesia da marcha com postura inclinada e redução dos movimentos pendulares dos braços é observada no espectro das doenças de Parkinson (síndrome corticobasal [geralmente decorrente de degeneração corticobasal, PSP ou doença de Alzheimer], PSP e demência com corpos de Lewy). Esses pacientes são particularmente suscetíveis ao exame de retropulsão.
Frequentemente, a marcha magnética é observada juntamente à hidrocefalia de pressão normal.
Marcha hemiparética pode ser observada na demência vascular.
Perda sensitiva de fibras grossas com sinal de Romberg positivo (decorrente de degeneração da coluna dorsal posterior) pode estar presente na neurossífilis.
Outra
Pele seca, mixedema pré-tibial e comprometimento auditivo podem estar presentes no hipotireoidismo.
Pode ocorrer atraso no ritmo do discurso, com pausas longas entre as palavras, na demência associada ao vírus da imunodeficiência humana (HIV).
Exame neuropsicológico
A terceira parte da investigação é o exame neuropsicológico. Em muitos casos, um exame neuropsicológico ajuda a avaliar o padrão e a extensão dos deficits.[56]
Memória
Deficits significativos de memória de curto prazo (por exemplo, problemas para lembrar uma lista de palavras ou reconstruir uma figura bidimensional a partir da memória) são observados durante o exame neuropsicológico na DA. A memória episódica também é afetada na encefalopatia límbica e na encefalopatia de Wernicke-Korsakoff.
O início agudo de deficits de memória episódica, que perduram em média 4 a 6 horas, na ausência de outros sintomas neurológicos, ou amnésia retrógrada se estendendo até semanas e meses anteriores, podem estar presentes na amnésia global transitória.
Perda de memória episódica pode estar presente juntamente com lesão hipóxica secundária à parada cardíaca. É mais grave após o ataque, e geralmente melhora rapidamente em alguns dias. Também pode haver comprometimento crônico da memória de trabalho e memória episódica.
Infartos talâmicos prévios podem resultar em comprometimento da memória episódica.
A memória semântica é especialmente afetada na demência semântica, enquanto a memória episódica é geralmente preservada até estágios mais avançados da doença.
O padrão frontal de perda de memória com comprometimento da recuperação, mas com a codificação intacta, é comumente observado na demência vascular, na demência frontotemporal, em outras demências frontais (por exemplo, PSP), assim como no envelhecimento normal.
A demência frontal-subcortical (por exemplo, esquecimento; bradifrenia; alterações emocionais e de personalidade como apatia, depressão e irritabilidade; incapacidade de manipular conhecimentos adquiridos) ocorre na demência frontotemporal, na PSP e na degeneração corticobasal. Deficits em recordações espontâneas com reconhecimento preservado também são observados no exame de memória. Também foi constatado que pacientes com degeneração corticobasal apresentam problemas com as memórias episódica, semântica e de trabalho.
A confabulação (falsas memórias) frequentemente é observada na síndrome de Wernicke-Korsakoff.
Pacientes com epilepsia do lobo temporal podem sofrer de deficits crônicos de codificação, armazenamento e recuperação de novas informações, em associação com a perda de memória durante a convulsão.
Executivo
Deficits executivos frontais (por exemplo, baixa concentração, desorganização, problemas com tarefas múltiplas) podem ocorrer em demência vascular, demências frontotemporais, demência associada ao HIV, hidrocefalia de pressão normal e lesão hipóxica após parada cardíaca.
Certos infartos talâmicos podem resultar em disfunção executiva.
Visuoespacial
Deficits visuoespaciais são comuns em muitos diagnósticos diferenciais, incluindo DA, demência com corpos de Lewy, DCJ e AVCs.
A acalculia (incapacidade de realizar operações matemáticas simples) pode ocorrer na DA, síndrome corticobasal ou DCJ.
Uma típica bateria de exames neuropsicológicos rápidos à beira do leito pode incluir o seguinte:[57]
Miniexame do Estado Mental (MEEM)
É uma medida rápida que testa seis áreas da função cognitiva: funções de orientação, registro, atenção, recuperação, linguagem e visuoespacial. A pontuação máxima é 30. Alguns consideram uma pontuação menor que 24 como um indicador de demência.
Embora seja uma ferramenta eficaz de rastreamento, depende fortemente da resposta verbal, leitura e escrita, e não avalia bem a função executiva.
Quando usada em série ao longo do tempo, a MEEM é capaz de medir alterações no status cognitivo.
Pacientes com comprometimento auditivo ou visual ou com baixa alfabetização no idioma de aplicação podem sair-se mal mesmo quando intactos cognitivamente.
Também há uma forma curta do MEEM (Miniexame do Estado Mental Padronizado - "S"MEEM) que consiste nos seis itens de memória do MEEM (recuperação imediata de três palavras e recuperação tardia de três palavras). O intervalo de pontuação é de 0 a 6, com 6 sendo o melhor desempenho e a pontuação limite para demência sendo menor que 4. Um estudo mostrou que o SMEEM tem a mesma sensibilidade e especificidade mais alta que o MEEM para rastreamento de demência dentre os residentes adultos de idade mais avançada na comunidade. Outro estudo mostrou que o SMEEM é um bom teste de rastreamento para acompanhamento de indivíduos idosos em uma clínica de memória.[58][59]
Avaliação cognitiva de Montreal (MoCA)
Semelhante ao MEEM, este é um teste de 30 pontos e, como o MEEM, avalia orientação, atenção (registro [não contabilizado], detecção de alvo usando toque), memória verbal de curto prazo, habilidades visuoespaciais (desenho de relógio; cópia de um cubo tridimensional), e linguagem (uma nomeação de comparação de três itens, repetição de duas frases complexas e tarefa de fluência fonêmica).
Diferentemente do MEEM, permite avaliar adicionalmente as funções executivas (tarefa de alternância adaptada do teste de trilhas B, tarefa de fluência fonêmica e abstração verbal de dois itens) e memória de trabalho (detecção de alvo usando toque, tarefa de subtração em série e dígitos de ordem direta e ordem inversa).[60]
Uma pontuação igual ou superior a 26 ou acima geralmente é considerada normal. Montreal Cognitive Test Opens in new window
Ainda que poucas, as outras vantagens significativas deste teste em relação ao MEEM são que ele está disponível e validado em centenas de idiomas e é um teste não proprietário. O teste leva ≤10 minutos para ser concluído.
Escore de teste mental abreviado (AMTS)
Consiste em 10 questões e cada questão corretamente respondida vale um ponto. A revisão sistemática e a metanálise de dois estudos do Reino Unido e um estudo da Itália, usando o AMTS como um instrumento de rastreamento de demência em pacientes hospitalizados com mais de 60 anos de idade, revelaram que o AMTS tem uma sensibilidade de 81% e uma especificidade de 84%, com valor de corte de <7 no diagnóstico da demência.[61] O teste leva ≤10 minutos para ser concluído.
Mini-Cog
Um teste simples que inclui memorização de três palavras e desenho de relógio. Um escore de memorização equivalente a 0, ou um escore de memorização de 1 a 2 associado ao desenho de relógio anormal, são considerados positivos para comprometimento cognitivo. O teste leva ≤5 minutos para ser concluído.
Addenbrooke's Cognitive Examination-Revised (ACE-R)
Uma breve bateria que examina a orientação, atenção, memória, fluência verbal, linguagem e habilidade visuoespacial. O escore total soma 100 pontos, com um escore de corte de 82 (sensibilidade de 84% e especificidade de 100% para demência). O teste leva ≤20 minutos para ser concluído.
Outros exames de rastreamento curtos e multidomínio[48] [ Rastreamento do comprometimento cognitivo com 6 perguntas Opens in new window ]
rastreador cognitivo de 10 pontos
Teste de comprometimento cognitivo de seis itens (6CIT)
Rastreador de seis itens
Rastreamento de comprometimento da memória (MIS)
Teste sua memória (TYM).
Escala internacional de demência associada ao HIV (IHDS)
Pode ser usado para o rastreamento rápido de pacientes com suspeita de demência por HIV. A IHDS consiste em três subtestes: percussão digital ("finger tapping") cronometrado, teste de sequência manual alternada cronometrado e evocação de quatro itens em 2 minutos. Um escore ≤10 é uma indicação para avaliação neuropsicológica adicional.[62]
Uma revisão Cochrane do MEEM para a detecção de demência na comunidade e nas populações de atenção primária concluiu que o MEEM contribui para um diagnóstico de demência, mas não deve ser usado isoladamente para confirmar ou descartar a doença.[63] Anos de estudo indicam taxas maiores de resultado falso-negativo para o diagnóstico de demência usando o MEEM, enquanto a residência em instituição asilar indica taxas maiores de resultado falso-positivo.[64]
Uma revisão sistemática e metanálise de 149 estudos de testes cognitivos para a detecção de demência revelou que os testes Mini-Cog e ACE-R foram comparáveis ao MEEM na detecção de demência, enquanto a MoCA foi comparável ao MEEM na detecção de comprometimento cognitivo leve.[65] No entanto, uma revisão Cochrane constatou que não há evidências suficientes para recomendar o Mini-Cog como uma ferramenta de triagem para demência nas unidades básicas de saúde.[66]
Teste de Aprendizado Verbal Califórnia (CVLT) ou Teste de Aprendizado Verbal de Hopkins (HVLT)
O CVLT e o HVLT avaliam as capacidades da memória verbal. Resumidamente, o profissional que aplica o teste lê em voz alta uma lista de palavras comuns (9, 12 ou 16), cada uma das quais pertencente a uma de três ou quatro categorias (por exemplo, frutas, roupas, ferramentas). Isso é repetido de três a cinco vezes. Após a lista ser lida pelo examinador, cada vez é solicitado ao sujeito para repetir quantos itens forem possíveis. Após uma curta espera, (~30 segundos), é solicitado novamente ao sujeito que se lembre da lista de palavras (em versões mais desafiadoras, o examinador pode fornecer uma segunda lista e verificar se o sujeito é capaz de manter os itens de cada lista separados, ou se as duas listas são confundidas). Por fim, há uma longa espera (10 a 20 minutos), durante a qual o sujeito recebe outras tarefas a serem realizadas, e então é solicitado ao sujeito que se recorde da (primeira) lista de palavras espontaneamente, em seguida com dicas, e então uma tarefa de reconhecimento sim/não.
Esse teste mede a memória verbal episódica de curto prazo, se o sujeito está ou não fazendo uso da informação de categoria (função executiva), e se recebe ajuda para a recuperação (por exemplo, dicas ou reconhecimento), as quais são tarefas do lobo frontal.
Os testes de recordação livre imediata podem ser úteis para predizer a progressão de pacientes com queixas sobre memória em relação à doença de Alzheimer com o passar dos anos, apesar de alguns tipos de testes de memória terem melhor valor preditivo que outros.[67]
Teste mini ou modificado de nomeação de Boston (TNB)
O TNB é um teste de confrontação visual com 60 itens (teste de vocabulário para nomear figuras) e mede o desempenho da recuperação de palavras. Os 60 itens consistem em palavras de alta frequência e baixa frequência. Pacientes com disnomia geralmente apresentam maiores dificuldades com a nomeação de objetos de baixa frequência.
Teste visuoespacial (por exemplo, desenho de relógio e cubo; ambos no teste MoCA)
A memória visuoespacial pode ser testada pedindo-se ao sujeito que copie um cubo (como no teste MoCA) ou que reproduza um desenho de linhas mais complexas, como a figura de Rey-Osterreith, ou a versão simplificada, a figura de Benson, primeiro copiando e então desenhando de memória alguns minutos depois.
Teste de memória visual (recordação de uma figura desenhada anteriormente)
Outra tarefa simples de memória para pacientes que estão comprometidos demais para o CVLT, HVLT ou memória de figura complexa é esconder três notas pelo quarto. Alguns minutos mais tarde, você pergunta o que foi escondido (memória verbal) e onde (memória visual).
Os testes de função executiva incluem:
Fluência verbal (fluência semântica e fonêmica ou léxica) - número de palavras que comecem com determinada(s) letra(s) em um minuto e número de animais ou alimentos em um minuto.
Teste de fluência de desenhos (fazer um desenho diferente conectando pontos com linhas retas).
Teste de trilhas parte B (desenhar linhas alternando entre números e letras em ordem crescente).
Teste de stroop. O teste de stroop aproveita nossa capacidade de ler palavras mais rapidamente e automaticamente que a nossa capacidade de dar nome às cores. Quando uma palavra é escrita ou exposta em uma cor diferente da cor à qual dá nome, o sujeito deve responder qual a cor da tinta, e inibir (desconsiderar) a palavra que lê (por exemplo, a palavra 'verde' escrita em cor azul deve ser lida como 'azul'). O mecanismo cognitivo envolvido nessa tarefa é chamado "atenção direta" e requer o manejo a atenção, inibindo uma resposta inata com a fim de dizer ou fazer outra coisa. Mensura a vitalidade mental (de atenção) e a flexibilidade mental.
Cálculos simples. Cálculos podem ser comprometidos por dificuldades executivas (transferência não adequada). Os cálculos podem ser testados pela realização de adições de um e/ou dois dígitos, subtrações, divisões e multiplicações simples. O examinador pode começar com uma tarefa difícil de multiplicação, como 214 x 35; se o sujeito responder corretamente, o examinador pode pular os cálculos simples.
Neuroimagem
O próximo passo na investigação de diagnóstico é o exame por neuroimagem. Recomenda-se um estudo de imagem estrutural para investigação de demência, que também deve ser realizado em um paciente com perda de memória.[48][68]
O estudo mais adequado para qualquer paciente com perda de memória é a ressonância nuclear magnética (RNM) cranioencefálica. RNM com T2, imagem ponderada por difusão e sequência de gradiente eco são métodos preferidos em relação à tomografia computadorizada (TC). RNMs são preferíveis porque têm melhor resolução, melhor diferenciação dos limites entre as substâncias cinza e branca e melhores sequências para identificação de doença vascular.
A neuroimagem serve para distinguir uma doença neurodegenerativa de outros processos, como lesões vasculares, lesões de massa, etiologias infecciosas e processos inflamatórios. Uma RNM cranioencefálica deve ser realizada em todos os pacientes com perda de memória, possivelmente mesmo se que eles apresentem todos os critérios clínicos para doença de Alzheimer, para:
Descarte outras causas possíveis de demência, particularmente as reversíveis, como lesões estruturais
Avalie a presença de uma patologia comórbida
Obtenha uma imagem inicial antes que a perda de memória evolua.
A imagem de recuperação de inversão atenuada por fluidos de cortes finos coronais através dos lobos temporais pode ajudar na detecção de esclerose hipocampal e precoces. [Figure caption and citation for the preceding image starts]: RNM cranioencefálica: mostra atrofia cortical difusa, com atrofia hipocampal predominante (setas vermelhas), em paciente com demência de Alzheimer. Atrofia parietal e envolvimento neocortical evidentes na doença mais avançada (setas azuis)Do acervo pessoal do Dr. Geschwind, MD, PhD; usado com permissão [Citation ends].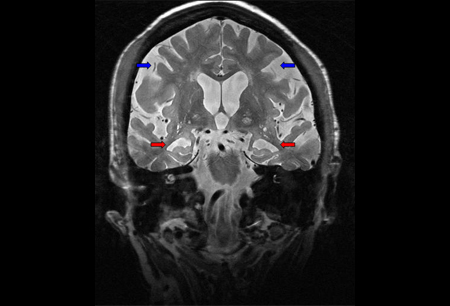 A imagem estrutural tipicamente mostra um padrão de atrofia correspondente aos deficits clínicos do paciente. Frequentemente os pacientes com perda de memória apresentam achados na RNM envolvendo os lobos temporais mediais (hipocampo). Em um paciente com perda de memória podem ser encontradas lesões em outras regiões do circuito de Papez, incluindo o tálamo anterior e os corpos mamilares.
A imagem estrutural tipicamente mostra um padrão de atrofia correspondente aos deficits clínicos do paciente. Frequentemente os pacientes com perda de memória apresentam achados na RNM envolvendo os lobos temporais mediais (hipocampo). Em um paciente com perda de memória podem ser encontradas lesões em outras regiões do circuito de Papez, incluindo o tálamo anterior e os corpos mamilares.
TC e angiografia por RM são indicadas quando há suspeita de AVC isquêmico ou vasculite como causas para a perda de memória. A angiografia por RM pode ter obtida ao mesmo tempo que a RNM.[29] TCs de crânio mostram melhor os sangramentos.[69] Embora a RNM seja mais sensível que a TC para infartos agudos, a TC costuma ser obtida primeiro para avaliar a presença de hemorragia ou infarto de grande porte. Isso permite que o médico responsável pelo tratamento tome decisões rápidas sobre a trombólise.[29] A TC de crânio sem contraste é a investigação de primeira escolha para lesão cerebral traumática, quando é necessário um exame de imagem.[70]
No Reino Unido, o National Institute for Health and Care Excellence (NICE) orienta a TC como investigação de primeira escolha para detectar lesões cerebrais agudas clinicamente importantes. A TC de crânio deve ser realizada em até 1 hora após a lesão para pacientes com idade a partir dos 16 anos que apresentarem qualquer um dos seguintes fatores de risco:[71]
Escala de coma de Glasgow ≤12 à avaliação inicial no pronto-socorro
Escala de coma de Glasgow <15 em 2 horas após a lesão na avaliação no pronto-socorro
Suspeita de fratura craniana aberta ou com afundamento
Qualquer sinal de fratura da base do crânio (hemotímpano, "olhos de panda", vazamento de líquido cefalorraquidiano pelo ouvido ou nariz, sinal de Battle)
Convulsão pós-traumática
Deficit neurológico focal
Mais de um episódio de vômito.
O NICE também recomenda que as pessoas com idade igual ou superior a 16 anos que tiverem tido alguma perda de consciência ou amnésia desde a lesão devem ser submetidas a uma TC de crânio em até 8 horas após um traumatismo cranioencefálico, ou dentro de uma hora em alguém que se apresentar mais de 8 horas após a lesão se tiver algum destes fatores de risco:[71]
Idade igual ou superior aos 65 anos
Qualquer sangramento ou distúrbio da coagulação presente
Mecanismo perigoso de lesão (um pedestre ou ciclista atropelado por um veículo automotor, um ocupante ejetado de um veículo automotor ou uma queda de uma altura superior a 1 metro ou 5 degraus)
Mais de 30 minutos de amnésia retrógrada dos eventos imediatamente anteriores ao traumatismo cranioencefálico.
Exames de imagem funcional com tomografia por emissão de pósitrons (PET) com fluordesoxiglicose (FDG) e TC/tomografia computadorizada por emissão de fóton único (TC-SPECT) podem ser usados para diferenciar DA de demência frontotemporal. A demência frontotemporal apresenta hipometabolismo frontal, enquanto a DA apresenta mais hipoperfusão temporoparietal posterior.[48][68] No caso da variante frontal da DA, no entanto, ela pode não ser útil. Um estudo em que se compara coortes de pacientes com provável DA versus pacientes com provável demência com corpos de Lewy descobriu que, em média, os pacientes com demência com corpos de Lewy apresentaram mais hipoperfusão occipital à SPECT de perfusão e menor dimensão do putâmen à RNM volumétrica do que a coorte com DA.[72] Como nenhum desses casos foi de patologia confirmada, testado quanto a imagens amiloides ou apresentou biomarcadores de líquido cefalorraquidiano (LCR) para diagnóstico de DA, ainda não está claro se essas técnicas são, em certo grau, melhores que o diagnóstico clínico padrão.
Investigações laboratoriais
Investigações iniciais
A probabilidade de identificar uma causa reversível de demência é estimada em cerca de 9%.[3] Em geral, exames laboratoriais iniciais que devem ser solicitados a todos os pacientes para identificar causas potencialmente reversíveis da perda de memória incluem:
Eletrólitos séricos (incluindo cálcio, magnésio e fósforo)
Função renal/ureia
testes da função tireoidiana
Vitamina B12 sérica
Hemograma completo
Velocidade de hemossedimentação/proteína C-reativa
Os níveis de tiamina também são adequados. Quando houver suspeita de demência vascular, um perfil lipídico e a medição da glicemia de jejum ou hemoglobina A1c (HbA1c) são importantes para tratamento de fatores de risco. O papel da deficiência de 25-hidroxivitamina D no comprometimento cognitivo é controverso; embora níveis mais baixos sejam associados à demência, a causalidade ainda não foi determinada.[73][74][75] Portanto, medir a vitamina D sérica ainda não é recomendado como parte de uma investigação padrão, atualmente.
Investigações das causas infecciosas
Embora o teste de reagina plasmática rápida para sífilis não seja recomendado rotineiramente, deve ser realizado caso o paciente apresente um fator de risco específico ou caso haja outras características clínicas de neurossífilis.[68] Muitos médicos solicitam este teste, pois a sífilis é uma forma reversível de demência que geralmente não é diagnosticada. Isso pode ser particularmente importante em regiões com prevalência mais alta de sífilis.
A sorologia para HIV também deve ser solicitada a qualquer paciente que apresente fatores de risco ou suspeita de etiologia infecciosa para sua demência.
Investigações das causas inflamatórias
Se uma encefalopatia límbica estiver presente, o soro (e, às vezes, o LCR) deve ser testado para anticorpos paraneoplásicos e não paraneoplásicos (por exemplo, anti-Hu, Ma2, CV2, anticorpos associados ao canal de potássio voltagem-dependente, receptor N-metil-D-aspartato [RNMDA], anticorpos antitireoglobulina [anti-Tg], antitireoperoxidase [anti-TPO] e muitos outros anticorpos).
Ao realizar testes para encefalopatia límbica mediada por anticorpos, incluindo doença paraneoplásica, por várias razões, recomenda-se enviar painéis completos. Muitos pacientes têm mais de um anticorpo. Alguns anticorpos são associados a determinadas síndromes e alguns anticorpos são associados a determinados cânceres.[34][76][77]
Teste genético
Testes genéticos são indicados quando houver dúvida sobre formas hereditárias de demência. Geralmente, essa é uma consideração no início precoce de DA, demência frontotemporal e doença de Creutzfeldt-Jakob. Pacientes que apresentam o genótipo da apolipoproteína E4 (Apo-E4) são mais suscetíveis a desenvolverem demência, mas tipicamente ela se apresenta em idade mais avançada. Atualmente, as diretrizes do Reino Unido não recomendam o uso de genotipagem da apolipoproteína E para diagnosticar DA.[48] Pacientes com mutações nos genes da presenilina-1, da presenilina-2 e da proteína precursora de amiloide tendem a apresentar início precoce da DA.
Algumas mutações genéticas associadas à demência frontotemporal incluem progranulina, proteína tau associada aos microtúbulos e o gene C9ORF72.[78] A expansão da repetição do hexanucleotídeo C9ORF72 (>30 repetições) é a mutação mais comum identificada em pacientes com demência frontotemporal e tem sido mais comumente observada em pacientes oriundos da Europa e dos EUA, mas raramente naqueles provenientes da Ásia. Clinicamente, a sua manifestação mais comum é a variante comportamental da demência frontotemporal, seguida por afasia progressiva primária. Essa mutação também foi identificada em pacientes diagnosticados com DA, síndromes semelhantes a doença de Huntington e doença de Parkinson. A extensão dessa mutação ainda está para ser determinada.[79][80] Um estudo em um centro de encaminhamento de demência frontotemporal descobriu que 12% dos pacientes apresentaram mutação no gene C9ORF72. É muito mais provável que portadores da mutação tenham história familiar de esclerose lateral amiotrófica ou doença psiquiátrica (alucinações e delírios). Os portadores também apresentam menor progressão e atrofia cerebral menos proeminente que aqueles sem a mutação.[81] O mecanismo patológico da neurodegeneração induzida pela mutação da repetição do gene C9ORF72 deve-se, aparentemente, a agregados de ácido ribonucleico (RNA) e é uma área intensa da pesquisa sendo feita atualmente.[78][82][83][84][85]
Sempre que o teste genético for realizado, o aconselhamento genético é essencial. As diretrizes para a realização de teste genético na doença de Huntington (DH) e outras demências neurodegenerativas autossômicas dominantes estão sendo continuamente reescritas com base em novas tecnologias, mas baseiam-se nas diretrizes originais da DH, as quais são geralmente referidas como o Protocolo de Huntington.[86]
Exames de urina
Se houver suspeita clínica de infecção do trato urinário, envie uma amostra de urina de jato médio para microscopia e cultura.[48] As infecções do trato urinário podem desencadear delirium, que se manifesta como declínio cognitivo súbito.
Investigações do líquido cefalorraquidiano (LCR)
Deve-se realizar estudos sobre fator estimulante de colônias (CSF) em apresentações atípicas de demência, em que haja considerações de causa infecciosa, autoimune, inflamatória, neoplásica ou de doença de Creutzfeldt-Jakob.
Os níveis de tau no LCR estão elevados e os níveis de beta amiloide 1-42 (Abeta42) estão diminuídos na DA. O exame do LCR para peptídeos beta-amiloides 42, tau total e proporções de tau fosforilada tem sensibilidade e especificidade na média de intervalo percentual de 85. Esses exames com biomarcador parecem ter melhor sensibilidade do que especificidade e podem ser mais úteis para descartar a doença de Alzheimer como etiologia para o comprometimento cognitivo do indivíduo, em vez de confirmá-la.[87]
Quando a hidrocefalia de pressão normal for considerada, um grande volume de punção lombar (ao menos 30 mL) ou uma drenagem de LCR prolongada podem ser realizados para avaliar se os sintomas, especialmente a marcha, melhoram após a punção lombar.[88][89]
Se houver encefalopatia límbica, o LCR pode ser enviado para anticorpos paraneoplásicos e não paraneoplásicos.
Outras investigações
O eletroencefalograma é essencial para descartar convulsões subclínicas quando convulsões forem sugeridas pelo quadro clínico. Nesses casos, os pacientes podem apresentar outros sintomas em associação com a perda de memória, como estado catatônico, interrupção súbita da fala ou tremor sutil na face, lábios ou olhos. Para declínios mais agudos no estado mental sem outra explicação, deve-se considerar o estado de mal epiléptico não convulsivo, no qual não há manifestações motoras de convulsões.[31]
Cognitive impairment: recognition, diagnosis and management in primary care Opens in new window
O uso deste conteúdo está sujeito ao nosso aviso legal