Recomendaciones
Urgente
"El tiempo perdido es tejido cerebral perdido" : la hemorragia intracerebral espontánea (HIC) es una emergencia.
El manejo temprano agresivo del PCI es crucial. El deterioro temprano es común en las primeras horas después del inicio de los síntomas.[23]
Maneje cualquier insuficiencia de las vías respiratorias, la respiración y la circulación que requiera una intervención urgente. En particular:
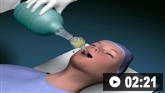
Considere la posibilidad de realizar una intubación endotraqueal.[68]
Administre oxigenoterapia solo si la saturación de oxígeno cae por debajo del 93%.[69] Aunque el Instituto Nacional para la Excelencia en Salud y Atención (NICE) en el Reino Unido recomienda comenzar con la terapia de oxígeno solo si la saturación de oxígeno cae por debajo del 95%, la evidencia más reciente sugiere que en pacientes con accidente cerebrovascular no hay beneficios al iniciar la oxigenoterapia cuando la SpO₂ es ≥93% y puede causar daños.[69]
Monitorice la oxigenoterapia controlada. Un límite superior de SpO₂ del 96% es razonable cuando se administra oxigenoterapia a la mayoría de los pacientes con enfermedades agudas que no presentan riesgo de hipercapnia.
Un objetivo más bajo del 88% al 92% es adecuado si el paciente se encuentra en riesgo de insuficiencia respiratoria hipercápnica.[70]
No administre oxígeno de forma rutinaria a personas que no son hipóxicas.[69]
Ingrese a cualquier persona con sospecha de accidente cerebrovascular directamente a una unidad de accidente cerebrovascular hiperagudo o agudo (según disponibilidad) lo antes posible; las guías de práctica clínica del Reino Unido recomiendan realizar esto dentro de las 4 horas posteriores a la presentación en el hospital.[55]
Organice una revisión inmediata por parte de un neurocirujano para evaluar si el paciente se beneficiará o no de la neurocirugía.[23][30][71]
Ofrezca una reducción rápida de la presión arterial (PA) a pacientes con HIC aguda que presentan una PA sistólica de 150 a 220 mmHg Y:[55]
Está presente dentro de las 6 horas posteriores al inicio de los síntomas
No presentan: una causa estructural subyacente (p. ej., tumor, malformación arteriovenosa o aneurisma); una puntuación de la escala de coma de Glasgow <6; un hematoma masivo con mal pronóstico esperado [ Escala de Coma de Glasgow Opens in new window ]
No se van a someter a una neurocirugía precoz para evacuar el hematoma.
Siga sus protocolos locales para la disminución urgente de la presión arterial en estos pacientes.[30] Trate de lograr una presión arterial sistólica de 130-139 mmHg en una hora, que se mantendrá durante al menos 7 días.[30]
Considere la reducción rápida de la PA para pacientes con HIC aguda que presentan una PA sistólica de >220 mmHg O presente más allá de las 6 horas del inicio de los síntomas Y:[55]
No tienen: una causa estructural subyacente (p. ej., tumor, malformación arteriovenosa o aneurisma); una puntuación en la escala de coma de Glasgow <6; un hematoma masivo con mal pronóstico esperado
No se van a someter a una neurocirugía precoz para evacuar el hematoma.
Establezca un objetivo de PA sistólica de 130 a 140 mmHg dentro de 1 hora de iniciar el tratamiento y mantenga esta PA durante al menos 7 días.[55]
Revierta el tratamiento anticoagulante de forma urgente.[30][72] Restablezca los niveles de coagulación a la normalidad lo antes posible en personas que estaban tomando:
Warfarina (y tienen un relación normalizada internacional (INR) elevada) u otro antagonista de la vitamina K: administre una combinación de concentrado de complejo de protrombina (factor 4) y vitamina K intravenosa.[30][55]
Dabigatrán: revertir con idarucizumab. Si no se dispone de idarucizumab, se puede considerar el concentrado de complejo de protrombina (factor 4).[30]
Tratamiento con inhibidores del factor Xa: administre concentrado de complejo de protrombina (4 factores). El factor de coagulación Xa recombinante (andexanet alfa) puede considerarse en el contexto de un ensayo controlado aleatorizado.[30]
Principales recomendaciones
Se debe ingresar a los pacientes con hemorragia intracerebral directamente en una unidad de accidente cerebrovascular hiperagudo para una evaluación especializada urgente y un seguimiento del nivel consciente, y remitidos inmediatamente para repetir los estudios por imágenes cerebrales si se produce un deterioro.[30]
Evalúe el nivel de conciencia del paciente mediante la escala de coma de Glasgow. [ Escala de Coma de Glasgow Opens in new window ]
Continúe monitorizando estrechamente la conciencia una vez que el paciente esté en la unidad de accidente cerebrovascular hiperagudo o agudo.[30]
Monitorice la glucemia regularmente. Mantenga una concentración de glucosa en sangre entre 4 y 11 mmol/L en personas con accidente cerebrovascular agudo.[55] Administre un tratamiento con insulina óptima con insulina intravenosa y glucosa a todos los adultos con diabetes tipo 1 con amenaza de accidente cerebrovascular real o amenazado. Siga los protocolos locales.[55]
Considere la posibilidad de monitorizar al paciente para detectar signos de presión intracraneal elevada si se presenta alguno de los siguientes:[23]
Puntuación de la escala de coma de Glasgow ≤8 que se presume relacionada con el efecto de masa del hematoma [ Escala de Coma de Glasgow Opens in new window ]
Evidencia clínica de hernia transtentorial
Hemorragia intraventricular significativa o hidrocefalia.
Derive a cualquier paciente que desarrolle hidrocefalia a un neurocirujano. El neurocirujano considerará la intervención quirúrgica (p. ej., la inserción de un drenaje ventricular externo).[30][55]
Consulte inmediatamente con un neurólogo si el paciente presenta convulsiones no controladas o recurrentes, o estado epiléptico. Se deben seguir los protocolos locales. Véase Estado epiléptico.
No inicie tratamiento con estatinas en pacientes con HIC primaria a menos que sea necesario para otras indicaciones.
Garantice la intervención y el tratamiento urgentes de especialistas para reducir el sangrado, ya que los pacientes con HIC pueden deteriorarse rápidamente.[30]
La reversión de la anticoagulación, la disminución intensiva de la presión arterial, la neurocirugía y el acceso a cuidados intensivos podrían ser beneficiosos en la HIC aguda, pero actualmente faltan evidencias de alta calidad para estas intervenciones.[71]
Estabilización
Maneje cualquier insuficiencia de las vías respiratorias, la respiración y la circulación que requiera tratamiento urgente. En particular:
Considere la intubación endotraqueal para los pacientes que no pueden proteger sus vías respiratorias o aquellos que presentan un nivel de conciencia deprimido (puntuación de la escala de coma de Glasgow ≤8 [ Escala de Coma de Glasgow Opens in new window ] ).[68] Esto se debe realizar por un anestesista o personal capacitado del servicio de urgencias.
Administre oxigenoterapia solo si la saturación de oxígeno cae por debajo del 93%.[69] Aunque el Instituto Nacional para la Excelencia en Salud y Atención (NICE) en el Reino Unido recomienda comenzar la terapia con oxígeno solo si la saturación de oxígeno cae por debajo del 95%, la evidencia más reciente sugiere que en pacientes con accidente cerebrovascular no hay beneficios al iniciar la oxigenoterapia cuando la SpO2 es ≥93% y puede causar daños.[69]
Monitorice la oxigenoterapia controlada. Es razonable un límite superior de SpO2 del 96% cuando se administra oxigenoterapia a la mayoría de los pacientes con enfermedad aguda que no presentan riesgo de hipercapnia.
La evidencia indica que el uso liberal de oxigenoterapia (objetivo SpO2 >96%) en adultos gravemente enfermos se asocia con una mayor mortalidad que la oxigenoterapia más conservadora.[73]
Un objetivo más bajo de SpO2 del 88% al 92% es adecuado si el paciente está en riesgo de insuficiencia respiratoria hipercápnica.[70]
No administre oxígeno de forma rutinaria a personas que no son hipóxicas.[69]
Evidencia: saturación de oxígeno objetivo en adultos gravemente enfermos
Demasiado oxigenoterapia aumenta la mortalidad.
La evidencia de una revisión sistemática relevante y un metanálisis respalda el uso de una oxigenoterapia conservadora/controlada versus la terapia liberal de oxígeno en adultos gravemente enfermos que no presentan riesgo de hipercapnia.
Las guías de práctica clínica difieren en sus recomendaciones sobre la saturación de oxígeno objetivo en adultos gravemente enfermos que reciben oxigenoterapia.
La guía de la Sociedad Torácica Británica (BTS) del 2017 recomienda un rango objetivo de SpO2 del 94% al 98% para pacientes que no tienen riesgo de hipercapnia, mientras que la guía de la Sociedad Torácica de Australia y Nueva Zelanda (TSANZ) de 2022 recomienda del 92% al 96%.[70][74]
Las guías de práctica clínica de la Iniciativa Global para el Asma (GINA) recomiendan un rango objetivo de SpO2 del 93% al 96% en el contexto de una exacerbación grave del asma.[75]
Una revisión sistemática que incluye un metanálisis de datos de 25 ensayos controlados aleatorizados (ECA), publicada en 2018, encontró que en adultos con enfermedad aguda, la oxigenoterapia liberal (ampliamente equivalente a una saturación objetivo >96%) se asocia con una mayor mortalidad que la oxigenoterapia conservadora (ampliamente equivalente a una saturación objetivo ≤96%).[73]
La mortalidad hospitalaria fue 11 por 1000 más alta para el grupo de oxigenoterapia liberal versus el grupo de terapia conservadora (IC del 95%: 2 a 22 por 1000 más).
La mortalidad a los 30 días también fue mayor en el grupo que había recibido terapia liberal de oxígeno (CR 1.14; IC del 95%: 1.01 a 1.29).
Los ensayos incluyeron adultos con sepsis, enfermedad crítica, accidente cerebrovascular, traumatismo, infarto de miocardio y paro cardíaco, y pacientes sometidos a cirugía de emergencia. Se excluyeron de la revisión los estudios que se limitaron a pacientes con enfermedades respiratorias crónicas o psiquiátricas, y pacientes con soporte vital extracorpóreo, que recibieron oxigenoterapia hiperbárica o sometidos a cirugía electiva.
Por lo tanto, un límite superior de SpO2 del 96% es razonable cuando se administra oxigenoterapia a pacientes médicos con enfermedades agudas que no presentan riesgo de hipercapnia. Sin embargo, un objetivo más elevado puede ser adecuado para algunas afecciones específicas (p. ej., neumotórax, intoxicación por monóxido de carbono, cefalea en racimos y crisis de células falciformes).[69]
En 2019, el BTS revisó su guía en respuesta a esta revisión sistemática y metanálisis y decidió que no se requería una actualización provisional.[70]
El comité señaló que la revisión sistemática respaldaba el uso de oxigenoterapia controlada para un objetivo.
Si bien la revisión sistemática mostró una asociación entre mayores saturaciones de oxígeno y mayor mortalidad, el comité de BTS consideró que la revisión no era definitiva sobre cuál debería ser el rango objetivo óptimo. El rango sugerido de 94 a 96% en la revisión se basó en el intervalo de confianza más bajo del 95% y la mediana de SpO2 inicial de los grupos de oxígeno liberal, junto con la recomendación de la guía TSANZ.
Posteriormente, la experiencia durante la pandemia de COVID-19 también ha favorecido que los médicos sean más conscientes de la viabilidad de la hipoxemia permisiva.[76]
El manejo de la oxigenoterapia en pacientes en unidades de cuidados intensivos es especializado e informado por evidencia adicional (no cubierta en este resumen) que es más específica para este contexto.[77][78][79]
Derive al paciente a la unidad de accidente cerebrovascular hiperagudo o agudo
En el hospital
Ingrese a cualquier persona con sospecha de accidente cerebrovascular directamente a una unidad de accidente cerebrovascular hiperagudo o agudo (según disponibilidad) lo antes posible; las guías de práctica clínica del Reino Unido recomiendan realizar esto dentro de las 4 horas posteriores a la presentación en el hospital.[55] Los pacientes con hemorragia intracerebral deben ser ingresados directamente en una unidad de ictus hiperagudo para una evaluación especializada urgente y un seguimiento del nivel consciente.[30]
Estos pacientes requieren una evaluación y un seguimiento especializados urgentes, ya que su salud puede deteriorarse rápidamente.[30][55]
Si la salud del paciente se deteriora, recomiende inmediatamente para repetir los estudios por imágenes del cerebro.[30][55]
Evidencia: unidades de accidente cerebrovascular hiperagudo
Los pacientes que han sufrido un accidente cerebrovascular presentan más probabilidades de estar vivos, independientes y vivir en casa 1 año después del accidente cerebrovascular si recibieron atención en una unidad de accidente cerebrovascular para pacientes hospitalizados agudos, en comparación con una atención alternativa menos organizada. La atención en una unidad especializada en accidentes cerebrovasculares parece ser el enfoque más efectivo.
La Guía Clínica Royal College of Physicians (RCP) National Clinical Guideline on Stroke del Reino Unido de 2016 (actualizada posteriormente en 2023 a la guía National Clinical Guideline for Stroke para el Reino Unido e Irlanda) citó una revisión de la Cochrane de 2013 realizada por la Stroke Unit Trialists' Collaboration para respaldar su recomendación de ingreso a pacientes con sospecha de accidente cerebrovascular agudo en una unidad de accidentes cerebrovasculares hiperagudos.[30]
Esta revisión de la Cochrane (con fecha de búsqueda enero 2013) evaluó el efecto de la atención organizada en la unidad de accidentes cerebrovasculares en comparación con otras formas alternativas de atención menos organizadas para los pacientes con accidente cerebrovascular agudo.[80]
Incluyó 28 ECA, con un total de 5855 pacientes ingresados en el hospital con accidente cerebrovascular (utilizando una definición clínica de accidente cerebrovascular: déficit neurológico focal debido a enfermedad cerebrovascular, excluyendo la hemorragia subaracnoidea y el hematoma subdural).
Los resultados de la atención organizada en la unidad especializada en accidentes cerebrovasculares versus la atención alternativa (unidades de medicina general o unidades de rehabilitación mixtas) presentaron que los pacientes en las unidades de accidente cerebrovascular presentó un riesgo reducido de "muerte", "muerte o cuidados institucionalizados", y "muerte o dependencia" en el seguimiento final (mediana de 1 año), en el seguimiento a 5 años y en el seguimiento a 10 años.
Estas conclusiones se confirmaron en una versión más reciente (2020) de esta revisión Cochrane que incluyó 29 ECA (n = 5902), nuevos datos de resultados de ensayos recientes y una evaluación adicional mediante metanálisis en red.[80]
[  ]
]
En el entorno comunitario
Organice el ingreso inmediato en urgencias a una unidad especializada en accidentes cerebrovasculares hiperagudos (o agudos, según la disponibilidad) para cualquier persona que presenta:
Síntomas neurológicos persistentes sospechosos de accidente cerebrovascular agudo[30][55]
Se deben excluir los síntomas neurológicos resueltos que tienen un trastorno hemorrágico o están tomando un anticoagulante como hemorragia. Esta es una práctica estándar.[30]
Evaluación inmediata de neurocirugía
Organice una revisión inmediata por parte de un neurocirujano para evaluar si el paciente se beneficiará de la neurocirugía.[23][71]
Esta revisión puede realizarse en el servicio de urgencias o en la unidad especializada en accidentes cerebrovasculares hiperagudos o agudos (según la disponibilidad del neurocirujano). El neurocirujano a menudo hace esto de forma remota en lugar de asistir en persona. Si está en la unidad especializada en accidentes cerebrovasculares, es el equipo de accidentes cerebrovasculares el que se se comunica con el equipo quirúrgico.
Derive a cualquier paciente que desarrolle hidrocefalia a un neurocirujano. El neurocirujano considerará la intervención quirúrgica (p. ej., la inserción de un drenaje ventricular externo).[30][55]
El papel de la cirugía para la mayoría de los pacientes con HIC espontánea sigue siendo controvertido.[23] La neurocirugía para evacuar el hematoma o tratar la hidrocefalia podría mejorar los resultados, pero hay una falta de evidencia clara y sigue siendo incierto a qué pacientes se debe operar.[71]
Según el Instituto Nacional para la Excelencia en Salud y Atención (NICE) del Reino Unido, las personas con cualquiera de las siguientes características clínicas rara vez requieren intervención quirúrgica y deben recibir tratamiento médico inicialmente:[55]
Pequeñas hemorragias profundas
Hemorragia lobular sin hidrocefalia ni deterioro neurológico rápido
Una hemorragia de gran importancia y comorbilidades significativas antes del accidente cerebrovascular
Puntuación de la escala de coma de Glasgow <8 a menos que se deba a hidrocefalia [ Escala de Coma de Glasgow Opens in new window ]
Hemorragia de la fosa posterior.
Considere la reducción rápida de la presión arterial (PA) para pacientes con ICH que tienen una PA sistólica de 150 a 220 mmHg Y:[55]
Está presente dentro de las 6 horas posteriores al inicio de los síntomas
No presentan: una causa estructural subyacente (p. ej., tumor, malformación arteriovenosa o aneurisma); una puntuación de la escala de coma de Glasgow <6; un hematoma masivo con mal pronóstico esperado [ Escala de Coma de Glasgow Opens in new window ]
No se van a someter a una neurocirugía precoz para evacuar el hematoma.
Siga su protocolo local para la disminución urgente de la presión arterial en estos pacientes.[30] La guía de práctica clínica The National Clinical Guideline for Stroke para el Reino Unido e Irlanda recomienda tratar de lograr una PA sistólica de 130-139 mmHg en una hora, que se mantendrá durante al menos 7 días.[30]
La European Stroke Organisation recomienda una reducción de la presión arterial a 140 mmHg (y mantenerla por encima de 110 mmHg) para reducir las expansiones del hematoma en pacientes con HIC hiperaguda (<6 horas). Su consenso de expertos ha concluido que la disminución de la presión arterial sistólica no debe exceder los 90 mmHg de los valores iniciales.[72]
La National Clinical Guideline for Stroke para el Reino Unido e Irlanda señala que existe evidencia limitada de ECA con respecto a la reducción intensiva de la presión arterial en pacientes después de la ICH con presión arterial sistólica inicial superior a 220 mmHg o más allá de las 6 horas desde el inicio y, por lo tanto, no hacen recomendaciones específicas relacionadas con este grupo de pacientes.[30]
Sin embargo, el Instituto Nacional para la Excelencia en Salud y Atención (NICE) en el Reino Unido recomienda que se considere la reducción rápida de la PA caso por caso para los pacientes, teniendo en cuenta el riesgo de daño, con HIC aguda que presentan una PA sistólica de 220 mmHg O presente más allá de las 6 horas del inicio de los síntomas Y:[55]
No presentan: una causa estructural subyacente (p. ej., tumor, malformación arteriovenosa o aneurisma); una puntuación de la escala de coma de Glasgow <6; un hematoma masivo con mal pronóstico esperado
No se van a someter a una neurocirugía precoz para evacuar el hematoma.
Trate de alcanzar un objetivo de PA sistólica de 140 mmHg o menos mientras se asegura de que la caída de magnitud no exceda los 60 mmHg dentro de 1 hora de iniciar el tratamiento.[55]
Evidencia: reducción rápida de la PA
La disminución rápida de la PA en pacientes con hemorragia intracerebral aguda y presión arterial sistólica alta se asocia con un menor riesgo de expansión del hematoma a las 24 horas y una posible mejora de la calidad de vida a los 90 días. No hay un aumento claro de los efectos perjudiciales en la mayoría de los pacientes, aunque se deben evitar los protocolos agresivos debido al riesgo de insuficiencia renal.
En 2022, sobre la base de nuevas evidencias de un análisis de datos agrupados de pacientes individuales (IPD) de los ensayos multicéntricos ATACH-2 y INTERACT2, el Instituto Nacional de Salud y Excelencia Asistencial (NICE) del Reino Unido actualizó sus guías de orientación sobre la eficacia y la seguridad de la reducción de la PA en personas con accidente cerebrovascular hemorrágico agudo.[81]
El NICE incluyó siete ensayos controlados aleatorizados (ECA) (n = 5119) en la revisión anterior de 2019 con la mayoría de la evidencia de ATACH-2 (n = 1000) y INTERACT2 (n = 2829). En la actualización de 2022, también incluyeron tres análisis post hoc del estudio ATACH-2 y consideraron por separado el análisis combinado de IPD.[81]
Todos los ensayos compararon el tratamiento intensivo de la PA con el tratamiento estándar de la PA, aunque la PA objetivo varió entre los estudios y la duración del tratamiento varió de 24 horas a 7 días.
La expansión del hematoma se redujo con el tratamiento intensivo (6 ensayos; n = 3417; CR 0.82 [IC del 95%: 0.73 a 0.93]; GRADE moderado).
La calidad de vida a los 90 días fue mejor con el tratamiento intensivo en el ensayo INTERACT2; sin embargo, no hubo diferencias en la calidad de vida en el resultado agrupado (2 ensayos, n = 3030, GRADE moderado).
La disminución intensiva de la PA no afectó los resultados funcionales (escala de Rankin modificada 0-2) a los 90 días (3 ensayos; n = 3832; CR 1.06 [IC del 95%: 0.99 a 1.13]; riesgo absoluto en el grupo control 44 más por 100, riesgo absoluto en el grupo de intervención 47 más por 100 [IC del 95%: 43 menos a 50 más]; evidencia de calidad moderada evaluada por GRADE).
No se observaron diferencias clínicas a los 90 días para la mortalidad (7 ensayos; n = 5099; GRADE alto), accidente cerebrovascular recurrente (3 ensayos; n = 3832; GRADE moderado) o infarto de miocardio (1 ensayo; n = 629; GRADE bajo).
No se observaron diferencias a las 24 horas en el deterioro neurológico (5 ensayos; n = 5065, GRADE bajo) ni en la isquemia cerebral sintomática (1 ensayo; n = 201; GRADE bajo).
Se observó un posible daño clínico para la insuficiencia renal a los 90 días (4 ensayos; n = 1647; CR 2,07 [IC del 95%: 1.08 a 3.99]; GRADO moderado).
En tres de los estudios no hubo diferencias significativas en la insuficiencia renal (aunque los tres tuvieron tasas de eventos bajas e intervalos de confianza amplios).
Sin embargo, el ensayo ATACH-2 utilizó un protocolo más agresivo para reducir la PA y se encontró que esto aumentaba el riesgo de insuficiencia renal (21/500 con tratamiento intensivo vs. 9/500 con tratamiento estándar; CR 2.33 [IC del 95%: 1.08 a 5.04]).
El análisis de IPD mostró que los umbrales objetivo de PA en la recomendación NICE de 2019 pueden ser dañinos, al igual que una reducción muy significativa (>60 mmHg) en la presión arterial dentro de la primera hora.[81][82] Por lo tanto, en 2022, el comité de guías de práctica clínica decidió eliminar el objetivo de alcanzar el objetivo en 1 hora. El comité también señaló que:
Solo un tercio de los participantes en el ensayo de INTERACT2 lograron el objetivo de 140 mmHg en 1 hora.
Una reducción de más de 60 mmHg en 1 hora se asoció con resultados significativamente peores como insuficiencia renal, deterioro neurológico temprano y muerte, en comparación con el tratamiento estándar.
Hay evidencia suficiente para mostrar que la disminución intensiva de la presión arterial sistólica puede ser segura cuando se usan protocolos menos agresivos, aunque no hay evidencia en adultos clínicamente frágiles.
La guía de práctica clínica NICE de 2019 establecía que el tratamiento debe comenzar dentro de las 6 horas y continúe el tratamiento durante 7 días. Sin embargo, este plazo se eliminó de la guía de 2022 debido a la evidencia débil y las preocupaciones sobre el impacto potencial en el flujo de pacientes, el manejo de camas y el uso de recursos.
Hubo evidencia limitada en personas que presentaron más de 6 horas después del inicio de los síntomas y en personas con una PA sistólica superior a 220 mmHg en el momento de la presentación, por lo que NICE hizo una recomendación más débil para estos grupos.
Revierta urgentemente las anomalías de la coagulación, particularmente en pacientes que toman anticoagulantes.[30][72]
Alrededor del 10% al 20% de las HIC agudas ocurren en pacientes que toman anticoagulantes orales, y esta etiología se asocia con un alto riesgo de expansión temprana del hematoma.[71]
Restablezca los niveles de coagulación a la normalidad lo antes posible en personas que estaban tomando:
Warfarina (y presentan un índice internacional normalizado [INR] elevado) u otro antagonista de la vitamina K: administre una combinación de concentrado de complejo de protrombina (factor 4) y vitamina K intravenosa (fitomenadiona)[30][55][72]
Dabigatrán: revertir con idarucizumab.[30][72] Si no se dispone de idarucizumab, se puede considerar el concentrado de complejo de protrombina (factor 4).[30]
Inhibidor del factor Xa: trate con concentrado de complejo de protrombina (factor 4).[30][72] Andexanet alfa puede considerarse en el contexto de un ensayo controlado aleatorizado.[30]
Supervise estrechamente el estado clínico del paciente y brinde atención de apoyo según corresponda.[30] En particular, monitorice:
Nivel de conciencia
Glucemia
Presión arterial
Saturación de oxígeno
Hidratación
Temperatura
Ritmo y frecuencia cardíaca.
Monitorice al paciente para detectar complicaciones, particularmente signos de presión intracraneal elevada y convulsiones.
Remita al paciente inmediatamente para que se repitan los estudios por imágenes cerebrales si la salud del paciente se deteriora.[30][55]
Nivel de conciencia
Evalúe el nivel de conciencia del paciente mediante la escala de coma de Glasgow. [ Escala de Coma de Glasgow Opens in new window ] La monitorización de la conciencia debe continuar una vez que el paciente está en la unidad de accidente cerebrovascular hiperagudo o agudo.[30]
Glucemia
Monitorice la glucemia regularmente. Mantenga una concentración de glucemia entre 4 y 11 mmol/Len personas con accidente cerebrovascular agudo.[55]
Administre un tratamiento con insulina óptima con insulina intravenosa y glucosa a todos los adultos con diabetes tipo 1 con amenaza de accidente cerebrovascular real o amenazado. Siga los protocolos locales.[55]
Evidencia: control gliacémico en el accidente cerebrovascular agudo
Los datos limitados disponibles no muestran un beneficio significativo con un control glucémico estricto en comparación con la atención habitual en pacientes con accidente cerebrovascular hemorrágico que desarrollan hiperglucemia posterior al accidente cerebrovascular, y existe un mayor riesgo de hipoglucemia.[30][55][83]
Hay muy poca evidencia de ECA sobre el control glucémico en pacientes con accidente cerebrovascular hemorrágico. Por lo tanto, los grupos de guías han considerado estudios pragmáticos (donde se incluye en el estudio a todos los pacientes que presentan un accidente cerebrovascular agudo) o grandes estudios prospectivos al hacer sus recomendaciones.
Las pautas varían en sus recomendaciones para el rango objetivo de glucosa en sangre en esta situación.
La guía del Instituto Nacional para la Excelencia en la Salud y la Atención (NICE) del Reino Unido sobre accidentes cerebrovasculares de 2008 recomienda mantener la glucemia entre 4 y 11 mmol / L (esto no se modificó en la actualización de 2022 de esta guía).[55]
Esta recomendación se basa en:
Evidencia del United Kingdom Glucose Insulin in Stroke Trial (GIST-UK), que no encontró apoyo para un control estricto de la glucemia en pacientes con niveles de glucosa en sangre leve o moderadamente elevados después de un accidente cerebrovascular agudo (15% de los participantes tuvieron accidente cerebrovascular hemorrágico)[84]
Consenso del panel de guías sobre el rango de glucosa recomendado.
El panel de pautas acordó por consenso que los pacientes con diabetes preexistente deben continuar siendo tratados de acuerdo con las pautas actuales.
La Guía Clínica Nacional de 2016 publicada por el Royal College of Physicians en el Reino Unido, actualizada en 2023 (National Clinical Guideline for Stroke for the UK and Ireland) recomienda un rango objetivo más amplio de 5 a 15 mmol / L, con un seguimiento estrecho para evitar la hipoglucemia.[30]
Esta guía también cita el ensayo GIST-UK para respaldar esta recomendación.[84]
La recomendación de las guías de práctica clínica de la Organización Europea de Accidentes Cerebrovasculares (ESO) de 2018 viene respaldada por la evidencia de una revisión sistemática.[83]
Esta guía de práctica clínica ha emitido una recomendación débil contra el uso sistemático de insulina intravenosa para lograr un control glucémico estricto como medio para mejorar el resultado funcional, la supervivencia o el tamaño del infarto (evidencia de muy baja calidad evaluada mediante GRADE).[83]
Presión arterial
Monitorice la presión arterial intensamente y siga las recomendaciones de la sección Reducción rápida de la presión arterial, arriba.
Saturación de oxígeno
Administre oxigenoterapia solo si la saturación de oxígeno cae por debajo del 93%.[69] Aunque el Instituto Nacional para la Excelencia en Salud y Atención (NICE) en el Reino Unido recomienda comenzar la terapia con oxígeno solo si la saturación de oxígeno cae por debajo del 95%, la evidencia más reciente sugiere que en pacientes con accidente cerebrovascular no hay beneficios al iniciar la oxigenoterapia cuando la SpO2 es ≥93% y puede causar daños.[69]
Monitorice la oxigenoterapia controlada. Es razonable un límite superior de SpO2 del 96% cuando se administra oxigenoterapia a la mayoría de los pacientes con enfermedad aguda que no presentan riesgo de hipercapnia.
La evidencia indica que el uso liberal de oxigenoterapia (objetivo SpO2 >96%) en adultos gravemente enfermos se asocia con una mayor mortalidad que la oxigenoterapia más conservadora.[73]
Un objetivo más bajo de SpO2 del 88% al 92% es adecuado si el paciente está en riesgo de insuficiencia respiratoria hipercápnica.[70]
No administre oxígeno de forma rutinaria a personas que no son hipóxicas.[69]
Hidratación
Evalúe la hidratación del paciente utilizando múltiples métodos dentro de las 4 horas posteriores a su llegada al hospital. Revise regularmente; maneje según sea necesario para mantener una hidratación normal.[30][55]
Temperatura
Monitorice la temperatura.[30] Los pacientes con accidente cerebrovascular pueden perder su termorregulación de forma aguda y pueden necesitar intervenciones en ausencia de infección.
Administre un antipirético (p. ej. paracetamol) en pacientes con temperatura alta.[85]
Ritmo y frecuencia cardíaca
Utilice su juicio clínico para determinar el método más adecuado para monitorizar el ritmo y la frecuencia cardíaca en función del paciente individual y siga el protocolo de su hospital.
Presión intracraneal
Considere la posibilidad de monitorizar al paciente para detectar signos de presión intracraneal elevada (PIC) y tratamiento si se presenta alguno de los siguientes:[23]
Puntuación de la escala de coma de Glasgow ≤8 que se presume relacionada con el efecto de masa del hematoma
Evidencia clínica de hernia transtentorial
Hemorragia intraventricular significativa o hidrocefalia.
Derive a cualquier paciente que desarrolle hidrocefalia a un neurocirujano. El neurocirujano considerará la intervención quirúrgica (p. ej., la inserción de un drenaje ventricular externo).[30][55]
Las causas comunes de PIC elevada son la hidrocefalia por hemorragia intraventricular o el efecto de masa del hematoma.[23]
La evacuación del hematoma y la hemicraniectomía descompresiva son opciones para tratar la PIC elevada.[23]
Convulsiones
Consulte inmediatamente con un neurólogo si el paciente tiene convulsiones no controladas o recurrentes, o estado epiléptico. Las convulsiones de inicio reciente en el contexto de la HIC espontánea son relativamente frecuentes (afectan entre el 2.8% y el 28% de los pacientes); la mayoría de estas convulsiones ocurren dentro de las primeras 24 horas de la hemorragia.[23] Véase Estado epiléptico.
Opte un anticonvulsivo según las características individuales del paciente.[23] Siga el protocolo de su hospital. En la práctica clínica, el levetiracetam y el valproato de sodio se utilizan comúnmente.
Estatinas
No iniciar tratamiento con estatinas en pacientes con HIC espontánea a menos que sea necesario para otras indicaciones.[30]
Evaluación de la deglución y nutrición
Al ingreso, asegúrese de que el paciente tenga su función de deglución evaluada por personal debidamente capacitado antes de que se le administre cualquier alimento, líquido o medicamento oral:[30][55]
Si la prueba de admisión indica problemas para tragar, asegúrese de que el especialista lo evalúe dentro de las 24 horas posteriores al ingreso (preferiblemente) y no más de 72 horas después.
Para evitar la neumonía por aspiración, administrar alimentos, líquidos y medicamentos a los pacientes con disfagia en una forma que se pueda tragar sin aspiración, después de la evaluación especializada de la deglución.[55]
Iniciar el soporte nutricional para las personas que están en riesgo de desnutrición. No se recomienda la administración sistemática de suplementos nutricionales a los pacientes que están adecuadamente alimentados en el momento del ingreso.[55]
Posicionamiento óptimo y movilización temprana
Asegúrese de que los pacientes tengan una evaluación inicial especializada para su posicionamiento lo antes posible y dentro de las 4 horas posteriores a su llegada al hospital.[30]
Evalúe las necesidades clínicas individuales y las preferencias personales para determinar la posición óptima de la cabeza del paciente. Tenga en cuenta algunos factores como la comodidad, las capacidades físicas y cognitivas y el control postural.[55] Las unidades de accidente cerebrovascular no deben contar con una política o práctica que favorezca una posición de cabeza sentada o acostada.[30] Al acostarse o sentarse, los pacientes con accidente cerebrovascular agudo deben colocarse para minimizar el riesgo de aspiración y otras complicaciones respiratorias, dolor y subluxación del hombro, contracturas y ulceración por presión en la piel.[30]
Evidencia: posicionamiento óptimo
La evidencia no muestra diferencias en los resultados cuando el paciente con accidente cerebrovascular agudo se coloca acostado o con la cabeza elevada. Por lo tanto, la posición óptima debe adaptarse individualmente al paciente.[86]
Existe una amplia variación en la práctica clínica, y se cree que acostarse ayuda a mantener el flujo sanguíneo a las regiones cerebrales "en riesgo", pero posiblemente aumenta el riesgo de complicaciones como la neumonía. En 2019, el Instituto Nacional para la Excelencia en Salud y Atención (NICE) del Reino Unido realizó una revisión sistemática para su actualización de la guía de accidente cerebrovascular de 2019, comparando la posición de los pacientes con accidente cerebrovascular agudo acostados versus sentados. La revisión incluyó dos estudios, informados en seis artículos, ambos con diseño PROBE (ensayo prospectivo, aleatorizado, abierto, controlado con evaluación de resultados cegada).[86]
En el estudio piloto HeadPoST (94 personas) todos los participantes tuvieron un accidente cerebrovascular isquémico agudo. El grupo de intervención se acostó durante 24 horas, luego de 24 a 48 horas se levantó la cabeza lentamente hasta un máximo de 15°; después de 48 horas, las cabezas se elevaron más a los 30 ° estándar o más. El grupo de control se sentó con la cabeza elevada a 30 ° o más tan pronto como fue posible después del diagnóstico, y se mantuvo en esta posición durante al menos 48 horas.[87]
En el estudio completo HeadPoST (11 093 personas), el 8.4% de los participantes presentaron un accidente cerebrovascular hemorrágico agudo. El grupo de intervención se acostó lo antes posible después de la presentación y durante al menos 24 horas. El grupo de control se sentó con la cabeza elevada al menos a 30° inmediatamente después de la presentación al servicio de urgencias y durante al menos 24 horas.[88]
La revisión de la guía de práctica clínica NICE informó que:
A pesar de que el ensayo piloto encontró que había un posible beneficio al acostarse en términos de función a los 90 días, el estudio completo de mayor tamaño no encontró ninguna diferencia entre los grupos (escala de Rankin modificada 0-2 (2 estudios; n = 9840; RR 1.07; IC del 95%: 0.9 a 1.26; GRADE de muy baja calidad).
No se observaron diferencias clínicamente significativas en el accidente cerebrovascular recurrente (2 estudios; n = 11 185; evidencia de calidad moderada evaluada mediante GRADE), la neumonía a los 90 días (un estudio; n = 11 093; GRADE baja calidad), EQ-5D para dolor/malestar a los 90 días (1 estudio; n=8830; GRADE baja calidad), tiempo de estancia (1 estudio; n=94; GRADE de baja calidad) o mortalidad a los 90 días (2 estudios; n = 10 945; calidad moderada GRADE).
El comité de la guía de práctica clínica señaló que un gran número de pacientes fueron excluidos de la inscripción debido a la discreción del médico (particularmente en relación con su capacidad para tolerar la posición acostada) y la gravedad promedio del accidente cerebrovascular fue menor y no representativa del rango de gravedad del accidente cerebrovascular manejado dentro de los centros de tratamiento de accidentes cerebrovasculares del Reino Unido.
Por lo tanto, el comité concluyó que los factores individuales como la comodidad, la afección médica, el cuidado de la presión, el dolor, las habilidades físicas y cognitivas, la orientación, la alineación, el control postural y el cumplimiento deben considerarse al posicionar a los pacientes con accidente cerebrovascular agudo.[86]
A pesar de que la mayoría de los pacientes de los estudios incluidos presentaron accidente cerebrovascular isquémico agudo, el NICE lanzó una recomendación amplia para todos los pacientes con accidente cerebrovascular agudo.
Las recomendaciones de NICE sobre el posicionamiento no cambiaron en la actualización de 2022 de su guía de accidentes cerebrovasculares.
Organice la evaluación de los pacientes con dificultades de movilización por parte de un profesional de salud debidamente capacitado lo antes posible. Asegúrese de que esta evaluación se realiza dentro de las primeras 24 horas de inicio para determinar los métodos de transferencia y movilización más adecuados y seguros.[30] Ayude al paciente a levantarse de la cama, pararse o caminar tan pronto como su afección clínica lo permita como parte de un programa de manejo activo en una unidad especializada en accidentes cerebrovasculares.[55] La movilización generalmente comienza entre las 24 y 48 horas del inicio del accidente cerebrovascular.[30] Si el paciente necesita ayuda para levantarse de la cama, pararse o caminar, no proporcione una movilización de alta intensidad en las primeras 24 horas después del inicio de los síntomas.[30][55]
La movilización de alta intensidad se refiere a la intervención de movilización muy temprana del ensayo AVERT.[30][89] Incluye la movilización que: comienza dentro de las primeras 24 horas del inicio del accidente cerebrovascular; incluye al menos tres sesiones adicionales fuera de la cama en comparación con la atención habitual; se enfoca en la actividad de sentarse, pararse y caminar (es decir, levantarse de la cama).
Evidencia: movilización temprana (dentro de las 48 horas)
Las guías de práctica clínica sugieren que la movilización temprana (dentro de las 48 horas) puede ser adecuado en pacientes que requieren asistencia mínima para movilizarse (p. ej., aquellos que han tenido un accidente cerebrovascular leve o que experimentan solo disfunción del lenguaje y/o de las extremidades superiores), aunque la evidencia es limitada.[90]
Cuando el Instituto Nacional para la Excelencia en la Salud y la Atención (NICE) del Reino Unido actualizó su guía de práctica clínica sobre el accidente cerebrovascular en 2019, encontraron dos estudios que examinaban la movilización temprana (dentro de las 48 horas) con un total de 75 personas.[90][91][92]
La revisión realizada por NICE que incorporó estos dos estudios informó que no hubo diferencias significativas en los resultados de mortalidad, resultado funcional (escala de Rankin modificada), deterioro neurológico, eventos adversos o duración de la estancia hospitalaria (todas las evidencias de muy baja calidad evaluadas mediante GRADE).
El panel de la guía de práctica clínica emitió una recomendación de consenso de que la movilización debe considerarse cuando la afección clínica del paciente lo permita.
Ambos estudios fueron solo en pacientes con accidente cerebrovascular isquémico agudo; sin embargo, NICE lanzó una recomendación amplia para todas las personas con accidente cerebrovascular agudo.
Las recomendaciones de NICE sobre la movilización temprana no se modificaron en la actualización de 2022 de su guía de accidentes cerebrovasculares.
Evidencia: movilización muy temprana (dentro de las 24 horas)
Una movilización muy temprana no parece mejorar los resultados, y las estrategias de alta intensidad pueden causar daños clínicos en los resultados funcionales tempranos, posiblemente debido a la reducción de la perfusión cerebral. Por lo tanto, no se debe perseguir activamente una movilización muy temprana. Sin embargo, no se debe desalentar a los pacientes que pueden movilizarse con escasa o ninguna ayuda en las primeras 24 horas después del accidente cerebrovascular.[30][90]
[  ]
[Evidencia B]
]
[Evidencia B]
La revisión del Instituto Nacional para la Excelencia en Salud y Atención (NICE) del Reino Unido para su guía de 2019 encontró seis estudios que examinaron la movilización muy temprana (dentro de las 24 horas) con un total de 2475 personas.[90]
Cinco de los estudios incluyeron a pacientes con accidente cerebrovascular isquémico y hemorrágico, el restante solo incluyó a pacientes con accidente cerebrovascular isquémico.
La mayoría de los datos procedían del ensayo AVERT III 2016.[93][94][95][96][97] Este estudio utilizó una estrategia de movilización de alta intensidad que comenzó dentro de las 24 horas posteriores al inicio de los síntomas del accidente cerebrovascular e incluyó al menos tres sesiones adicionales fuera de la cama (sentado, de pie o caminando) en comparación con la atención habitual.
Para los resultados funcionales se observó una indicación de daño clínico como resultado de una movilización muy temprana con menos pacientes que alcanzaron una puntuación de Rankin modificada de 0-2 a los 7 días (dos estudios; n = 191; 118 menos por 1000 [de 223 menos a 20 más], evidencia de baja calidad evaluada mediante GRADE); sin embargo, no hubo diferencias significativas entre la movilización muy temprana y la atención habitual para la puntuación de Rankin modificada 0-2 a los 90 días (5 estudios; n = 2377; GRADE alto) o 12 meses (2 estudios; n = 2152; GRADE moderado).
Tampoco se observaron diferencias significativas entre los grupos para el accidente cerebrovascular recurrente (1 estudio; n = 71; GRADE bajo), deterioro neurológico (1 estudio; n=138; GRADE muy bajo), eventos adversos (2 estudios; n = 209; GRADE moderado), el tiempo de estancia hospitalaria (1 estudio; n=124; GRADE bajo) o mortalidad a los 90 días (6 estudios; n=2475; GRADE moderado).
Un estudio pequeño encontró un efecto beneficioso estadísticamente significativo de la movilización muy temprana para los resultados funcionales medidos por el índice de Barthel al alta (n = 90; GRADE moderado) y a los 90 días (n=80; GRADE moderado), pero el comité de la guía de práctica clínica no consideró que esto fuera clínicamente significativo.[90]
El NICE comenta que la evidencia sobre la movilización muy temprana es difícil de interpretar debido a las diferencias en la intensidad, el momento y el tipo de movilización utilizada en los ensayos, y la falta de estratificación por la capacidad inicial de movilizarse de forma independiente.
El consenso del comité de las guías de práctica clínica del NICE es no restringir la movilización adecuada muy temprana (dentro de las 24 horas) en personas que presentan movilidad independiente después de sufrir un accidente cerebrovascular. El NICE aconseja no iniciar la movilización intensa (movilizaciones más frecuentes de mayor duración que la "atención habitual") dentro de las primeras 24 horas entre las personas que necesitan ayuda para sentarse fuera de la cama, pararse o caminar, porque esto podría reducir la perfusión cerebral en estos pacientes.
Las recomendaciones de NICE sobre la movilización muy temprana no cambiaron en la actualización de 2022 de su guía de práctica clínica sobre accidentes cerebrovasculares.
La guía de práctica clínica National Clinical Guideline for Stroker para el Reino Unido e Irlanda ha emitido recomendaciones similares de que la movilización dentro de las 24 horas posteriores al inicio del accidente cerebrovascular debe ser solo para pacientes que requieren poca o ninguna asistencia para movilizarse, basando su decisión en los resultados del ensayo AVERT.[30]
Prevención de la trombosis venosa profunda y la embolia pulmonar
Administre compresión neumática intermitente dentro de los 3 días posteriores al ingreso para la prevención de trombosis venosa profunda y embolia pulmonar en pacientes inmóviles. Administre un tratamiento continuo durante 30 días o hasta que el paciente se mueva o sea dado de alta, lo que ocurra primero.[30]
No administre heparina de bajo peso molecular (HBPM) de forma rutinaria ni use medias de compresión graduadas.[30] Sin embargo, en la práctica, considere la HBPM profiláctica si la compresión neumática intermitente está contraindicada o no es posible.
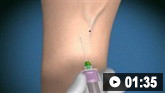
Cómo tomar una muestra de sangre venosa de la fosa antecubital utilizando una aguja de vacío.
El uso de este contenido está sujeto a nuestra cláusula de exención de responsabilidad