Anamnesis y examen
Principales factores de diagnóstico
común
presencia de factores de riesgo
Los factores de riesgo clave para el estado hipercoagulable son los antecedentes de tromboembolismo venoso (TEV) no provocado, el aumento de la edad, el embarazo/postparto, las neoplasias, el estado inflamatorio agudo, los anticuerpos antifosfolípidos, los trastornos mieloproliferativos, el síndrome nefrótico, la enfermedad de Behcet, la coagulación intravascular diseminada, hemoglobinuria paroxística nocturna, trombocitopenia inducida por heparina, píldoras anticonceptivas orales que contienen estrógenos/tratamiento de sustitución hormonal/tratamiento con moduladores selectivos de los receptores de estrógenos, quimioterapia, cirugía, deficiencia de antitrombina, deficiencia de proteína C o S, deficiencia de plasminógeno.
inflamación de las pantorrillas
Sugiere una trombosis venosa profunda.[Figure caption and citation for the preceding image starts]: Trombosis venosa profunda agudaDe la colección de Dr Roopen Arya; usado con autorización [Citation ends].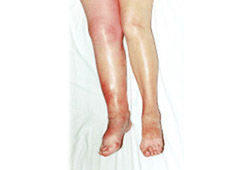
dolor o sensibilidad a lo largo del sistema venoso profundo
Sugiere una trombosis venosa profunda.
dolor torácico
Sugiere una embolia pulmonar.
taquipnea
Sugiere una embolia pulmonar.
dificultad para respirar
Sugiere una embolia pulmonar.
hipotensión
Sugiere una embolia pulmonar.
taquicardia
Sugiere una embolia pulmonar.
Otros factores de diagnóstico
común
antecedentes familiares de tromboembolia venosa (TEV)
La existencia de antecedentes de TEV en parientes de primer grado con un primer evento a una edad temprana (<50 años) puede sugerir una trombofilia hereditaria subyacente.[114]
Factores de riesgo
Fuerte
antecedentes de tromboembolia venosa no provocada
Aproximadamente el 25% de primeros casos de tromboembolia venosa (TEV) son TEV no provocados (idiopáticos) e indican un estado de hipercoagulabilidad subyacente.[49]
La estratificación del riesgo mediante el uso de los niveles de dímero D (marcador de fibrinólisis), producción de trombina y factor VIII puede ayudar a identificar a los pacientes con un alto riesgo de TEV recurrente.[33][108][109][110][111]
mayor edad
El riesgo de tromboembolismo venoso aumenta con la edad, desde 1 de cada 100,000 niños, pasando por 1 de cada 1000 adultos de edad avanzada de 40 años, hasta 1 de cada 100 en los mayores de 80 años.[39][40][41] El envejecimiento está asociado a un aumento de los niveles de los factores VII, IX y X activados y de los niveles de factor VIII, fibrinógeno y dímero D (marcador de fibrinólisis), lo que implica a su vez mayor riesgo de trombosis.[42]
La elevada prevalencia de comorbilidades asociadas al envejecimiento puede aumentar aún más los niveles de los factores de coagulación.
embarazo/posparto
El embarazo provoca una disminución de los valores fisiológicos de proteína S y un aumento de los niveles de fibrinógeno, factor VIII y factor de von Willebrand. Esto produce una resistencia a la proteína C activada. Todos los cambios continúan durante al menos 2 meses tras el parto.[46]
Aumenta 4 veces el riesgo de desarrollar tromboembolia venosa (TEV), en comparación con las mujeres no embarazadas.[43][44][45]
Aunque el riesgo absoluto de TEV en el embarazo sigue siendo bajo, es una de las principales causas de morbilidad y mortalidad materna.[47][48] El riesgo aumenta con antecedentes familiares de TEV y trombofilia hereditaria.[7][17][26] El riesgo de TEV relacionada con el embarazo es mayor entre las mujeres con deficiencia de antitrombina tipo I, homocigosidad para el factor V Leiden o heterocigosidad compuesta,[7][17][26] y aquellos con una TEV previa no provocada asociada al estrógeno.
neoplasia maligna
Es el factor de riesgo predisponente en entre el 16% y el 18% de los pacientes con trombofilia.[49][50]
El estado protrombótico se produce por la activación del sistema de coagulación debida a la expresión del factor tisular, la actividad fibrinolítica y la liberación de citocinas por las células malignas y su interacción con las células endoteliales y las plaquetas.[51][52]
La prevalencia de la neoplasia maligna oculta en el momento del diagnóstico de tromboembolia venosa (TEV) no provocada (idiopática) es de un 6.1% y del 10% a los 12 meses del diagnóstico de TEV.[53]
La neoplasia maligna oculta es menos frecuente en casos de TEV provocado (1.6% y 2.4% en el momento del diagnóstico y a los 12 meses del diagnóstico de TEV, respectivamente).[53]
El diagnóstico posterior de cáncer coincide generalmente con una enfermedad metastásica avanzada.[54]
La neoplasia maligna oculta y la TEV están asociados a una alta incidencia de recurrencia precoz, sangrado y muerte.[50]
estado inflamatorio agudo
El riesgo de tromboembolia venosa (TEV) se ve aumentado en pacientes hospitalizados con infección aguda, artritis, enfermedad del tejido conjuntivo o enfermedad inflamatoria intestinal.[44][55][56]
Los pacientes que padecen una enfermedad infecciosa en el entorno comunitario tienen un riesgo hasta 2 veces mayor de desarrollar TEV.[57]
La enfermedad inflamatoria intestinal aumenta hasta 3 veces el riesgo de TEV.[58] Hasta el momento, no se ha aclarado el mecanismo subyacente.
anticuerpos antifosfolípidos (AAF)
Asociada a enfermedades autoinmunitarias (p. ej., lupus eritematoso sistémico) o neoplasias malignas (p. ej., linfoma).[59]
La mayor parte de los pacientes con AAF que desarrollan tromboembolia venosa (TEV) presentan factores de riesgo adicionales de desarrollar trombosis.[59]
Hasta el 20% de los pacientes que presentan TEV tienen niveles altos de anticuerpos anticardiolipina antes del evento.[60]
El síndrome antifosfolípido se caracteriza por la persistencia de aPLs (anticoagulante lúpico, anticuerpos anticardiolipina, anticuerpos anti-beta-2–glicoproteína 1 analizados al menos dos veces, con 12 semanas de diferencia), y un evento trombótico objetivamente confirmado o una morbilidad relacionada con el embarazo.[61][62][63]
El síndrome antifosfolípido confirmado está asociado a un alto riesgo de TEV recurrente una vez retirado el tratamiento anticoagulante.
enfermedades mieloproliferativas
Incluyen la policitemia vera, la trombocitemia esencial, la mielofibrosis primaria o idiopática y la leucemia mielógena crónica.
Entre el 12% y el 39% de los casos presenta trombosis.[64]
Se han observado altas tasas de trombosis venosa abdominal.[65]
La mutación V617F del gen JAK2 puede ser responsable del fenotipo protrombótico.[65]
síndrome nefrótico
Se ha observado una alta incidencia de estado de hipercoagulabilidad en los primeros 6 meses tras el diagnóstico.[67]
La prevalencia de trombosis venosa renal es elevada.[68]
La patogenia no está clara, pero probablemente se deba a la combinación de niveles alterados de coagulación y proteínas fibrinolíticas, activación plaquetaria, hiperviscosidad, hiperlipidemia, niveles bajos de albúmina sérica y tratamiento con corticosteroides o diuréticos.[68]
enfermedad de Behcet
Enfermedad multisistémica poco frecuente que se caracteriza por úlceras orales y genitales recurrentes con afectación ocular.
La tromboembolia venosa es una complicación habitual que afecta a entre el 6% y el 39% de los pacientes.[69][70]
La patogenia no se conoce bien.
Se ha observado un aumento de los marcadores de producción de trombina y de fibrinólisis en todos los pacientes.[70]
coagulación intravascular diseminada
Complicación de una afección subyacente, como sepsis, neoplasia maligna, traumatismo o hepatopatía.
Tiene una patogenia compleja que resulta en el aumento de la producción de trombina debido a su vez al aumento de la expresión del factor tisular, la función alterada de los anticoagulantes naturales y la aceleración de la fibrinólisis.[71]
Se puede complicar por eventos de sangrado o trombosis.
hemoglobinuria paroxística nocturna
El estado de hipercoagulabilidad se produce en el 50% de los pacientes con enfermedades graves y es causa de la muerte en un tercio de los pacientes.[72]
La patogenia no está demasiado clara, pero se cree que está relacionada con la hemólisis y, posiblemente, con la activación directa del complemento de las plaquetas.[73]
trombocitopenia inducida por heparina
Se produce por la producción de anticuerpos contra el complejo formado entre la heparina y el factor plaquetario 4 (FP4).
La unión de los anticuerpos al complejo de heparina y el FP4 induce la activación plaquetaria, la formación de micropartículas, el consumo de plaquetas, trombocitopenia y un aumento posterior de la producción de trombina.[74]
Se debe sospechar en cualquier paciente que desarrolle trombocitopenia o un nuevo cuadro de trombosis poco después de comenzar el tratamiento con heparina.[75][76]
El riesgo de trombocitopenia inducida por heparina es menor en pacientes médicos/obstétricos tratados con heparina de bajo peso molecular (<0.1%) y aumenta en pacientes postoperatorios de cirugía cardíaca y ortopédica tratados con heparina no fraccionada (1% al 5%).[75][77]
Píldora anticonceptiva oral que contiene estrógenos/tratamiento de sustitución hormonal/tratamiento con moduladores selectivos de los receptores de estrógenos
Aumentar el riesgo de tromboembolismo venoso (TEV).[78][79]
[  ]
]
El riesgo absoluto de desarrollar TEV después de consumir píldoras anticonceptivas orales en mujeres jóvenes sin antecedentes personales o familiares de trombosis venosa sigue siendo bajo.
La píldora anticonceptiva oral combinada y el tratamiento hormonal sustitutivo (THS) pueden provocar una disminución de los niveles de proteína S, un aumento de los niveles de los factores VII y VIII, un aumento de la fibrinólisis y una resistencia a la proteína C activada.[80][81][82][83][84]
Los preparados transdérmicos de TRH pueden estar asociados a un menor riesgo que las formulaciones orales.[85][86][87][88]
La incidencia de TEV es la más alta en los primeros 12 meses posteriores al comienzo del tratamiento con píldoras anticonceptivas orales o del TRH.[78] El uso de tamoxifeno se asocia a un mayor riesgo de TEV.[89] Entre las mujeres que toman tamoxifeno adyuvante para el cáncer de mama en fase inicial, la prevalencia de la mutación del factor V Leiden puede ser aproximadamente cinco veces mayor en las que experimentan un evento tromboembólico que en las que no.[90]
quimioterapia
La tasa global de tromboembolismo venoso (TEV) de los pacientes que reciben quimioterapia para el cáncer es del 6%.
Los regímenes que incorporan talidomida o lenalidomida, además de dosis altas de dexametasona, están asociados a una mayor incidencia de TEV (del 8% al 75% en pacientes con un mieloma recién diagnosticado), en comparación con el 3% asociado al uso de talidomida o lenalidomida como fármaco individual.[91]
El tratamiento con asparraginasa conlleva un riesgo 5 veces mayor de desarrollar TEV en pacientes con leucemia linfoblástica aguda.[92]
cirugía
El riesgo de tromboembolismo venoso (TEV) varía según el tipo de cirugía y otros factores de riesgo subyacentes. En los pacientes que no reciben profilaxis, se estima que el riesgo inicial de TEV sintomática después de una cirugía ortopédica mayor es del 4.3%.[93]
Probablemente se deba a un estado protrombótico postoperatorio. Un traumatismo quirúrgico puede producir una exposición del factor tisular y la consiguiente activación del sistema de coagulación.[94]
deficiencia de antitrombina
La prevalencia es de 1 entre 5000 en personas de raza blanca.[15]
Las mutaciones genéticas pueden causar una deficiencia cuantitativa o un defecto cualitativo de antitrombina (AT). Se ha registrado hasta en el 3% de las personas de raza blanca y en el 6% de las personas del sudeste asiático con tromboembolismo venoso (TEV).[10][11][16]
Una deficiencia grave de AT puede aumentar el riesgo de TEV hasta 50 veces.[17]
La homocigosis por un defecto de AT tiene como resultado la muerte intrauterina.
deficiencia de proteína C
Los pacientes que tienen una deficiencia bien definida de proteína C corren un mayor riesgo de desarrollar tromboembolismo venoso (TEV) que los que no la tienen.
La prevalencia es de 1 de cada 500 en personas de raza blanca, más alta en personas del sudeste asiático.[11][18]
Presente en hasta el 5% de las personas de raza blanca y hasta el 8% de las personas del sudeste asiático con ETV.[10][16][19]
La deficiencia homocigota puede dar lugar a un fenotipo grave con púrpura fulminante neonatal.[20]
deficiencia de proteína S
Prevalencia de 1 en 1000 en personas de raza blanca; mayor en personas del sudeste asiático.[10][12][19]
La proteína S es un cofactor necesario para la inactivación de los factores Va y VIIIa a través de la proteína C activada.[3]
La deficiencia de proteína S se ha asociado a un alto riesgo de desarrollar TEV, especialmente en personas jóvenes.
deficiencia de plasminógeno
Los estudios sugieren que la frecuencia de la deficiencia de plasminógeno es mayor de lo esperado en pacientes con trombosis venosa.[3]
Puede ser una deficiencia cuantitativa (hipoplasminogénesis) o cualitativa (displasminogénesis).
Débil
obesidad
La patogenia es multifactorial y provoca el aumento de los niveles de los factores de coagulación, además de alterar la fibrinólisis.
La obesidad provoca el aumento de los niveles de factor tisular, factores VII y VIII e inhibidor del activador del plasminógeno 1 y puede contribuir al estado protrombótico.[95][96] Es posible que las adipocitocinas también intervengan.[97]
La obesidad está asociada a un mayor riesgo de desarrollar una primera tromboembolia venosa (TEV) y TEV recurrente y este riesgo será aún mayor cuanto más lo sea el índice de masa corporal (IMC).[27][98][99]
tabaquismo
La hipercoagulabilidad puede ser el resultado de la activación de la coagulación y el aumento de los niveles de fibrinógeno y de los factores VII, IX y X en personas que fuman habitualmente, en comparación con las personas no fumadoras.[102]
Está asociado a un riesgo débil de desarrollar tromboembolia venosa, que remite al abandonar el hábito de fumar.[100][101]
Infección por VIH
La incidencia de tromboembolia venosa es superior en pacientes con infección por VIH que en los grupos de control de pacientes de la misma edad y el mismo sexo.[103]
El mecanismo que conduce al estado protrombótico es incierto.
vuelo de largo recorrido (>4 horas)
El riesgo de TEV en una cohorte de personas sanas que realicen un vuelo ≥4 horas es de 1 entre 6000.[104]
En un subconjunto de personas sanas que realizaron un vuelo de 8 horas, se observó una activación de la coagulación y la fibrinólisis, así como un aumento de los marcadores de producción de trombina. Este hallazgo sugiere que la hipercoagulabilidad adquirida a causa de este tipo de vuelos (en lugar del estado de inmovilización) contribuye al riesgo de desarrollar TEV.[104][105]
El riesgo de TEV aumenta con la presencia de otros factores de riesgo.[104][106][107]
fibrinógeno elevado
disfibrinogenemia
Trastorno hereditario poco frecuente asociado a sangrado, que se complica por la trombosis en el 21% de los pacientes.[21]
factor V de Leiden
Mutación genética del factor de coagulación V que confiere la hipercoagulabilidad.
Tiene una prevalencia de hasta el 6% en personas de raza blanca, pero es poco frecuente en otros grupos étnicos.[5][7]
Se encuentra en hasta un 20% de las personas de raza blanca con tromboembolia venosa (TEV).[22][23] Aproximadamente el 90% de los pacientes con resistencia a la proteína C activada tiene esta mutación factor V de Leiden.[3]
El riesgo de TEV se ve aumentado hasta 7 veces en individuos heterocigotos y hasta 80 veces en homocigotos.[7]
Más del 75% de los portadores nunca desarrollará TEV.[24] No obstante, entre los portadores con historia familiar de TEV, aproximadamente el 50% desarrollará TEV antes de los 65 años de edad.[24]
mutación del gen de la protrombina (G-20210-A; también denominada variante F2 c.*97G>A)
Las personas portadoras de la mutación tienen niveles de protrombina superiores a los normales.
Tiene una prevalencia de hasta el 2% en personas de raza blanca, pero es poco frecuente en otros grupos étnicos.[6][25]
Se presenta en hasta el 6% de las personas que padecen tromboembolia venosa (TEV) y en hasta el 18% de aquellas con antecedentes familiares positivos de TEV.[6]
El riesgo de tromboembolia venosa (TEV) se ve aumentado de 2 a 3 veces en individuos heterocigotos.
La heterocigosis compuesta con factor V de Leiden aumenta 20 veces el riesgo de TEV.[26]
niveles elevados del factor VIII (>150 U/L)
Aumenta el riesgo de tromboembolismo venoso (TEV) hasta cinco veces, pero el riesgo es más de 10 veces en la población de raza negra.[14][31]
La patogenia no está clara, pero se puede deber a una mutación genética.[3]
Se encuentra en aproximadamente el 25% de los pacientes con TEV.[32]
El riesgo de TEV aumenta un 10% por cada incremento de 10 U/litro que se registre en el nivel del factor VIII.[31][32][33]
Estos niveles se asocian a un riesgo mayor de TEV recurrente.[33]
niveles elevados del factor IX o XI
hiperhomocisteinemia
Su función en la hipercoagulabilidad es un tema de controversia, pero no puede predisponer a una tromboembolia venosa.[37][38]
Puede ser congénita o adquirida. Las formas adquiridas se encuentran en pacientes con deficiencias dietarias de folato o vitaminas B6 o B12. La forma congénita se debe a una mutación, que da lugar a una fijación defectuosa del folato y a la reducción de la actividad de la metilentetrahidrofolato-reductasa (MTHFR).
Entre los mecanismos fisiopatológicos posibles se encuentra la activación endotelial, la proliferación de las células musculares lisas, los cambios en la producción de óxido nítrico endotelial y los cambios en el metabolismo endotelial de los esteroles.[3]
anemia falciforme
Su participación en el desarrollo de un estado de hipercoagulabilidad es un tema de controversia.
La anemia falciforme conduce al aumento de los niveles de marcadores de producción de trombina, la activación anormal del sistema fibrinolítico, el aumento de la expresión del factor tisular y la activación plaquetaria.[27]
Se ha sugerido que la anemia falciforme está asociada al aumento de las tasas de embolia pulmonar pero las tasas de trombosis venosa profunda (TVP) son equivalentes a las de los grupos de control de la misma edad.[28]
niveles elevados del inhibidor de la fibrinólisis activado por la trombina (IFAT)
Se asocian a un riesgo 2 veces mayor de desarrollar una primera tromboembolia venosa (TEV) y TEV recurrente.[36]
El uso de este contenido está sujeto a nuestra cláusula de exención de responsabilidad