Etiologia
O tabagismo é o fator causador mais significativo no câncer de bexiga, com risco atribuível de aproximadamente 50%.[11][20][21] O risco relativo de câncer de bexiga em indivíduos com história de tabagismo versus aqueles que nunca fumaram é de 2-3.[20] O risco relativo de câncer de bexiga por fumo passivo é de 1.4.[20]
A exposição ocupacional a carcinógenos químicos, como aminas aromáticas usadas nos setores de borracha e corante; hidrocarbonetos aromáticos policíclicos usados nos setores de alumínio, carvão/óleo/petróleo e revestimento; e exposição ao arsênico em água potável são fatores causadores reconhecidos de câncer de bexiga.[11][22] Outros grupos ocupacionais com aumento do risco incluem bombeiros, pintores, trabalhadores de lavanderias a seco e cabeleireiros.[23] A radiação pélvica, geralmente usada para câncer de próstata, e a quimioterapia, como ciclofosfamida ou ifosfamida, aumentam significativamente o risco de câncer de bexiga.[11][23] A exposição ambiental ao arsênico na água potável é um fator causador reconhecido de câncer urotelial.[11][24]
O diabetes (principalmente o tipo 2) pode aumentar o risco de câncer de bexiga; as evidências são conflitantes.[11][25][26] Algumas evidências sugerem que a pioglitazona está associada a um aumento do risco de câncer de bexiga em adultos com diabetes do tipo 2.[27][28][29] O papel potencial do índice de massa corporal, da pressão arterial, da glicose plasmática, do colesterol e dos triglicerídeos na etiologia do câncer de bexiga é incerto.[11][21][30]
A metaplasia escamosa queratinizante, que aparece como leucoplasia na cistoscopia, geralmente surge como resultado de uma irritação/inflamação crônica (por exemplo, infecção do trato urinário crônica, infecção por Schistosoma, cateter de demora crônico) e aumenta o risco de carcinoma de células escamosas na bexiga.[11][31][32]
Ocorrem casos familiares de câncer de bexiga; 4.3% dos pacientes com câncer de bexiga têm um parente de primeiro grau com câncer de bexiga e até 50% dos pacientes com câncer urotelial têm história familiar de câncer.[11][33] Entre os pacientes com suspeita de síndrome de câncer familiar, as variantes de linha germinativa patogênicas e provavelmente patogênicas são mais comumente encontradas nos genes BRCA1, MSH2, MLH1, ATM e CHEK2.[33] Estudos identificaram mutações das linhas germinativas associadas à predisposição ao câncer de bexiga (incluindo as variantes MSH2 e MLH1 associadas à síndrome de Lynch).[33][34][35] Os pacientes com variantes na linha germinativa foram diagnosticados com mais frequência em uma idade mais jovem do que aqueles sem variantes.[34]
Fisiopatologia
As nitrosaminas são concentradas e excretadas na urina, expondo assim as células que revestem o trato urinário a esses carcinógenos. Essa exposição é prolongada na bexiga (onde surgem 95% dos carcinomas uroteliais), mas a transformação maligna pode surgir em qualquer lugar no trato urinário, desde o cálice renal até o meato uretral.[36] É provável que a exposição frequente e prolongada a estes carcinógenos contribua para a transformação maligna das células uroteliais. Estudos do tecido normal da bexiga mostram taxas extremamente altas de mutações com heterogeneidade significativa.[37]
Os tumores multifocais síncronos são uma apresentação comum e podem ser acompanhados por áreas de displasia, chegando até mesmo a carcinoma in situ, tanto em áreas contíguas quanto distantes.[38][39] Podem ocorrer recidivas metacrônicas, frequentemente em locais distantes do tumor primário.[40] Esses achados levam ao conceito de um "efeito de campo", no qual a exposição do urotélio a carcinógenos aproximadamente na mesma concentração forma um epitélio, do qual células ocasionais começam a surgir e produzem clones independentes de células transformadas.[38] A promoção subsequente pode causar tumores multifocais, que podem ser síncronos ou metacrônicos.
Embora acredite-se que o efeito de campo explique a natureza multifocal do câncer de bexiga, estudos de desativação do cromossomo X sugerem uma única origem celular para a maioria dos tumores.[41] No entanto, os dois conceitos têm utilidade clínica: uma mutação pontual pode iniciar o processo, oferecendo uma vantagem de crescimento para as células que depois desenvolvem o fenótipo maligno, talvez explicando a proximidade dos novos tumores, e o fenômeno de implantação das células cancerígenas a jusante nos tumores do trato superior e de implantação pós-ressecção.
Vias fisiopatológicas distintas
É provável que múltiplas vias moleculares complexas sejam responsáveis pelo desenvolvimento do câncer de bexiga. Alterações precoces nos genes de remodelagem da cromatina, incluindo mutações em KMT2D e KDM6A, podem desempenhar um papel importante ao impulsionarem as células a colonizar áreas maiores do urotélio.[42] Mutações adicionais nos genes TP53, PIK3CA, FGFR3 ou RB1 podem então desencadear a transformação maligna.
Foram identificadas duas vias distintas que levam ao câncer de bexiga não músculo-invasivo e ao câncer de bexiga músculo-invasivo, com diferentes características clínicas, patológicas e moleculares.[42][43] No câncer de bexiga não músculo-invasivo, alterações, incluindo deleção do cromossomo 9 e mutação pontual no FGFR3, são observadas em precursores hiperplásicos e no câncer de bexiga papilar não músculo-invasivo, sugerindo uma relação clonal entre o precursor e o câncer de bexiga. O câncer de bexiga músculo-invasivo parece exigir a inativação de um ou mais genes supressores de tumor, como TP53, RB1 e PTEN, com o desenvolvimento do tumor precedido por displasia urotelial plana e carcinoma in situ. Em casos de câncer de bexiga não músculo-invasivo de alto grau, as vias parecem se cruzar, com ocorrência tanto de hiperplasia quanto de displasia.[42][43]
Classificação
Classificação TNM[3][4]
Com base nos resultados da biópsia, no exame físico e nos estudos de imagem, os tumores da bexiga são estadiados de acordo com a profundidade da invasão. O sistema de estadiamento mais usado e universalmente aceito é a classificação tumor-nodo-metástase (TNM):
Tamanho e extensão do tumor primário (T)
Envolvimento do linfonodo regional (N)
Presença ou ausência de metástases à distância (M).
Segundo esse sistema, o câncer de bexiga não invasivo do músculo inclui:
Tumores papilares confinados à mucosa epitelial (Ta)
Tumores que invadem o tecido subepitelial (isto é, lâmina própria; T1)
Carcinoma in situ (Tis).
Câncer de bexiga invasivo do músculo inclui:
Tumores confinados a órgãos: invadem a muscular própria (T2a ou T2b)
Tumores não-orgânicos: invadem a gordura perivesical (T3a ou T3b)
Os tumores invadem órgãos adjacentes: estroma da próstata, vesículas seminais, útero, vagina, parede pélvica, parede abdominal (T4a ou T4b).
Classificação da Organização Mundial da Saúde (OMS) - carcinoma urotelial[5]
Neoplasias uroteliais não invasivas
Papiloma urotelial
Papiloma urotelial invertido
Neoplasia urotelial papilar de baixo potencial maligno (NUPBPM)
Carcinoma urotelial papilar não invasivo, baixo grau
Carcinoma urotelial papilar não invasivo, alto grau
Carcinoma urotelial in situ
Neoplasias uroteliais invasivas
Carcinoma urotelial invasivo
Os tumores são classificados de acordo com suas características celulares. Anteriormente, os carcinomas de bexiga eram classificados de acordo com a classificação da OMS de 1973 de papiloma urotelial como bem diferenciado (G1), moderadamente diferenciado (G2) ou mal diferenciado (G3).[6] Em 2004, a OMS e a International Society of Urological Pathology (ISUP) publicaram um sistema de classificação que usou critérios específicos de citologia e arquitetura.[7] A classificação da OMS/ISUP diferencia entre neoplasias uroteliais papilares de baixo potencial maligno e carcinomas uroteliais de alto grau e baixo grau.
Outras atualizações da ISUP esclareceram a classificação do carcinoma urotelial não invasivo com graus mistos e subtipos de carcinoma urotelial invasivo (variantes) e diferenciações divergentes.[8] Embora o sistema de classificação da OMS tenha sido atualizado, os sistemas de classificação mais antigos continuam a ser usados.[8][9]
Comparação dos sistemas de classificação de 1973 e 2004 para neoplasias uroteliais não invasivas:[10]
OMS 1973
Papiloma urotelial
Grau 1: bem diferenciado, tem arquitetura papilar existente, cromatina fina e uma pequena indicação de nucléolos ou mitoses
Grau 2: moderadamente diferenciado, geralmente tem arquitetura papilar, cromatina granular e uma indicação mais forte de nucléolos e mitoses
Grau 3: inadequadamente diferenciado, menor probabilidade de apresentar arquitetura papilar, tem cromatina grossa e muitos exemplos de nucléolos e mitoses.
OMS/ISUP 2004
Papiloma urotelial
NUPBPM
Carcinoma urotelial papilar de baixo grau
Carcinoma urotelial papilar de alto grau
O estadiamento e a classificação exatos do câncer de bexiga são essenciais para diagnóstico, tratamento e acompanhamento adequados. O estádio e o grau do câncer fornecem uma indicação da probabilidade de recorrência e do risco de progressão para câncer invasivo.[Figure caption and citation for the preceding image starts]: Carcinoma urotelial papilar não invasivo (Ta) de baixo grau; observe o tumor satélite adjacente, ilustrando o efeito de campoDo acervo de Donald Lamm, MD, FACS [Citation ends].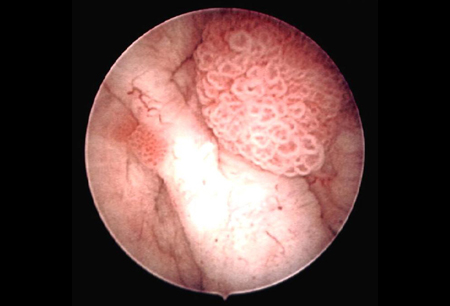 [Figure caption and citation for the preceding image starts]: Carcinoma urotelial de baixo grau disseminado na uretra prostática; a ilustração mostra o eletrodo de alça usado para remover tumores de bexigaDo acervo de Donald Lamm, MD, FACS [Citation ends].
[Figure caption and citation for the preceding image starts]: Carcinoma urotelial de baixo grau disseminado na uretra prostática; a ilustração mostra o eletrodo de alça usado para remover tumores de bexigaDo acervo de Donald Lamm, MD, FACS [Citation ends].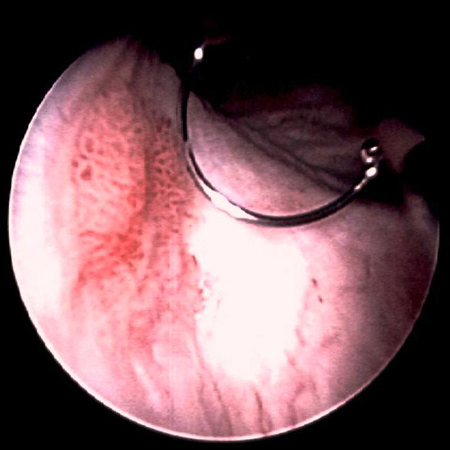 [Figure caption and citation for the preceding image starts]: Tumores de baixo grau rodeados por pequenos tumores satélites com pequenas frondes uniformes. Em primeiro plano, um tumor sólido em uma base ampla, uma aparência típica de tumores de alto grau. Tumores de baixo e alto grau geralmente ocorrem no mesmo pacienteDo acervo de Donald Lamm, MD, FACS [Citation ends].
[Figure caption and citation for the preceding image starts]: Tumores de baixo grau rodeados por pequenos tumores satélites com pequenas frondes uniformes. Em primeiro plano, um tumor sólido em uma base ampla, uma aparência típica de tumores de alto grau. Tumores de baixo e alto grau geralmente ocorrem no mesmo pacienteDo acervo de Donald Lamm, MD, FACS [Citation ends].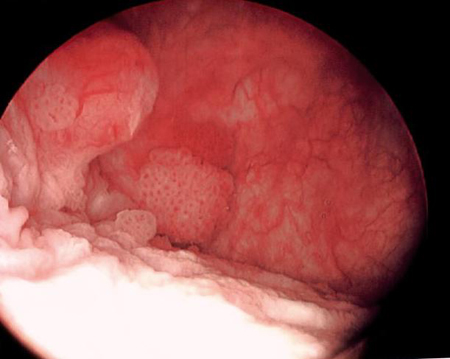
O uso deste conteúdo está sujeito ao nosso aviso legal