El tratamiento está indicado si los síntomas de la menopausia interfieren con las actividades cotidianas y la calidad de vida de la mujer. Se deben aclarar los síntomas predominantes y explicar los cambios en el estilo de vida y las opciones de tratamiento farmacológico (explicando los beneficios y riesgos).
La hormonoterapia debe administrarse en la dosis más baja y durante el tiempo más corto posible, mientras se mantiene simultáneamente el beneficio del alivio de los síntomas. Dado que la duración de los síntomas no se puede pronosticar, no existe una duración máxima predeterminada de la terapia hormonal; todos los pacientes requieren una toma de decisiones individualizada. La reevaluación debe realizarse al menos una vez al año.
Manejo de los sofocos
Los sofocos pueden tratarse con métodos farmacológicos (hormonales y no hormonales) o no farmacológicos (estilo de vida y métodos alternativos), o bien con una combinación de ambos.
Cambios en el estilo de vida
A pesar de la limitada evidencia, ciertos cambios en el estilo de vida pueden mejorar la tolerancia a los síntomas. Se debe estimular a la población femenina a perder peso (cuando sea adecuado) y a realizar más ejercicio físico.[11]Maas AHEM, Rosano G, Cifkova R, et al. Cardiovascular health after menopause transition, pregnancy disorders, and other gynaecologic conditions: a consensus document from European cardiologists, gynaecologists, and endocrinologists. Eur Heart J. 2021 Mar 7;42(10):967-84.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7947184
http://www.ncbi.nlm.nih.gov/pubmed/33495787?tool=bestpractice.com
Ambos tienen beneficios cardiovasculares y ósea y pueden mejorar el bienestar general, pero pueden no tener un impacto específicamente identificable en los sofocos y no pueden mejorar la densidad ósea.[8]North American Menopause Society. Management of osteoporosis in postmenopausal women: the 2021 position statement of The North American Menopause Society. Menopause. 2021 Sep 1;28(9):973-97.
http://www.ncbi.nlm.nih.gov/pubmed/34448749?tool=bestpractice.com
Otras medidas relacionadas con los cuidados personales incluyen evitar las comidas picantes, el alcohol, la cafeína, los ambientes cálidos y el estrés. El consumo de alcohol y de cafeína está asociado con el empeoramiento de los síntomas vasomotores. También puede ser de ayuda vestirse con varias capas de ropa, usar abanico, beber agua fría y vaporizarse agua. Una revisión cualitativa de ensayos clínicos aleatorios controlados (EAC) y metaanálisis observó que el yoga tiene una eficacia moderada a corto plazo sobre los síntomas psicológicos, pero ninguna sobre los somáticos, vasomotores ni urogenitales.[33]Cramer H, Lauche R, Langhorst J, et al. Effectiveness of yoga for menopausal symptoms: a systematic review and meta-analysis of randomized controlled trials. Evid Based Complement Alternat Med. 2012 Nov 7;2012:863905.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3524799
http://www.ncbi.nlm.nih.gov/pubmed/23304220?tool=bestpractice.com
Tratamiento combinado de estrógeno/progestina por vía oral
La hormonoterapia para una mujer con útero incluye un estrógeno junto con una progestina para proteger contra la hiperplasia y el cáncer de endometrio.[17]The North American Menopause Society Advisory Panel. The 2022 hormone therapy position statement of The North American Menopause Society. Menopause. 2022 Jul 1;29(7):767-94.
http://www.ncbi.nlm.nih.gov/pubmed/35797481?tool=bestpractice.com
Los estrógenos son el tratamiento más efectivo para los síntomas vasomotores, reduciendo los sofocos entre un 80% y un 90%.[34]American College of Obstetricians and Gynecologists. Practice bulletin no. 141: management of menopausal symptoms. Jan 2014 [internet publication].
https://www.acog.org/clinical/clinical-guidance/practice-bulletin/articles/2014/01/management-of-menopausal-symptoms
Los regímenes de combinación incluyen:
El régimen combinado continuo está indicado para mujeres que han tenido amenorrea durante más de 12 meses. Es fácil de seguir y continúa la amenorrea de la menopausia. Si la mujer tiene hemorragia de privación después de los primeros 6 meses del régimen combinado continuo, se requiere una evaluación endometrial (ultrasonido pélvico ± biopsia del endometrio) y se debe considerar la posibilidad de cambiar a un régimen secuencial para que pueda tener un patrón de sangrado predecible.
En un régimen secuencial, se agrega una progestina a un estrógeno durante los últimos 10 a 14 días del ciclo. El tratamiento hormonal (TH) secuencial puede ser preferida por las mujeres perimenopáusicas, pero puede indicarse también a las mujeres posmenopaúsicas.[35]Hamoda H, Panay N, Peddar H, et al. The British Menopause Society & Women’s Health Concern 2020 recommendations on hormone replacement therapy in menopausal women. 2020 [internet publication].
https://thebms.org.uk/publications/consensus-statements/bms-whcs-2020-recommendations-on-hormone-replacement-therapy-in-menopausal-women
[36]Stuenkel CA, Davis SR, Gompel A, et al. Treatment of symptoms of the menopause: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2015 Nov;100(11):3975-4011.
https://academic.oup.com/jcem/article/100/11/3975/2836060
http://www.ncbi.nlm.nih.gov/pubmed/26444994?tool=bestpractice.com
Hormonoterapia solo con estrógeno
Las mujeres histerectomizadas pueden tomar estrógenos en monoterapia si no presentan contraindicaciones al tratamiento sistémico con estrógenos.[17]The North American Menopause Society Advisory Panel. The 2022 hormone therapy position statement of The North American Menopause Society. Menopause. 2022 Jul 1;29(7):767-94.
http://www.ncbi.nlm.nih.gov/pubmed/35797481?tool=bestpractice.com
Administración transdérmica de un estrógeno
Es preferible una formulación transdérmica de estrógeno (generalmente estradiol) a un estrógeno oral en el caso de mujeres que presenten un mayor riesgo trombótico (incluyendo un índice de masa corporal IMC >30), que estén tomando otros medicamentos, presenten niveles de triglicéridos en el límite de la normalidad, presenten riesgo de cálculos biliares, o que tengan dificultades para cumplir con la toma de una píldora diariamente. Dado que no hay efecto de primer paso, la administración de estrógeno transdérmico puede suponer menor riesgo de tromboembolismo que el oral, pero esto no se ha estudiado en un ECA.[22]Vinogradova Y, Coupland C, Hippisley-Cox J. Use of hormone replacement therapy and risk of venous thromboembolism: nested case-control studies using the QResearch and CPRD databases. BMJ. 2019 Jan 9;364:k4810.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6326068
http://www.ncbi.nlm.nih.gov/pubmed/30626577?tool=bestpractice.com
[23]Cobin RH, Goodman NF; AACE Reproductive Endocrinology Scientific Committee. American Association of Clinical Endocrinologists and American College of Endocrinology position statement on menopause - 2017 update. Endocr Pract. 2017 Jul;23(7):869-80.
http://journals.aace.com/doi/full/10.4158/EP171828.PS
http://www.ncbi.nlm.nih.gov/pubmed/28703650?tool=bestpractice.com
También puede presentar una menor incidencia de náuseas. Las complicaciones de los estrógenos transdérmicos a largo plazo son probablemente las mismas que las de los estrógenos orales, aunque no se estudiaron específicamente en la Women's Health Initiative. Según las recomendaciones del National Institute for Health and Care Excellence (NICE) del Reino Unido, la administración transdérmica de estrógeno en dosis terapéuticas estándar no aumenta el riesgo de tromboembolia venosa, en comparación con el riesgo basal en la población, ni presenta una mayor probabilidad de aumentar el riesgo de accidente cerebrovascular.[1]National Institute for Health and Care Excellence. Menopause: diagnosis and management. Dec 2019 [internet publication].
https://www.nice.org.uk/guidance/ng23
El estradiol transdérmico está disponible en parches, en pulverizadores dosificados, o en preparados en gel, todos ellos para aplicar en la piel. Un ensayo aleatorizado controlado (EAC) multicéntrico de 12 semanas demostró que el gel de estradiol transdérmico redujo significativamente la frecuencia y gravedad de los sofocos en las semanas 4 y 12 en mujeres menopáusicas sanas que presentaban sofocos de moderados a graves en comparación con placebo.[37]Archer DF, Pickar JH, MacAllister DC, et al. Transdermal estradiol gel for the treatment of symptomatic postmenopausal women. Menopause. 2012 Jun;19(6):622-9.
http://www.ncbi.nlm.nih.gov/pubmed/22282101?tool=bestpractice.com
Los efectos secundarios señalados con más frecuencia fueron cefalea, infección, dolor de mamas, náuseas e insomnio. Un metanálisis en red no encontró diferencias en la eficacia entre la administración de estradiol en parche y en aerosol en lo que respeta a los síntomas vasomotores.[38]Kovács G, Zelei T, Vokó Z. Comparison of efficacy and local tolerability of estradiol metered-dose transdermal spray to estradiol patch in a network meta-analysis. Climacteric. 2016 Oct;19(5):488-95.
http://www.ncbi.nlm.nih.gov/pubmed/27593417?tool=bestpractice.com
Las mujeres con un útero intacto requieren protección con una progestina. Está disponible una combinación de un estrógeno y una progestina en un solo parche transdérmico en la mayoría de los países. Las preparaciones transdérmicas combinadas secuenciales de hormonoterapia también suelen estar disponibles.
Interrupción de la terapia con estrógenos
No hay pruebas suficientes para recomendar un método de interrupción de la terapia con estrógenos sobre otro. No existe una edad estándar para la interrupción de la hormonoterapia. Cada caso individual debe ser evaluado regularmente (p.ej., cada año) para determinar el grado de beneficio de hormonoterapia. Para las mujeres que obtienen un beneficio mínimo de la hormonoterapia, se pueden plantear una discusión razonable sobre el cese del tratamiento a cualquier edad.
Estrógenos conjugados con bazedoxifeno.
Se ha aprobado el estrógeno/bazedoxifeno conjugado (un modulador selectivo de receptores de estrógeno) en algunos países para el tratamiento de los síntomas vasomotores y la prevención de la osteoporosis en mujeres con un útero intacto.[8]North American Menopause Society. Management of osteoporosis in postmenopausal women: the 2021 position statement of The North American Menopause Society. Menopause. 2021 Sep 1;28(9):973-97.
http://www.ncbi.nlm.nih.gov/pubmed/34448749?tool=bestpractice.com
[39]Tella SH, Gallagher JC. Bazedoxifene + conjugated estrogens in HT for the prevention of osteoporosis and treatment of vasomotor symptoms associated with the menopause. Expert Opin Pharmacother. 2013 Dec;14(17):2407-20.
http://www.ncbi.nlm.nih.gov/pubmed/24093499?tool=bestpractice.com
En comparación con los estrógenos/medroxiprogesterona conjugados, las mujeres tratadas con estrógenos/bazedoxifeno conjugados experimentaron una reducción significativa de eventos adversos. Las mujeres que toman estrógenos/bazedoxifeno conjugados no deben tomar progestina.
El bazedoxifeno tiene un efecto favorable (antiestrogénico) sobre el tejido mamario.[40]Valera MC, Gourdy P, Trémollières F, et al. From the Women's Health Initiative to the combination of estrogen and selective estrogen receptor modulators to avoid progestin addition. Maturitas. 2015 Nov;82(3):274-7.
http://www.ncbi.nlm.nih.gov/pubmed/26261036?tool=bestpractice.com
Se requiere más investigación sobre este tema.
Hormonas bioidénticas
Los preparados de terapia hormonal bioidéntica (BHT) son simplemente un estrógeno (con o sin progestina) en una base compuesta personalizada. Se han promocionado las hormonas bioidénticas compuestas no reguladas como 'naturales' y más seguras que la hormonoterapia convencional, pero estas afirmaciones no están fundamentadas.
Una revisión sistemática concluyó que la terapia hormonal bioidéntica es más efectiva que el placebo para tratar los sofocos menopáusicos moderados a graves (evidencia de calidad baja a moderada), pero con tasas más altas de efectos adversos.[41]Gaudard AM, Silva de Souza S, Puga ME, et al. Bioidentical hormones for women with vasomotor symptoms. Cochrane Database Syst Rev. 2016 Aug 1;(8):CD010407.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD010407.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/27479272?tool=bestpractice.com
No hay datos de seguridad a largo plazo relacionados con resultados como el infarto de miocardio, el accidente cerebrovascular y el cáncer de mama.[41]Gaudard AM, Silva de Souza S, Puga ME, et al. Bioidentical hormones for women with vasomotor symptoms. Cochrane Database Syst Rev. 2016 Aug 1;(8):CD010407.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD010407.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/27479272?tool=bestpractice.com
Organismos asesores, tales como North American Menopause Society, American College of Obstetricians and Gynecologists (ACOG), las Academias Nacionales de Ciencias, Ingeniería y Medicina de los Estados Unidos y la British Menopause Society generalmente no recomiendan la terapia de estrógeno/progestina compuesta debido a la falta de pureza y potencia estandarizadas con los riesgos que conlleva una dosis excesiva o insuficiente.[17]The North American Menopause Society Advisory Panel. The 2022 hormone therapy position statement of The North American Menopause Society. Menopause. 2022 Jul 1;29(7):767-94.
http://www.ncbi.nlm.nih.gov/pubmed/35797481?tool=bestpractice.com
[35]Hamoda H, Panay N, Peddar H, et al. The British Menopause Society & Women’s Health Concern 2020 recommendations on hormone replacement therapy in menopausal women. 2020 [internet publication].
https://thebms.org.uk/publications/consensus-statements/bms-whcs-2020-recommendations-on-hormone-replacement-therapy-in-menopausal-women
[42]American College of Obstetricians and Gynecologists. ACOG clinical consensus no. 6: compounded bioidentical menopausal hormone therapy. Nov 2023 [internet publication].
https://www.acog.org/clinical/clinical-guidance/clinical-consensus/articles/2023/11/compounded-bioidentical-menopausal-hormone-therapy
[43]Stuenkel CA, Manson JE. Compounded bioidentical hormone therapy: the national academies weigh in. JAMA Intern Med. 2021 Mar 1;181(3):370-71.
http://www.ncbi.nlm.nih.gov/pubmed/33315055?tool=bestpractice.com
De forma similar, la American Association of Clinical Endocrinologists (AACE) y el American College of Endocrinology (ACE) no recomiendan la terapia hormonal bioidéntica debido a la falta de beneficios comprobados y el potencial para un control de calidad deficiente.[23]Cobin RH, Goodman NF; AACE Reproductive Endocrinology Scientific Committee. American Association of Clinical Endocrinologists and American College of Endocrinology position statement on menopause - 2017 update. Endocr Pract. 2017 Jul;23(7):869-80.
http://journals.aace.com/doi/full/10.4158/EP171828.PS
http://www.ncbi.nlm.nih.gov/pubmed/28703650?tool=bestpractice.com
Para la mayor parte de las mujeres, la hormonoterapia autorizada (regulada) proporciona un tratamiento adecuado sin los riesgos de las formulaciones personalizadas.
Los preparados regulados que contienen estradiol y progesterona micronizada (un estrógeno similar, y un progestágeno equivalente a, aquellos producidos por los ovarios) deben utilizarse preferentemente a los preparados compuestos por parte de mujeres que están considerando el uso de preparados más naturales. La declaración de la posición de 2017 de la AACE/ACE recomienda que cuando sea necesario el uso de progesterona, se considere la progesterona micronizada como la alternativa más segura frente a una progestina sintética.[23]Cobin RH, Goodman NF; AACE Reproductive Endocrinology Scientific Committee. American Association of Clinical Endocrinologists and American College of Endocrinology position statement on menopause - 2017 update. Endocr Pract. 2017 Jul;23(7):869-80.
http://journals.aace.com/doi/full/10.4158/EP171828.PS
http://www.ncbi.nlm.nih.gov/pubmed/28703650?tool=bestpractice.com
La progesterona micronizada se puede tomar por vía oral o vaginal, pero la progesterona micronizada transdérmica no protege el endometrio.[44]Stute P, Neulen J, Wildt L. The impact of micronized progesterone on the endometrium: a systematic review. Climacteric. 2016 Aug;19(4):316-28.
https://www.tandfonline.com/doi/full/10.1080/13697137.2016.1187123
http://www.ncbi.nlm.nih.gov/pubmed/27277331?tool=bestpractice.com
Se puede adquirir fácilmente una crema de progesterona bioidéntica sin receta, pero solo uno de tres ensayos aleatorizados controlados (EAC) publicados demostraron cierta eficacia en comparación con el placebo a la hora de reducir los síntomas vasomotores.[45]Whelan AM, Jurgens TM, Trinacty M. Bioidentical progesterone cream for menopause-related vasomotor symptoms: is it effective? Ann Pharmacother. 2013 Jan;47(1):112-6.
http://www.ncbi.nlm.nih.gov/pubmed/23249728?tool=bestpractice.com
Riesgos de la terapia hormonal
Es importante proporcionar información sobre los beneficios y riesgos de la hormonoterapia, para ayudar a las mujeres a tomar una decisión informada sobre qué tratamiento utilizar para los síntomas de la menopausia, si los hubiera.
El riesgo asociado con el uso de la hormonoterapia varía entre las mujeres, dependiendo de la dosis, la duración del tratamiento, la vía de administración, la edad al inicio del tratamiento y si se incluye un progestágeno en el régimen. La relación beneficio-riesgo de la hormonoterapia parece favorable para el tratamiento de los síntomas vasomotores y la prevención de la pérdida o fractura ósea entre las mujeres (sin contraindicaciones) con menos de 60 años o que están dentro de los 10 años de la aparición de la menopausia.[8]North American Menopause Society. Management of osteoporosis in postmenopausal women: the 2021 position statement of The North American Menopause Society. Menopause. 2021 Sep 1;28(9):973-97.
http://www.ncbi.nlm.nih.gov/pubmed/34448749?tool=bestpractice.com
[17]The North American Menopause Society Advisory Panel. The 2022 hormone therapy position statement of The North American Menopause Society. Menopause. 2022 Jul 1;29(7):767-94.
http://www.ncbi.nlm.nih.gov/pubmed/35797481?tool=bestpractice.com
Durante 18 años de seguimiento, la mortalidad por cualquier causa en una cohorte combinada de mujeres posmenopáusicas que recibieron hormonoterapia durante 5 a 7 años en los dos ensayos de la Women's Health Initiative no difirió entre los grupos con hormonoterapia y con placebo (27.1% frente a 27.6%, respectivamente; cociente de riesgos instantáneos [CRI] 0.99, intervalo de confianza [IC] del 95%: 0.94 a 1.03]).[46]Manson JE, Aragaki AK, Rossouw JE, et al. Menopausal hormone therapy and long-term all-cause and cause-specific mortality: the women's health initiative randomized trials. JAMA. 2017 Sep 12;318(10):927-38.
http://www.ncbi.nlm.nih.gov/pubmed/28898378?tool=bestpractice.com
Ni el estrógeno en monoterapia (CRI 0.94, IC del 95%: 0.88 a 1.01) ni la combinación de estrógeno más progestina (CRI 1.02, IC del 95%: 0.96 a 1.08) se asociaron con mayor riesgo de mortalidad por cualquier causa.[46]Manson JE, Aragaki AK, Rossouw JE, et al. Menopausal hormone therapy and long-term all-cause and cause-specific mortality: the women's health initiative randomized trials. JAMA. 2017 Sep 12;318(10):927-38.
http://www.ncbi.nlm.nih.gov/pubmed/28898378?tool=bestpractice.com
Cardiopatía, accidente cerebrovascular y tromboembolia venosa
La hormonoterapia no se recomienda actualmente para la prevención primaria de enfermedades cardiovasculares.[17]The North American Menopause Society Advisory Panel. The 2022 hormone therapy position statement of The North American Menopause Society. Menopause. 2022 Jul 1;29(7):767-94.
http://www.ncbi.nlm.nih.gov/pubmed/35797481?tool=bestpractice.com
[18]Marjoribanks J, Farquhar C, Roberts H, et al. Long-term hormone therapy for perimenopausal and postmenopausal women. Cochrane Database Syst Rev. 2017 Jan 17;(1):CD004143.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD004143.pub5/full
http://www.ncbi.nlm.nih.gov/pubmed/28093732?tool=bestpractice.com
[19]American College of Obstetricians and Gynecologists. ACOG committee opinion no. 565: hormone therapy and heart disease. Jun 2013 [internet publication].
https://www.acog.org/clinical/clinical-guidance/committee-opinion/articles/2013/06/hormone-therapy-and-heart-disease
http://www.ncbi.nlm.nih.gov/pubmed/23812486?tool=bestpractice.com
[20]Kremer C, Gdovinova Z, Bejot Y, et al. European Stroke Organisation guidelines on stroke in women: Management of menopause, pregnancy and postpartum. Eur Stroke J. 2022 Jun;7(2):I-XIX.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9134774
http://www.ncbi.nlm.nih.gov/pubmed/35647308?tool=bestpractice.com
Se requiere investigación adicional para evaluar el impacto de la sincronización del inicio de la hormonoterapia sobre el riesgo de cardiopatía y la mortalidad.
[Figure caption and citation for the preceding image starts]: Tasas absolutas de cardiopatía coronaria para diferentes tipos de hormonoterapia, en comparación con ausencia de hormonoterapia (o placebo), diferentes duraciones del uso de la hormonoterapia y tiempo transcurrido desde que se interrumpió la hormonoterapia en mujeres menopáusicas.National Institute for Health and Care Excellence. Menopausia: diagnóstico y manejo. Diciembre de 2019 [Citation ends].
El riesgo de tromboembolia venosa y de accidente cerebrovascular isquémico aumenta con la hormonoterapia oral, pero el riesgo absoluto de accidente cerebrovascular en mujeres menores de 60 años de edad es muy bajo.[1]National Institute for Health and Care Excellence. Menopause: diagnosis and management. Dec 2019 [internet publication].
https://www.nice.org.uk/guidance/ng23
[47]de Villiers TJ, Gass ML, Haines CJ, et al. Global consensus statement on menopausal hormone therapy. Climacteric. 2013 Apr;16(2):203-4.
http://www.tandfonline.com/doi/full/10.3109/13697137.2013.771520
http://www.ncbi.nlm.nih.gov/pubmed/23488524?tool=bestpractice.com
[48]de Villiers TJ, Hall JE, Pinkerton JV, et al. Revised global consensus statement on menopausal hormone therapy. Climacteric. 2016 Aug;19(4):313-5.
http://www.ncbi.nlm.nih.gov/pubmed/27322027?tool=bestpractice.com
Los estudios observacionales y un metaanálisis indican que los estrógenos transdérmicos están asociados con un menor riesgo de tromboembolismo venoso y de accidente cerebrovascular que los estrógenos orales.[1]National Institute for Health and Care Excellence. Menopause: diagnosis and management. Dec 2019 [internet publication].
https://www.nice.org.uk/guidance/ng23
[17]The North American Menopause Society Advisory Panel. The 2022 hormone therapy position statement of The North American Menopause Society. Menopause. 2022 Jul 1;29(7):767-94.
http://www.ncbi.nlm.nih.gov/pubmed/35797481?tool=bestpractice.com
[47]de Villiers TJ, Gass ML, Haines CJ, et al. Global consensus statement on menopausal hormone therapy. Climacteric. 2013 Apr;16(2):203-4.
http://www.tandfonline.com/doi/full/10.3109/13697137.2013.771520
http://www.ncbi.nlm.nih.gov/pubmed/23488524?tool=bestpractice.com
[48]de Villiers TJ, Hall JE, Pinkerton JV, et al. Revised global consensus statement on menopausal hormone therapy. Climacteric. 2016 Aug;19(4):313-5.
http://www.ncbi.nlm.nih.gov/pubmed/27322027?tool=bestpractice.com
Los pacientes con alto riesgo de complicaciones cardiovasculares deben someterse a una evaluación detallada de los riesgos y beneficios de la TH, y pueden ser candidatos a un ensayo de no TH.[11]Maas AHEM, Rosano G, Cifkova R, et al. Cardiovascular health after menopause transition, pregnancy disorders, and other gynaecologic conditions: a consensus document from European cardiologists, gynaecologists, and endocrinologists. Eur Heart J. 2021 Mar 7;42(10):967-84.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7947184
http://www.ncbi.nlm.nih.gov/pubmed/33495787?tool=bestpractice.com
[Figure caption and citation for the preceding image starts]: Tasas absolutas de accidente cerebrovascular para diferentes tipos de hormonoterapia, en comparación con ausencia de hormonoterapia (o placebo), diferentes duraciones del uso de la hormonoterapia y tiempo transcurrido desde que se interrumpió la hormonoterapia en mujeres menopáusicas.National Institute for Health and Care Excellence. Menopausia: diagnóstico y manejo. Diciembre de 2019 [Citation ends].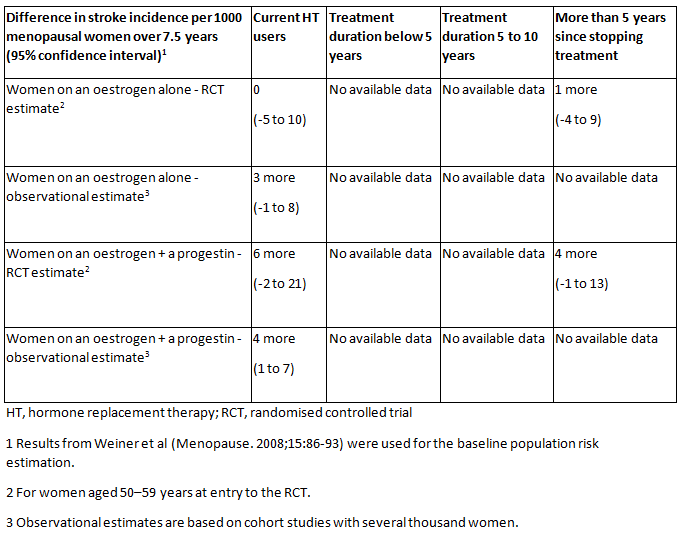
Cáncer de mama y de ovario
La hormonoterapia con estrógeno en monoterapia se asocia con poco o ningún cambio en el riesgo de cáncer de mama.[1]National Institute for Health and Care Excellence. Menopause: diagnosis and management. Dec 2019 [internet publication].
https://www.nice.org.uk/guidance/ng23
Un estrógeno prescrito en combinación con una progestina se asocia con un pequeño aumento en el riesgo de cáncer de mama.[1]National Institute for Health and Care Excellence. Menopause: diagnosis and management. Dec 2019 [internet publication].
https://www.nice.org.uk/guidance/ng23
[47]de Villiers TJ, Gass ML, Haines CJ, et al. Global consensus statement on menopausal hormone therapy. Climacteric. 2013 Apr;16(2):203-4.
http://www.tandfonline.com/doi/full/10.3109/13697137.2013.771520
http://www.ncbi.nlm.nih.gov/pubmed/23488524?tool=bestpractice.com
[48]de Villiers TJ, Hall JE, Pinkerton JV, et al. Revised global consensus statement on menopausal hormone therapy. Climacteric. 2016 Aug;19(4):313-5.
http://www.ncbi.nlm.nih.gov/pubmed/27322027?tool=bestpractice.com
[Evidencia C]f5f80ae3-be5c-4ddf-8bff-5c164c58e0a4guidelineC¿Cuáles son los efectos del tratamiento hormonal sustitutivo (THS) administrado para los síntomas de la menopausia en el riesgo de desarrollar cáncer de mama?[1]National Institute for Health and Care Excellence. Menopause: diagnosis and management. Dec 2019 [internet publication].
https://www.nice.org.uk/guidance/ng23
El aumento del riesgo está relacionado con la duración del tratamiento y es probable que desaparezca después de su interrupción.[1]National Institute for Health and Care Excellence. Menopause: diagnosis and management. Dec 2019 [internet publication].
https://www.nice.org.uk/guidance/ng23
[47]de Villiers TJ, Gass ML, Haines CJ, et al. Global consensus statement on menopausal hormone therapy. Climacteric. 2013 Apr;16(2):203-4.
http://www.tandfonline.com/doi/full/10.3109/13697137.2013.771520
http://www.ncbi.nlm.nih.gov/pubmed/23488524?tool=bestpractice.com
[48]de Villiers TJ, Hall JE, Pinkerton JV, et al. Revised global consensus statement on menopausal hormone therapy. Climacteric. 2016 Aug;19(4):313-5.
http://www.ncbi.nlm.nih.gov/pubmed/27322027?tool=bestpractice.com
La Agencia Reguladora de Medicamentos y Productos Sanitarios del Reino Unido ha publicado una tabla en la que se resume el riesgo de cáncer de mama para las mujeres que actualmente reciben tratamiento hormonal y tratamiento posterior desde la edad de la menopausia hasta los 69 años.[49]Medicines and Healthcare products Regulatory Agency. Drug safety update. Hormone replacement therapy (HRT): further information on the known increased risk of breast cancer with HRT and its persistence after stopping. Aug 2019 [internet publication].
https://www.gov.uk/drug-safety-update/hormone-replacement-therapy-hrt-further-information-on-the-known-increased-risk-of-breast-cancer-with-hrt-and-its-persistence-after-stopping
[Figure caption and citation for the preceding image starts]: Resumen de los riesgos y beneficios del THS* durante el uso actual y el uso actual más el tratamiento posterior desde la menopausia hasta los 69 años, por cada 1000 mujeres con 5 o 10 años de uso del THS. Clave: *El alivio de los síntomas de la menopausia no está incluido en esta tabla, pero es un beneficio clave del THS y desempeñará un papel importante en la decisión de prescribir la THS. †Mejores estimaciones basadas en los riesgos relativos del uso del THS a partir de los 50 años. Para el cáncer de mama, esto incluye los casos diagnosticados durante el uso actual del THS y diagnosticados después del uso de la THS hasta los 69 años; para otros riesgos, esto supone que no hay efectos residuales después de suspender el uso del THS. § La evidencia más reciente sugiere que los productos transdérmicos del THS tienen un menor riesgo de TEV que las preparaciones oralesAgencia Reguladora de Medicamentos y Productos Sanitarios. Tratamiento hormonal sustitutivo (THS): más información sobre el aumento conocido del riesgo de cáncer de mama con la TRH y su persistencia después de suspenderla. Agosto de 2019 [publicación en Internet]; usado con permiso [Citation ends].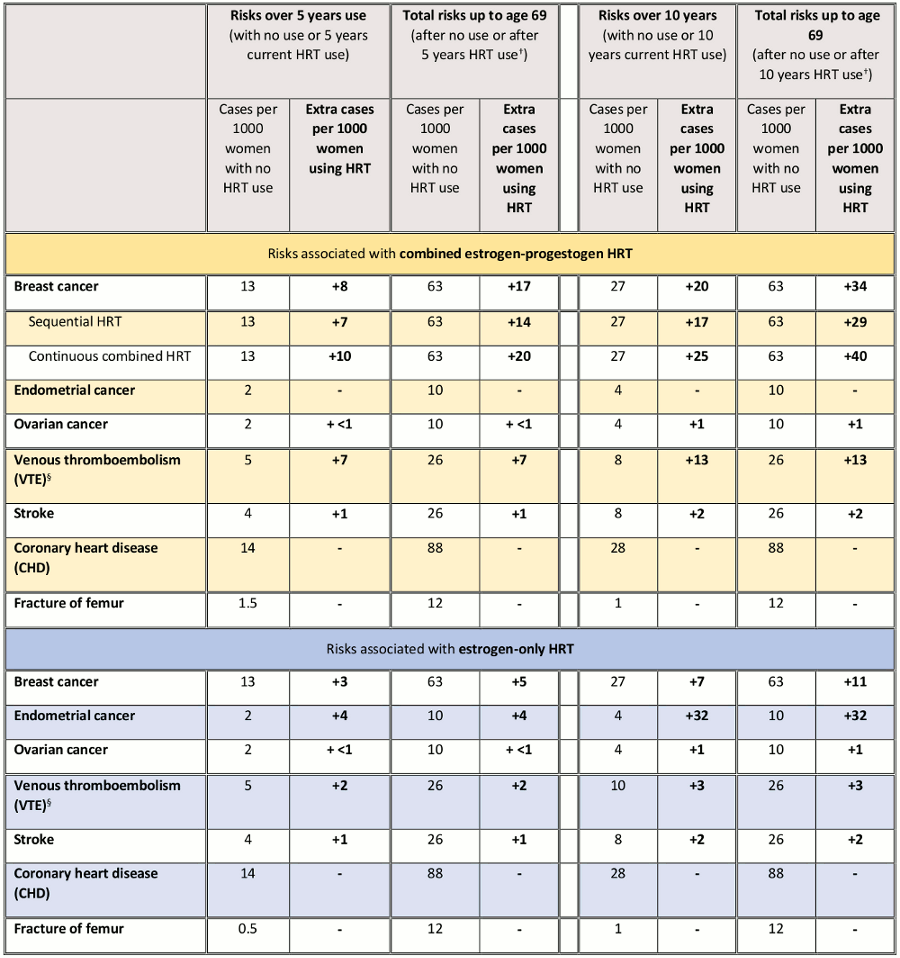
Hay evidencias que sugieren que la hormonoterapia aumenta la densidad del tejido mamario.[1]National Institute for Health and Care Excellence. Menopause: diagnosis and management. Dec 2019 [internet publication].
https://www.nice.org.uk/guidance/ng23
Esto puede dificultar la detección de tumores y puede resultar en que algunas mujeres vuelvan a tener que repetir la mamografía y/o a realizar evaluaciones posteriores.
Un metaanálisis de 52 estudios epidemiológicos analizó los riesgos de cáncer de ovario en 12,110 mujeres posmenopáusicas, el 55% de las cuales habían usado hormonoterapia durante algún tiempo.[50]Beral V, Gaitskell K, Hermon C, et al.; Collaborative Group On Epidemiological Studies Of Ovarian Cancer. Menopausal hormone use and ovarian cancer risk: individual participant meta-analysis of 52 epidemiological studies. Lancet. 2015 May 9;385(9980):1835-42.
http://www.ncbi.nlm.nih.gov/pubmed/25684585?tool=bestpractice.com
El metaanálisis sugirió que 5 años de uso de hormonoterapia, comenzando a la edad de 50 años, resultaría en un cáncer de ovario extra por cada 1000 usuarias.[50]Beral V, Gaitskell K, Hermon C, et al.; Collaborative Group On Epidemiological Studies Of Ovarian Cancer. Menopausal hormone use and ovarian cancer risk: individual participant meta-analysis of 52 epidemiological studies. Lancet. 2015 May 9;385(9980):1835-42.
http://www.ncbi.nlm.nih.gov/pubmed/25684585?tool=bestpractice.com
Un metanálisis de 2019 de estudios prospectivos encontró que el uso de la terapia hormonal (TH) durante más de un año en mujeres posmenopáusicas está asociado con un mayor riesgo de cáncer de mama.[51]Collaborative Group on Hormonal Factors in Breast Cancer. Type and timing of menopausal hormone therapy and breast cancer risk: individual participant meta-analysis of the worldwide epidemiological evidence. Lancet. 2019 Aug 29;394(10204):1159-68.
www.doi.org/10.1016/S0140-6736(19)31709-X
http://www.ncbi.nlm.nih.gov/pubmed/31474332?tool=bestpractice.com
El riesgo aumentó con una mayor duración del uso de la TH, y persistió después de que se detuvo la TH. El riesgo fue mayor con el estrógeno y progestágeno combinados en comparación con las preparaciones que solo contienen estrógeno, pero no se observó un aumento del riesgo con los estrógenos vaginales tópicos. Las actuales recomendaciones no han variado: que la terapia hormonal (TH) debe utilizarse durante el menor tiempo posible y que las pacientes deben estar atentas a los signos de cáncer de mama y se les debe animar a que asistan a los cribados regulares de detección del cáncer de mama.[49]Medicines and Healthcare products Regulatory Agency. Drug safety update. Hormone replacement therapy (HRT): further information on the known increased risk of breast cancer with HRT and its persistence after stopping. Aug 2019 [internet publication].
https://www.gov.uk/drug-safety-update/hormone-replacement-therapy-hrt-further-information-on-the-known-increased-risk-of-breast-cancer-with-hrt-and-its-persistence-after-stopping
[52]European Medicines Agency. Committee for Medicinal Products for Human Use (CHMP). Guideline on clinical investigation of medicinal products for hormone replacement therapy of oestrogen deficiency symptoms in postmenopausal women. Oct 2005 [internet publication].
https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-clinical-investigation-medicinal-products-hormone-replacement-therapy-oestrogen-deficiency_en.pdf
Los riesgos y beneficios de la terapia hormonal (TH) deben discutirse con los pacientes durante la toma de decisiones compartida antes de comenzar la TH.[1]National Institute for Health and Care Excellence. Menopause: diagnosis and management. Dec 2019 [internet publication].
https://www.nice.org.uk/guidance/ng23
[53]British Menopause Society. BMS response to Lancet paper on the link between different forms of HRT and breast cancer incidence. Aug 2019 [internet publication].
https://thebms.org.uk/2019/08/bms-response-to-lancet-paper-on-the-link-between-different-forms-of-hrt-and-breast-cancer-incidence
Medicamentos no hormonales para síntomas vasomotores
Una revisión sistemática y un metaanálisis de 43 ensayos de tratamientos no hormonales encontraron que el reemplazo de estrógeno fue significativamente más eficaz que las alternativas no hormonales.[54]Nelson HD, Vesco KK, Haney E, et al. Nonhormonal therapies for menopausal hot flashes: systematic review and meta-analysis. JAMA. 2006 May 3;295(17):2057-71.
http://www.ncbi.nlm.nih.gov/pubmed/16670414?tool=bestpractice.com
Sin embargo, las alternativas no hormonales pueden beneficiar a las mujeres que no pueden tomar un estrógeno debido a que existen factores de riesgo o incapacidad para tolerar la hormonoterapia.[55]The North American Menopause Society Advisory Panel. The 2023 nonhormone therapy position statement of The North American Menopause Society. Menopause. 2023 Jun 1;30(6):573-90.
http://www.ncbi.nlm.nih.gov/pubmed/37252752?tool=bestpractice.com
Inhibidores selectivos de la recaptación de serotonina (ISRS) e inhibidores de la recaptación de serotonina-noradrenalina (IRSN)
Los ISRS y los IRSN son efectivos para tratar los síntomas vasomotores en mujeres que no pueden recibir hormonoterapia.[56]Freeman EW, Guthrie KA, Caan B, et al. Efficacy of escitalopram for hot flashes in healthy menopausal women: a randomized controlled trial. JAMA. 2011 Jan 19;305(3):267-74.
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3129746
http://www.ncbi.nlm.nih.gov/pubmed/21245182?tool=bestpractice.com
[57]American Academy of Family Physicians. ACOG releases clinical guidelines on management of menopausal symptoms. Am Fam Physician. 2014 Sep 1;90(5):338-40.
https://www.aafp.org/afp/2014/0901/p338.pdf
[58]Shams T, Firwana B, Habib F, et al. SSRIs for hot flashes: a systematic review and meta-analysis of randomized trials. J Gen Intern Med. 2014 Jan;29(1):204-13.
http://www.ncbi.nlm.nih.gov/pubmed/23888328?tool=bestpractice.com
Algunas evidencias indican que el escitalopram puede ser más eficaz que otros ISRS para reducir los sofocos.[58]Shams T, Firwana B, Habib F, et al. SSRIs for hot flashes: a systematic review and meta-analysis of randomized trials. J Gen Intern Med. 2014 Jan;29(1):204-13.
http://www.ncbi.nlm.nih.gov/pubmed/23888328?tool=bestpractice.com
Sólo la paroxetina está aprobada para el tratamiento de los síntomas vasomotores moderados a severos asociados con la menopausia.[34]American College of Obstetricians and Gynecologists. Practice bulletin no. 141: management of menopausal symptoms. Jan 2014 [internet publication].
https://www.acog.org/clinical/clinical-guidance/practice-bulletin/articles/2014/01/management-of-menopausal-symptoms
[59]Orleans RJ, Li L, Kim MJ, et al. FDA approval of paroxetine for menopausal hot flushes. N Engl J Med. 2014 May 8;370(19):1777-9.
http://www.nejm.org/doi/full/10.1056/NEJMp1402080
http://www.ncbi.nlm.nih.gov/pubmed/24806158?tool=bestpractice.com
En un EAC de 8 semanas de duración de 339 mujeres perimenopáusicas y posmenopáusicas con síntomas vasomotores molestos, la venlafaxina (una IRSN) redujo la frecuencia de los síntomas en 1.8 veces más por día más que el placebo (P = 0.005).[60]Joffe H, Guthrie KA, LaCroix AZ, et al. Low-dose estradiol and the serotonin-norepinephrine reuptake inhibitor venlafaxine for vasomotor symptoms: a randomized clinical trial. JAMA Intern Med. 2014 Jul;174(7):1058-66.
http://archinte.jamanetwork.com/article.aspx?articleid=1876676
http://www.ncbi.nlm.nih.gov/pubmed/24861828?tool=bestpractice.com
El estradiol en dosis bajas pareció ser más eficaz (2.3 veces menos síntomas vasomotores por día que con placebo), pero no se comparó directamente con la venlafaxina en este estudio.[60]Joffe H, Guthrie KA, LaCroix AZ, et al. Low-dose estradiol and the serotonin-norepinephrine reuptake inhibitor venlafaxine for vasomotor symptoms: a randomized clinical trial. JAMA Intern Med. 2014 Jul;174(7):1058-66.
http://archinte.jamanetwork.com/article.aspx?articleid=1876676
http://www.ncbi.nlm.nih.gov/pubmed/24861828?tool=bestpractice.com
La venlafaxina puede ser una alternativa razonable para las mujeres que no pueden tomar un estrógeno.
En comparación con el placebo, la desvenlafaxina (un IRSN) redujo la frecuencia y la gravedad de los sofocos moderados a graves durante un período de 12 meses en un ensayo aleatorio comparativo de 365 mujeres posmenopáusicas con síntomas vasomotores molestos.[61]Pinkerton JV, Archer DF, Guico-Pabia CJ, et al. Maintenance of the efficacy of desvenlafaxine in menopausal vasomotor symptoms: a 1-year randomized controlled trial. Menopause. 2013 Jan;20(1):38-46.
http://www.ncbi.nlm.nih.gov/pubmed/23266839?tool=bestpractice.com
Como consecuencia de las preocupaciones con respecto a la seguridad de la desvenlafaxina en este grupo de población de pacientes, un análisis de seguridad aislado no encontró evidencias de riesgo aumentado de eventos cardiovasculares, cerebrovasculares, ni hepáticos asociados con la desvenlafaxina (en comparación con placebo) para el tratamiento de los síntomas vasomotores menopáusicos.[62]Archer DF, Pinkerton JV, Guico-Pabia CJ, et al. Cardiovascular, cerebrovascular, and hepatic safety of desvenlafaxine for 1 year in women with vasomotor symptoms associated with menopause. Menopause. 2013 Jan;20(1):47-56.
http://www.ncbi.nlm.nih.gov/pubmed/23266840?tool=bestpractice.com
Gabapentina
Los estudios indican que la gabapentina es moderadamente efectiva para el tratamiento de los sofocos.[36]Stuenkel CA, Davis SR, Gompel A, et al. Treatment of symptoms of the menopause: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2015 Nov;100(11):3975-4011.
https://academic.oup.com/jcem/article/100/11/3975/2836060
http://www.ncbi.nlm.nih.gov/pubmed/26444994?tool=bestpractice.com
[63]Hayes LP, Carroll DG, Kelley KW. Use of gabapentin for the management of natural or surgical menopausal hot flashes. Ann Pharmacother. 2011 Mar;45(3):388-94.
http://www.ncbi.nlm.nih.gov/pubmed/21343402?tool=bestpractice.com
Sin embargo, se reportan habitualmente efectos adversos como somnolencia, mareos e inestabilidad.[63]Hayes LP, Carroll DG, Kelley KW. Use of gabapentin for the management of natural or surgical menopausal hot flashes. Ann Pharmacother. 2011 Mar;45(3):388-94.
http://www.ncbi.nlm.nih.gov/pubmed/21343402?tool=bestpractice.com
La gabapentina puede provocar un letargo intolerable cuando se usa durante el día.[36]Stuenkel CA, Davis SR, Gompel A, et al. Treatment of symptoms of the menopause: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2015 Nov;100(11):3975-4011.
https://academic.oup.com/jcem/article/100/11/3975/2836060
http://www.ncbi.nlm.nih.gov/pubmed/26444994?tool=bestpractice.com
Los efectos secundarios pueden mitigarse al dosificar solo por la noche, o al utilizar un régimen de escalada de dosis.
Clonidina
La clonidina, un agente antihipertensivo, reduce los sofocos pero puede ser menos efectiva que los ISRS/IRSN y la gabapentina.[36]Stuenkel CA, Davis SR, Gompel A, et al. Treatment of symptoms of the menopause: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2015 Nov;100(11):3975-4011.
https://academic.oup.com/jcem/article/100/11/3975/2836060
http://www.ncbi.nlm.nih.gov/pubmed/26444994?tool=bestpractice.com
La hipotensión puede ser un efecto adverso que limite el tratamiento.[64]Goldberg RM, Loprinzi CL, O'Fallon JR, et al. Transdermal clonidine for ameliorating tamoxifen-induced hot flashes. J Clin Oncol. 1994 Jan;12(1):155-8.
http://www.ncbi.nlm.nih.gov/pubmed/8270972?tool=bestpractice.com
Debe monitorizarse la presión arterial durante el tratamiento y en el rebote después de la descontinuación del tratamiento. Los parches transdérmicos producen niveles estables en la sangre y son preferibles a los preparados de clonidina oral.[36]Stuenkel CA, Davis SR, Gompel A, et al. Treatment of symptoms of the menopause: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2015 Nov;100(11):3975-4011.
https://academic.oup.com/jcem/article/100/11/3975/2836060
http://www.ncbi.nlm.nih.gov/pubmed/26444994?tool=bestpractice.com
Síntomas de atrofia urogenital
Se pueden considerar los preparados vaginales de estrógeno en dosis bajas en mujeres con síntomas de atrofia urogenital.[17]The North American Menopause Society Advisory Panel. The 2022 hormone therapy position statement of The North American Menopause Society. Menopause. 2022 Jul 1;29(7):767-94.
http://www.ncbi.nlm.nih.gov/pubmed/35797481?tool=bestpractice.com
Una revisión de las bases de datos de Medline y la Cochrane mostró que los estrógenos vaginales son más efectivos que el placebo para mejorar la sequedad y disminuir la dispareunia, la urgencia urinaria y la frecuencia urinaria.[65]Rahn DD, Carberry C, Sanses TV, et al.; Society of Gynecologic Surgeons Systematic Review Group. Vaginal estrogen for genitourinary syndrome of menopause: a systematic review. Obstet Gynecol. 2014 Dec;124(6):1147-56.
http://www.ncbi.nlm.nih.gov/pubmed/25415166?tool=bestpractice.com
Las tasas de infecciones del tracto urinario también disminuyeron con el uso de estrógenos vaginales. Los niveles de estradiol en suero permanecieron dentro de las normas posmenopáusicas, excepto para los casos en que se usaron altas dosis de estrógeno vaginal en crema.[65]Rahn DD, Carberry C, Sanses TV, et al.; Society of Gynecologic Surgeons Systematic Review Group. Vaginal estrogen for genitourinary syndrome of menopause: a systematic review. Obstet Gynecol. 2014 Dec;124(6):1147-56.
http://www.ncbi.nlm.nih.gov/pubmed/25415166?tool=bestpractice.com
En mujeres sin antecedentes de cáncer hormonodependiente, se puede continuar el tratamiento con estrógenos vaginales para el alivio de los síntomas y no existe evidencia alguna que recomiende una vigilancia del endometrio.[30]North American Menopause Society. Management of symptomatic vulvovaginal atrophy: 2013 position statement of the North American Menopause Society. Menopause. 2013 Sep;20(9):888-902.
http://www.menopause.org/docs/default-source/2013/vva-position-statement.pdf?sfvrsn=0
http://www.ncbi.nlm.nih.gov/pubmed/23985562?tool=bestpractice.com
En el estudio observacional del Women's Health Initiative, el riesgo de enfermedad cardiovascular, de cáncer de mama invasivo y de cáncer de endometrio, fue idéntico entre las mujeres que eran usuarias de estrógeno vaginal y las que no lo eran.[66]Crandall CJ, Hovey KM, Andrews CA, et al. Breast cancer, endometrial cancer, and cardiovascular events in participants who used vaginal estrogen in the Women's Health Initiative Observational Study. Menopause. 2018 Jan;25(1):11-20.
http://www.ncbi.nlm.nih.gov/pubmed/28816933?tool=bestpractice.com
Los estrógenos vaginales no requieren reemplazo de progestina.
Los comprimidos vaginales de estradiol no producen una absorción sistémica significativa y se pueden usar a largo plazo, según sea necesario. Sin embargo, en octubre de 2019, la Agencia Europea de Medicamentos (EMA) recomendó limitar el uso de cremas vaginales de estradiol de alta potencia (que contienen 100 microgramos/g o 0.01% de estradiol) a un único período de tratamiento de hasta 4 semanas. Esto se debe a que se encontró que los niveles de estradiol en la sangre eran más elevados que los niveles posmenopáusicos normales y podrían resultar en efectos adversos similares a los observados con la terapia hormonal (TH) sistémica (oral o transdérmica) (p. ej., tromboembolia venosa, accidente cerebrovascular, cáncer endometrial, cáncer de mama). Esta formulación no debe usarse en pacientes que ya están bajo tratamiento con TH.[67]European Medicines Agency. Four-week limit for use of high-strength estradiol creams. Press release. Oct 2019 [internet publication].
https://www.ema.europa.eu/en/news/four-week-limit-use-high-strength-estradiol-creams
Por lo tanto, se pueden preferir otras formulaciones de estrógenos vaginales (p. ej., estrógenos conjugados en crema, comprimidos y anillos intravaginales de estradiol). No existen evidencias que sugieran que un preparado estrogénico vaginal sea más eficaz que otro.[68]Lethaby A, Ayeleke RO, Roberts H. Local oestrogen for vaginal atrophy in postmenopausal women. Cochrane Database Syst Rev. 2016 Aug 31;(8):CD001500.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001500.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/27577677?tool=bestpractice.com
El ospemifeno es un modulador selectivo de los receptores de estrógeno indicado para el tratamiento de la dispareunia en mujeres posmenopáusicas. En un ensayo de fase III, el ospemifeno aumentó el porcentaje de células superficiales y redujo la dispareunia en comparación con el placebo.[69]Portman DJ, Bachmann GA, Simon JA. Ospemifene, a novel selective estrogen receptor modulator for treating dyspareunia associated with postmenopausal vulvar and vaginal atrophy. Menopause. 2013 Jun;20(6):623-30.
http://www.ncbi.nlm.nih.gov/pubmed/23361170?tool=bestpractice.com
Los sofocos fueron el evento adverso más frecuentemente reportado (ospemifeno 7% frente a placebo 4%).[69]Portman DJ, Bachmann GA, Simon JA. Ospemifene, a novel selective estrogen receptor modulator for treating dyspareunia associated with postmenopausal vulvar and vaginal atrophy. Menopause. 2013 Jun;20(6):623-30.
http://www.ncbi.nlm.nih.gov/pubmed/23361170?tool=bestpractice.com
[70]Palacios S, Cancelo MJ. Clinical update on the use of ospemifene in the treatment of severe symptomatic vulvar and vaginal atrophy. Int J Womens Health. 2016 Oct 26;8:617-26.
https://www.dovepress.com/clinical-update-on-the-use-of-ospemifene-in-the-treatment-of-severe-sy-peer-reviewed-fulltext-article-IJWH
http://www.ncbi.nlm.nih.gov/pubmed/27822125?tool=bestpractice.com
Sobrevivientes de cáncer de mama y cáncer ginecológico
Las recomendaciones consensuadas para el tratamiento de los síntomas de la menopausia después del cáncer de mama incluyen:[71]Santen RJ, Stuenkel CA, Davis SR, et al. Managing menopausal symptoms and associated clinical issues in breast cancer survivors. J Clin Endocrinol Metab. 2017 Oct 1;102(10):3647-61.
http://www.ncbi.nlm.nih.gov/pubmed/28934376?tool=bestpractice.com
[72]American College of Obstetricians and Gynecologists. Clinical consensus no. 2: treatment of urogenital symptoms in individuals with a history of estrogen-dependent breast cancer. Dec 2021 [internet publication].
https://www.acog.org/clinical/clinical-guidance/clinical-consensus/articles/2021/12/treatment-of-urogenital-symptoms-in-individuals-with-a-history-of-estrogen-dependent-breast-cancer
En general, evitar el tratamiento con hormonoterapia menopáusica sistémica o estrógeno vaginal*.
Implementar medidas relativas al estilo de vida (p.ej., una dieta saludable, actividad física regular, abandono del tabaquismo, pérdida de peso, limitación o evitación del alcohol y mantenimiento de niveles adecuados de vitamina D y calcio).
Terapia no hormonal, farmacológica (p.ej., inhibidores selectivos de la recaptación de serotonina/noradrenalina) y/o terapia cognitivo-conductual.
*Existen datos que sugieren que la hormonoterapia no aumenta el riesgo de recurrencia en mujeres que no presentan neoplasia maligna estrógeno dependiente.[73]Del Carmen MG, Rice LW. Management of menopausal symptoms in women with gynecologic cancers. Gynecol Oncol. 2017 Aug;146(2):427-35.
http://www.ncbi.nlm.nih.gov/pubmed/28625396?tool=bestpractice.com
[74]O'Donnell RL, Clement KM, Edmondson RJ. Hormone replacement therapy after treatment for a gynaecological malignancy. Curr Opin Obstet Gynecol. 2016 Feb;28(1):32-41.
http://www.ncbi.nlm.nih.gov/pubmed/26626038?tool=bestpractice.com
Una revisión sugirió que el uso a corto plazo de la hormonoterapia puede resultar en una mejoría de los síntomas menopáusicos, tanto vasomotores como genitourinarios, en pacientes con cáncer ginecológico que no presentan neoplasia maligna estrógeno-dependiente.[73]Del Carmen MG, Rice LW. Management of menopausal symptoms in women with gynecologic cancers. Gynecol Oncol. 2017 Aug;146(2):427-35.
http://www.ncbi.nlm.nih.gov/pubmed/28625396?tool=bestpractice.com
El uso de estrógenos en mujeres con neoplasia maligna no dependiente de estrógenos debe ajustarse a la situación de la paciente.
El gel policarbófilo, un humectante vaginal, también se puede ofrecer como tratamiento eficaz para los síntomas de la atrofia vaginal, como la sequedad y la dispareunia.[75]Goetsch MF, Lim JY, Caughey AB. Locating pain in breast cancer survivors experiencing dyspareunia: a randomized controlled trial. Obstet Gynecol. 2014 Jun;123(6):1231-6.
http://www.ncbi.nlm.nih.gov/pubmed/24807329?tool=bestpractice.com
[76]Reid R, Abramson BL, Blake J, et al. Managing menopause. J Obstet Gynaecol Can. 2014 Sep;36(9):830-3.
https://www.jogc.com/article/S1701-2163(15)30487-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/25222364?tool=bestpractice.com
La dispareunia es común en las sobrevivientes de cáncer de mama debido a la atrofia y la sequedad por falta de estrógeno. En un pequeño ensayo, la lidocaína redujo la sensibilidad en el vestíbulo vulvar de las sobrevivientes de cáncer de mama posmenopáusicas con dispareunia (puntuación media de dolor coital de 8 en una escala de 10 puntos), en comparación con la solución salina normal.[75]Goetsch MF, Lim JY, Caughey AB. Locating pain in breast cancer survivors experiencing dyspareunia: a randomized controlled trial. Obstet Gynecol. 2014 Jun;123(6):1231-6.
http://www.ncbi.nlm.nih.gov/pubmed/24807329?tool=bestpractice.com
Se han aprobado la dehidroepiandrosterona intravaginal (DHEA) y el ospemifeno oral para el tratamiento de la dispareunia, pero no se ha determinado su seguridad tras cáncer de mama.[71]Santen RJ, Stuenkel CA, Davis SR, et al. Managing menopausal symptoms and associated clinical issues in breast cancer survivors. J Clin Endocrinol Metab. 2017 Oct 1;102(10):3647-61.
http://www.ncbi.nlm.nih.gov/pubmed/28934376?tool=bestpractice.com
Disminución de la libido
A las mujeres con un nivel preocupante de bajo deseo sexual y de cansancio físico se les debe aconsejar la suplementación con andrógenos como una opción, particularmente si no ha sido efectivo un estrógeno con o sin progestina.
La Endocrine Society de los EE. UU. recomienda no diagnosticar la deficiencia de andrógenos en mujeres menopáusicas sanas debido a la falta de un síndrome bien definido y no se dispone de datos que correlacionen los niveles de andrógenos con signos o síntomas específicos.[77]Wierman ME, Arlt W, Basson R, et al. Androgen therapy in women: a reappraisal: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2014 Oct;99(10):3489-510.
https://academic.oup.com/jcem/article/99/10/3489/2836272
http://www.ncbi.nlm.nih.gov/pubmed/25279570?tool=bestpractice.com
Consulte Disfunción sexual en mujeres.
Incontinencia urinaria de estrés
La rehabilitación del suelo pélvico puede ser útil para la incontinencia urinaria de estrés.[78]Dumoulin C, Cacciari LP, Hay‐Smith EJC. Pelvic floor muscle training versus no treatment, or inactive control treatments, for urinary incontinence in women. Cochrane Database Syst Rev. 2018 Oct 4;(10):CD005654.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD005654.pub4/full?highlightAbstract=floor%7Cpelvic
En un estudio, el 73.4% de las mujeres posmenopáusicas seleccionadas de forma aleatoria para una combinación de estriol intravaginal y rehabilitación del suelo pélvico durante 6 meses experimentaron una mejoría subjetiva en la incontinencia urinaria de estrés, en comparación con sólo el 9.71% de las mujeres del grupo control (sólo con estriol).[79]Capobianco G, Donolo E, Borghero G, et al. Effects of intravaginal estriol and pelvic floor rehabilitation on urogenital aging in postmenopausal women. Arch Gynecol Obstet. 2012 Feb;285(2):397-403.
http://www.ncbi.nlm.nih.gov/pubmed/21706345?tool=bestpractice.com
Ambos grupos señalaron mejorías en los signos y síntomas de la atrofia urogenital.
Alteraciones del sueño y síntomas en el estado de ánimo
Durante la menopausia, es común sufrir problemas tales como dificultad para dormir, o falta de descanso nocturno e interrupciones del sueño. El insomnio a menudo se asocia con sofocos (otros factores, como la depresión o la apnea del sueño, también pueden estar involucrados) Pero ningún estudio ha mostrado una relación fisiológica directa.
Algunas mujeres reportan que su sueño mejoró durante la hormonoterapia.[17]The North American Menopause Society Advisory Panel. The 2022 hormone therapy position statement of The North American Menopause Society. Menopause. 2022 Jul 1;29(7):767-94.
http://www.ncbi.nlm.nih.gov/pubmed/35797481?tool=bestpractice.com
[80]Freedman RR. Pathophysiology and treatment of menopausal hot flashes. Semin Reprod Med. 2005 May;23(2):117-25.
http://www.ncbi.nlm.nih.gov/pubmed/15852197?tool=bestpractice.com
En una revisión sistemática de 11 estudios de calidad variable, la progesterona mejoró los síntomas vasomotores y la calidad del sueño.[81]Spark MJ, Willis J. Systematic review of progesterone use by midlife and menopausal women. Maturitas. 2012 Jul;72(3):192-202.
http://www.ncbi.nlm.nih.gov/pubmed/22541358?tool=bestpractice.com
Datos de un estudio sugieren que el uso a corto plazo de la hormonoterapia puede mejorar el estado de ánimo y los síntomas depresivos durante la transición menopáusica y la menopausia temprana, pero los resultados del estudio son inconsistentes.[82]Gordon JL, Girdler SS. Hormone replacement therapy in the treatment of perimenopausal depression. Curr Psychiatry Rep. 2014 Dec;16(12):517.
http://www.ncbi.nlm.nih.gov/pubmed/25308388?tool=bestpractice.com
[83]Veerus P, Hovi SL, Sevón T, et al. The effect of hormone therapy on women's quality of life in the first year of the Estonian Postmenopausal Hormone Therapy trial. BMC Res Notes. 2012 Apr 3;5:176.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3349465
http://www.ncbi.nlm.nih.gov/pubmed/22472039?tool=bestpractice.com
Existe evidencia que sugiere que la terapia cognitivo-conductual (TCC) puede tener una función beneficiosa en el tratamiento del estado de ánimo bajo y de la ansiedad en mujeres con síntomas menopáusicos después del tratamiento del cáncer de mama.[84]Mann E, Smith MJ, Hellier J, et al. Cognitive behavioural treatment for women who have menopausal symptoms after breast cancer treatment (MENOS 1): a randomised controlled trial. Lancet Oncol. 2012 Mar;13(3):309-18.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3314999
http://www.ncbi.nlm.nih.gov/pubmed/22340966?tool=bestpractice.com
Faltan evidencias de buena calidad relacionadas con la terapia cognitiva conductual (TCC) específicamente en mujeres con depresión asociada a la menopausia temprana, pero dado el bajo riesgo de daño y la sólida base de evidencias para el tratamiento de la depresión en la población general, es una opción razonable en mujeres perimenopáusicas con depresión.[85]Maki PM, Kornstein SG, Joffe H, et al; Board of Trustees for The North American Menopause Society (NAMS) and the Women and Mood Disorders Task Force of the National Network of Depression Centers. Guidelines for the evaluation and treatment of perimenopausal depression: summary and recommendations. Menopause. 2018 Oct;25(10):1069-85.
https://journals.lww.com/menopausejournal/Fulltext/2018/10000/Guidelines_for_the_evaluation_and_treatment_of.5.aspx
http://www.ncbi.nlm.nih.gov/pubmed/30179986?tool=bestpractice.com
Aunque la hormonoterapia u otras alternativas pueden mejorar los patrones de sueño, es necesario realizar una evaluación detallada de otros factores subyacentes que puedan precisar un tratamiento dirigido. Los trastornos del estado de ánimo, sobre todo la depresión, suelen mejorar con la hormonoterapia, aunque los antidepresivos convencionales pueden ser más eficaces.[86]Cohen LS, Soares CN, Joffe H. Diagnosis and management of mood disorders during the menopausal transition. Am J Med. 2005 Dec 19;118(suppl 12B):93-7.
http://www.ncbi.nlm.nih.gov/pubmed/16414333?tool=bestpractice.com
Las mujeres con síntomas de depresión severa deben derivarse para una evaluación de salud mental.
Terapias alternativas o herbarias
En una revisión de la Cochrane de 43 ensayos aleatorios controlados que incluían fitoestrógenos se observó que hubo un enorme efecto placebo (del 1% al 59%) en la mayoría de los ensayos.[87]Lethaby A, Marjoribanks J, Kronenberg F, et al. Phytoestrogens for menopausal vasomotor symptoms. Cochrane Database Syst Rev. 2013 Dec 10;(12):CD001395.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001395.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/24323914?tool=bestpractice.com
Esta y otras revisiones no han hallado pruebas concluyentes de que los fitoestrógenos, incluidas las isoflavonas, son efectivos para el tratamiento de los síntomas vasomotores menopáusicos.[34]American College of Obstetricians and Gynecologists. Practice bulletin no. 141: management of menopausal symptoms. Jan 2014 [internet publication].
https://www.acog.org/clinical/clinical-guidance/practice-bulletin/articles/2014/01/management-of-menopausal-symptoms
[87]Lethaby A, Marjoribanks J, Kronenberg F, et al. Phytoestrogens for menopausal vasomotor symptoms. Cochrane Database Syst Rev. 2013 Dec 10;(12):CD001395.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001395.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/24323914?tool=bestpractice.com
[88]Sacks FM, Lichtenstein A, Van Horn L, et al; American Heart Association Nutrition Committee. Soy protein, isoflavones, and cardiovascular health: an American Heart Association Science Advisory for professionals from the Nutrition Committee. Circulation. 2006 Feb 21;113(7):1034-44.
http://circ.ahajournals.org/content/113/7/1034.long
http://www.ncbi.nlm.nih.gov/pubmed/16418439?tool=bestpractice.com
No se ha demostrado que la acupuntura, ni la reflexología mejoren significativamente los síntomas vasomotores en comparación con el placebo.[34]American College of Obstetricians and Gynecologists. Practice bulletin no. 141: management of menopausal symptoms. Jan 2014 [internet publication].
https://www.acog.org/clinical/clinical-guidance/practice-bulletin/articles/2014/01/management-of-menopausal-symptoms


